2019 年《世界卫生组织消化系统肿瘤分类》(第5 版)胰腺上皮性肿瘤解读
2021-01-26王朝夫
王 婷,袁 菲,王朝夫
(上海交通大学医学院附属瑞金医院病理科,上海 200025)
2019 年 《世界卫生组织消化系统肿瘤分类》(第5 版)(以下简称2019 版分类) 于2019 年6 月正式公布。2019 版分类总结了过去近10 年的研究成果,对每一种消化系统肿瘤类型进行了多方面的系统介绍,包括肿瘤的发生部位、临床特征、流行病学、病因学、发病机制、组织病理学、诊断性分子病理学、肿瘤分期和肿瘤预后等。该分类将胰腺肿瘤分为良性上皮性肿瘤及癌前病变、恶性上皮性肿瘤、胰腺神经内分泌肿瘤三大部分。相较于2010 版分类,2019 版分类将胰腺淋巴造血系统肿瘤、软组织肿瘤及转移性肿瘤与消化系统其他部位类似的肿瘤合并后,分为消化系统淋巴造血源性肿瘤和消化系统间叶源性肿瘤2 个独立的章节。本文主要对2019 版分类中胰腺上皮性肿瘤方面的新增内容和修订内容进行总结、分析和比较,以期能更好地指导临床实践。更新内容具体包括:①胰腺腺泡细胞囊腺瘤的更名;②胰腺上皮内瘤变重新分级;③胰腺导管内乳头状黏液性肿瘤(嗜酸细胞亚型)独立命名;④新增2 种胰腺导管腺癌的特殊组织学亚型;⑤新的胰腺神经内分泌肿瘤分类标准等[1]。
胰腺上皮性肿瘤中新增及变化的病种
一、良性上皮性肿瘤及癌前病变
2019 版分类中将胰腺良性上皮性肿瘤、癌前病变及其对应的恶性肿瘤列举在一起,合并为“良性上皮性肿瘤及癌前病变”共同阐述,便于读者理解这类疾病的内在机制和进展过程(见表1)。胰腺导管腺癌主要的癌前病变包括胰腺上皮内瘤变、胰腺导管内乳头状黏液性肿瘤和胰腺黏液性囊性肿瘤。胰腺浆液性囊腺癌目前仅在胰腺浆液性囊腺瘤发生远处转移时,方可诊断。
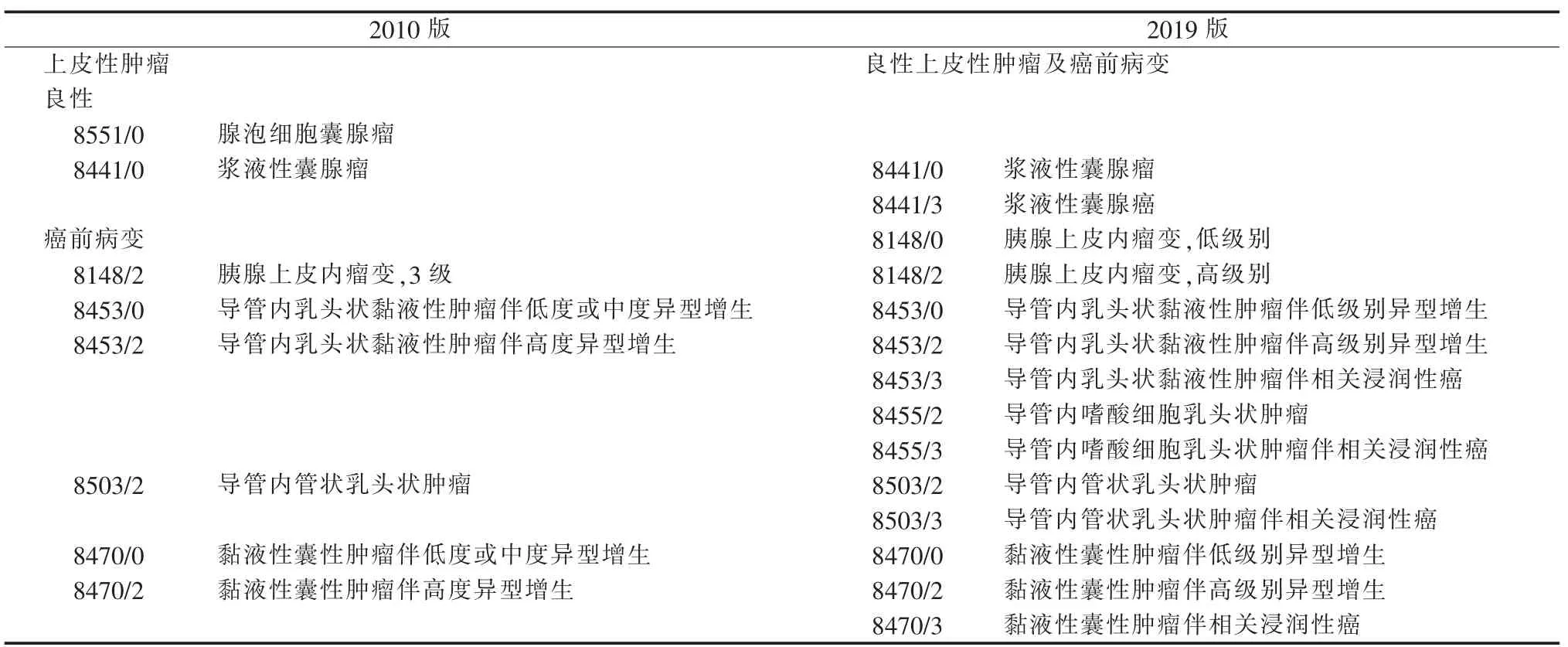
表1 2010 版与2019 版分类中胰腺良性上皮性肿瘤及癌前病变分类对比
1.胰腺腺泡囊性转化:2010 版分类中原有的胰腺腺泡细胞囊腺瘤在2019 版分类中更名为 “胰腺腺泡囊性转化”。2013 年一项针对8 例胰腺腺泡囊腺瘤患者的分子研究,仅在1 例病变中发现染色体的扩增,而5 例病变中出现X 染色体随机失活,这一结果支持该类病变是非肿瘤性病变。胰腺腺泡囊性转化的发病率低,目前国内外相关报道少于50 例。患者的发病年龄为9~83 岁(平均年龄为43 岁),男女间的发病比例为3∶1。该类患者缺乏特异性的临床表现,部分患者为偶然发现。手术标本肉眼检查,为多房或单房的囊性肿块,直径1.5~19.7 cm(平均直径为5.8 cm),囊壁菲薄,充满透明液体,几乎不与主胰管相通。标本组织切片在显微镜下观察,可见囊壁内衬1~2 层上皮,上皮细胞核位于基底部,靠近顶端的细胞质染色较淡或呈颗粒状;囊壁间可见残留的胰腺组织。免疫组织化学(免疫组化)检测结果示,囊壁内衬的上皮细胞有胰腺腺泡(胰蛋白酶阳性,糜蛋白酶阳性,BCL10 阳性)和导管(CK19 阳性)分化表现。研究已证实,胰腺腺泡囊性转化为良性临床经过,无复发或向恶性转化的风险,也不与胰腺腺泡细胞癌相关[1-2]。本次更名的意义在于明确胰腺腺泡囊性转化是非肿瘤性的良性病变,具有指导临床避免过度治疗的作用[1-2]。
2.胰腺上皮内瘤变:2019 版分类将原有的3 级胰腺上皮内瘤变重新划分为2 级,即低级别胰腺上皮内瘤变(原1 级、2 级)和高级别胰腺上皮内瘤变(原3 级),后者是胰腺导管腺癌的主要癌前病变。胰腺上皮内瘤变在手术标本肉眼检查中不易被发现,而主要依赖于显微镜下观察。低级别与高级别胰腺上皮内瘤变的形态结构特征见表2,两者的诊断取决于组织形态和细胞形态级别中更高的一级。免疫组化检测结果显示,无论是低级别还是高级别胰腺上皮内瘤变均可以表达上皮细胞膜抗原(epithelial membrane antigen,EMA)、黏蛋白(mucoprotein,MUC)1、MUC4 和MUC5AC,不表达MUC2;低级别胰腺上皮内瘤变呈幽门腺化生时可以表达MUC6;高级别胰腺上皮内瘤变还可以异常表达癌胚抗原(carcinoembryonic antigen,CEA,细胞质定位)和B72.3,同时缺乏TP53 基因突变和SMAD-4 失活表现,以此可与胰腺导管腺癌相鉴别。临床上,低级别胰腺上皮内瘤变很常见,且临床意义不大;而高级别胰腺上皮内瘤变则提示患者高度可能存在浸润性癌,需要广泛、充分地取材以寻找是否存在浸润性癌成分。病理科医师在出具病理报告时应提醒临床医师注意,特别是在手术切除标本中未发现浸润性癌,但发现高级别胰腺上皮内瘤变时(尤其是位于切缘处),需要提醒外科医师切除更多的胰腺组织,以便进一步寻找是否存在浸润性癌成分[1]。
3.胰腺导管内乳头状黏液性肿瘤:2019 版分类中对胰腺导管内乳头状黏液性肿瘤的修改较多,主要表现在以下几个方面。①肿瘤定义中将原有的“典型的肉眼可见病变直径≥1.0 cm”修改为“典型的肉眼可见病变直径>0.5 cm”。②将原有的“导管内乳头状黏液性肿瘤伴低度或中度异型增生”修改为 “导管内乳头状黏液性肿瘤伴低级别异型增生(ICD-O 编码为8453/0)”,维持原有的“导管内乳头状黏液性肿瘤伴高级别异型增生 (ICD-O 编码为8453/2)”。③以往认为导管内乳头状黏液性肿瘤包括胃型、肠型、嗜酸细胞型和胰胆管型4 种形态学亚型,而2019 版分类中将嗜酸细胞型独立命名为导管内嗜酸细胞乳头状肿瘤(ICD-O 编码为8455/2),相当于原位癌;同时当肿瘤伴有浸润性癌成分时,2019 版分类中将其称为导管内嗜酸细胞乳头状肿瘤伴相关浸润性癌(ICD-O 编码为8455/3)。这样重新分类是基于肿瘤分子机制的研究结果。目前研究认为,其他3 种亚型的导管内乳头状黏液性肿瘤中常见的基因异常为Kras、GNAS 和RNF43 基因突变,但导管内嗜酸细胞乳头状肿瘤并没有这些改变,而在有限的几例病例研究中发现了ARHGAP26、ASXL1、EPHA8 和ERBB4 基因突变[1]。
导管内嗜酸细胞乳头状肿瘤占胰腺所有导管内肿瘤的4.5%,患者的发病年龄为36~87 岁(平均年龄为59 岁),女性多见,70%发生在胰头,并与主胰管相关。肉眼观察手术标本,通常可见扩张的主胰管内有大的棕褐色乳头状突起或实性结节,肿瘤平均直径为5.5 cm。在显微镜下观察,可见肿瘤为复杂分支状的乳头形态,且伴有纤细的纤维血管轴心;乳头衬覆2~5 层立方或柱状上皮,细胞呈高度异型性,细胞质内富含嗜酸性颗粒,细胞核大而圆,核仁明显;上皮间常穿插有杯状细胞,上皮间及间质中有中性粒细胞浸润;约30%的导管内嗜酸细胞乳头状肿瘤伴有浸润性癌成分。免疫组化检测显示,肿瘤细胞表达EMA、MUC1、MUC6 和Hep Par-1,穿插的杯状细胞表达MUC2 和MUC5AC[1,3]。

表2 胰腺上皮内瘤变的形态学特征
2019 版分类中强调了胰腺导管内乳头状黏液性肿瘤必须是肉眼可见的病变,且直径>0.5 cm。当胰管上皮呈乳头状增生,但病变肉眼不可见,且直径<0.5 cm 时,则需诊断为胰腺上皮内瘤变。区别两者的重要性在于,导管内乳头状黏液性肿瘤可以呈多灶性或异时性发生,手术切除肿瘤的患者需要接受密切随访。此外,有学者认为几乎所有的胰腺上皮内瘤变细胞均为胃型分化,所以当胰腺导管上皮呈肠型分化时,通常应诊断为胰腺导管内乳头状黏液性肿瘤。也有研究者提出了“初期导管内乳头状黏液性肿瘤”或是“初期导管内嗜酸细胞乳头状肿瘤”的概念,指病变直径为0.5~1.0 cm 且胰管上皮增生成长的指状乳头,或是细胞呈肠型、嗜酸细胞型,或是细胞出现GNAS 突变[1]。
值得注意的是,2019 版分类推荐,当黏液性囊肿缺乏导管内乳头状黏液性肿瘤或是黏液性囊性肿瘤的形态特征,同时没有明显的胰管梗阻证据时,则应诊断为单纯黏液囊肿[1]。
4.胰腺黏液性囊性肿瘤:与胰腺导管内乳头状黏液性肿瘤相似,2019 版分类中针对胰腺黏液性囊性肿瘤的分级,根据囊壁内衬上皮不典型性级别分级,将原有的3 级分类更改为2 级分类,其中将原有的轻度和中度异型合并为黏液性囊性肿瘤伴低级别异型增生(ICD-O 编码为8470/0),并维持原有的黏液性囊性肿瘤伴高级别异型增生(ICD-O 编码为8470/2)。这样的更新简化了肿瘤诊断,便于病理医师掌握,也与患者的预后相关,前者生物学行为相当于良性肿瘤,后者生物学行为相当于原位癌[1]。
二、恶性上皮性肿瘤
2019 版分类中对于胰腺恶性上皮性肿瘤的内容更新主要集中在神经内分泌肿瘤,其余恶性肿瘤相关内容的变化不大。
1.胰腺导管腺癌:2019 版分类中对胰腺导管腺癌的介绍在保留了2010 版的大部分内容的基础上,增加了大细胞癌伴横纹肌样表型和浸润性微乳头状癌这2 种新的特殊组织学亚型(见表3)。2010版分类中大细胞癌伴横纹肌样表型属于胰腺未分化癌,而2019 版分类中将其独立出来,但并未详细描述。已有的病例报道显示,该组织学亚型的患者发病年龄为44~96 岁(平均年龄为65 岁),男女发病比例接近1∶1;肿瘤最大径为4~22 cm,主要位于胰体尾部。显微镜下观察,可见肿瘤细胞为多形性或单形间变样,细胞质红染,有横纹肌样特征,偶有内含物;细胞核呈泡状,核仁明显;局灶可见腺管样结构。肿瘤细胞表达CK 和波形蛋白,不表达E-cadherin。肿瘤分子改变包括SMARCB1(INI 1)核表达缺失和Kras 扩增。该类肿瘤具有抗药性,患者预后差。浸润性微乳头状癌诊断标准为,胰腺导管腺癌中≥50%肿瘤组织呈微乳头状结构。原发于胰腺的浸润性乳头状癌发病率低,关于其临床特征目前尚未有明确报道。有研究报道了313 例胰腺癌患者中有8 例肿瘤组织含有至少20%的浸润性微乳头状癌成分,其中2 例患者浸润性微乳头状癌成分≥80%,4 例患者浸润性微乳头状癌成分为51%~80%,2 例患者含有局灶性浸润性微乳头癌成分(20%~50%)。这8 例患者的发病年龄为60~80 岁,其中男性3 例,女性5 例,肿瘤最大径为2.0~4.5 cm,有6 例患者出现淋巴结转移,预后较差。显微镜下观察,见缺乏纤维血管轴心的小而紧密的微乳头状簇位于组织裂隙中,细胞呈中-高度异型[4-9]。

表3 胰腺导管腺癌的特殊组织学亚型和诊断要点
2.胰腺实性假乳头状肿瘤:2019 版分类的胰腺实性假乳头状肿瘤中增加了新的组织学亚型——实性假乳头状肿瘤伴高级别癌,即在传统的胰腺实性假乳头状肿瘤上出现高级别恶性转化,通常肿瘤细胞呈弥漫成片分布,细胞异型性更高,核分裂象更多。有研究报道了106 例胰腺实性假乳头状肿瘤病例,其中17 例出现高级别恶性转化(16.0%),中位随访56.9 个月后,2 例实性假乳头状肿瘤伴高级别癌的患者在淋巴结和肝脏有肿瘤复发的迹象,提示患者预后不良[1,7]。
3.胰腺神经内分泌肿瘤 (pancreatic neuroendocrine tumor,PanNET):2019 版分类中PanNET 较2010 版分类更新最为明显,按照无功能性胰腺神经内分泌肿瘤 (non-functioning pancreatic neuroendocrine tumor,NF-PanNET)、功能性神经内分泌肿瘤(functioning pancreatic neuroendocrine tumor,F-Pan-NET)、胰腺神经内分泌癌 (pancreatic neuroendocrine carcinoma,PanNEC)和胰腺混合性神经内分泌-非神经内分泌肿瘤 (pancreatic mixed neuroendocrine-non-neuroendocrine neoplasm,PanMiNEN)的顺序,用较多篇幅介绍了PanNET,并遵循2017 年版世界卫生组织胰腺内分泌肿瘤的分类标准进行分类(见表4)。这种分类较2010 版分类的区别主要在于2 点。①将以往无法归类的高增殖活性的PanNET (该类肿瘤组织形态学分化良好,Ki-67 指数大于20%)归类于PanNET G3。②将以往常用的混合性腺神经内分泌癌更名为PanMiNEN,前者只包括腺癌合并神经内分泌肿瘤的情况,而后者还包括其他非神经内分泌肿瘤合并神经内分泌肿瘤的情况,如腺泡细胞癌等。2019 版分类除了体现PanNET 与PanNEC 间的肿瘤细胞分化程度、核分裂象计数、Ki-67 指数和预后差异(PanNET 患者5 年、10 年、20 年的总体生存率分别为33%、17%及10%,PanNEC 患者很少存活超过1 年)外,更重要的是两者间的分子病理改变有明显区别。PanNET(G1、G2、G3)主要分子事件包括MEN1、DAXX、ATRX、SETD2、PTEN、TSC1/2 基因的失 活和PI3K/mTOR通路的过度活化等,而PanNEC 则主要为体细胞基因改变,包括TP53、RB1、CDKN2A 等。此外,当PanNET(G3)患者出现转移性的疾病进展时,可能出现TP53 基因突变[1]。
此外,需要注意两个容易混淆的诊断名词“高分化”和“高级别”。“高分化”指的是神经内分泌肿瘤细胞轻-中度不典型,有器官样结构,缺乏坏死且通常弥漫或强表达神经内分泌标志物[突触蛋白(synapsin,Syn) 和嗜铬粒蛋白A (chromogranin A,CgA)]。PanNET G1、G2、G3 均为“高分化神经内分泌肿瘤”。“高级别”则是指肿瘤细胞核分裂象计数>20 个/2 mm2和 (或)Ki-67 指数>20%。PanNET G3和PanNEC(小细胞型和大细胞型)都是“高级别神经内分泌肿瘤”。
(1)NF-PanNET:2019 版分类中NF-PanNET 的定义强调了以下5 点内容。①属于高分化神经内分泌肿瘤;②肿瘤最大径≥0.5 cm;③缺乏特异性激素综合征;④当NF-PanNET 最大径<0.5 cm 时,即为微腺瘤;⑤多发性(常难以计数)微腺瘤即为微腺瘤病。NF-PanNET 较F-PanNET 更为常见,约占所有胰腺神经内分泌肿瘤的60%。虽然临床上NFPanNET 患者缺乏功能性激素综合征,但其肿瘤细胞仍可以不同比例、不同程度地表达激素标志物,通常为胰高血糖素、胰多肽和生长抑素。而微腺瘤可以弥漫表达某一种激素标志物,如胰高血糖素或胰多肽。此外,NF-PanNET 表达转录因子胰岛素基因增强子蛋白1,可以用来提示转移性神经内分泌肿瘤为胰腺来源。NF-PanNET 肿瘤细胞常表现为细胞膜的生长抑素受体2A 强表达。

表4 PanNET 分类和分级标准
(2)F-PanNET:F-PanNET 是一类由产生相应激素的细胞构成的恶性肿瘤,可导致患者出现无法控制的激素分泌和对应的临床综合征。2019 版分类从肿瘤的发生部位、临床特征、流行病学、病因学、发病机制、组织病理学、诊断性分子病理学、肿瘤分期和预后等多方面详细介绍了几种常见的F-PanNET,包括胰岛素瘤、胃泌素瘤、胰高血糖素瘤、生长抑素瘤、血管活性肠肽瘤、产五羟色胺瘤、产促肾上腺皮质激素瘤等,为临床医师和病理医师熟悉这类肿瘤提供依据。
(3)PanNEC:PanNEC 是一类伴有神经内分泌分化的高级别恶性肿瘤,包括小细胞型和大细胞型。虽然PanNEC 诊断标准中要求Ki-67 指数>20%,但实际病例中Ki-67 通常为60%~80%,而当Ki-67<40%时就必须谨慎诊断。此外,PanNEC 肿瘤细胞中SSTR2 和SSTR5 通常为阴性,有助于其与PanNET 间的鉴别。
(4)PanMiNEN:该肿瘤由不同分化类型的肿瘤构成,包括神经内分泌肿瘤和非神经内分泌肿瘤(如导管腺癌、腺泡细胞癌),每种肿瘤成分的百分比均需≥30%。除了根据组织学形态区分各类肿瘤成分外,免疫组化检测是非常重要的辅助手段。通常神经内分泌肿瘤表达Syn、CgA,导管腺癌表达CEA、EMA、MUC1、MUC2,腺泡细胞癌表达胰蛋白酶、糜蛋白酶、BCL10[1]。
胰腺肿瘤TNM 临床分类和分期变化
2019 版分类中对胰腺肿瘤的TNM 临床分类和分期有2 种,一种针对外分泌胰腺癌和高级别胰腺神经内分泌肿瘤(包括PanNET G3、PanNEC)(见表5、6),另一种针对高分化胰腺神经内分泌瘤(PanNET G1 和G2)(见表7、8)。与2010 年版分类相比,2019 版分类强调了原发肿瘤最大径、局部淋巴结转移数目与临床分类及分期的相关性,主要体现在以下几个方面。①T2期由原来的“肿瘤局限于胰腺组织内,最大径>2 cm” 修改为“2 cm<肿瘤最大径≤4 cm”;②T3期由“肿瘤超出胰腺组织”修改为“肿瘤最大径>4 cm”;③N1期由“局部有淋巴结转移”修改为“局部有1~3 个淋巴结转移”,新增加了以“局部有≥4 个淋巴结转移”为N2期的情况;④在肿瘤临床Ⅲ期除了保留原有的 “T 为T4,N 为任何N,M 为M0”的情况以外,新增加了“T 为T1、T2、T3,N为N2,M 为M0”的情况。

表5 2010 版和2019 版胰腺肿瘤TNM 临床分类对比

表6 2019 版分类胰腺肿瘤临床分期
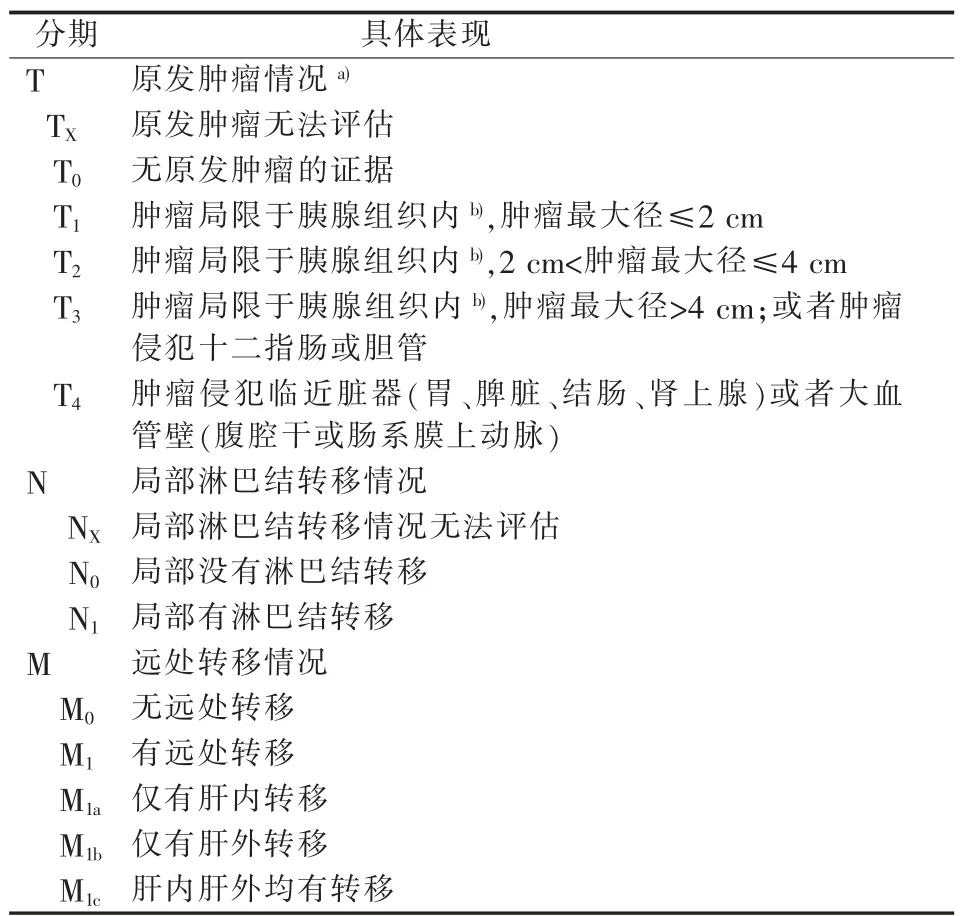
表7 2019 版分类胰腺高分化神经内分泌瘤(G1 和G2)TNM 临床分类
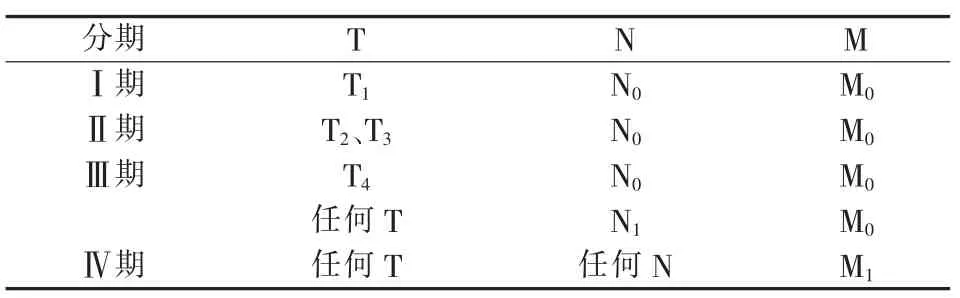
表8 2019 版分类胰腺高分化神经内分泌瘤(G1 和G2)临床分期
此外,值得注意的是,对于胰腺肿瘤的癌前病变(包括导管内乳头状黏液性肿瘤、导管内嗜酸细胞乳头状肿瘤、导管内管状乳头状肿瘤和黏液性囊性肿瘤等)伴相关浸润性癌的临床分类,原发肿瘤情况(T)评价的不是癌前病变肿瘤的最大径,而是其浸润性癌的最大径。针对这一情况,2019 版分类也将T1(肿瘤最大径≤2 cm)定义为早期浸润,并细分为T1a(肿瘤最大径≤0.5 cm)、T1b(0.5 cm<肿瘤最大径≤1 cm)、T1c(1 cm<肿瘤最大径≤2 cm),提示这三者间预后可能存在差异[1]。但当浸润性癌为相互不连续的多灶浸润时,如何评价肿瘤的临床分类和分期,2019 版分类中未有提及,还需要临床医师在诊断中积累经验,提出新的观点。
总 结
总之,2019 版WHO 胰腺肿瘤分类在疾病的命名、分类、分级、临床分期等方面有较大的变化,更新了肿瘤发生、发展的分子机制研究成果,为临床医师准确认识疾病提供了重要的参考资料。
