可视化细胞色素b5蛋白的显色核心片段解析
2021-01-26展恩玲盛成旺陈煜明唐涛赵春青
展恩玲,盛成旺,陈煜明,唐涛,赵春青*
(1.南京农业大学植物保护学院,江苏 南京 210095;2.湖南省农业科学院植物保护研究所,湖南 长沙 410125)
蛋白指示标签,包括短肽、表位标记、折叠蛋白标记和非色谱标记等,作为一种重要的生物分子研究辅助工具已被广泛应用,并大幅度简化蛋白质的异源重组表达和纯化过程[1-2]。其中,常用的可视化蛋白标签多为荧光蛋白,如绿色荧光蛋白(green fluorescent protein,GFP)、黄色荧光蛋白(yellow fluorescent protein,YFP)和单体红色荧光蛋白(monomeric red fluorescent protein,mRFP)等。荧光蛋白主要用于监测经其标记的靶标蛋白在活细胞或组织内的动态过程[3],其优点在于无需外源性底物和辅助因子即可在长波紫外辐射(ultraviolet,UV)下被激发[4-6]。因此,荧光蛋白均需UV-激发或利用荧光成像技术才能观测到颜色[7]。此外,荧光蛋白的光谱与结构特征相互依赖[5],其成本高且分子质量太大会干扰蛋白的表达[2]。因此,在原核系统中表达重组蛋白时,常用成本较低且分子质量较小的His和GST标签[1]。但这些标签在蛋白表达和纯化过程中无显色特性,造成检测结果后延,操作技术复杂,如需免疫印迹(Western blot)等检测技术,耗时耗力。因此,研发一种新颖并兼具上述优点的可视化蛋白标签来简便蛋白重组表达和纯化进程将尤为必要。
细胞色素b5(cytochrome b5,Cyt-b5)是一类含有辅基原卟啉Ⅸ(血红素,heme)的金属蛋白,在生物体内作为电子转移元件参与多种重要的氧化还原反应[8]。它在红细胞中以可溶蛋白形式存在并介导高铁血红蛋白还原[9],是内质网膜微电子传递链的组成部分[9-10]。辅基亚铁血红素作为Cyt-b5的主要功能域,因其铁离子价态的可逆变化,而具有接收和传递单个电子的功能;同时,当其原有的酶活性被保留时,亚铁血红素使蛋白呈红色[11]。已有研究表明,冈比亚按蚊(AnophelesgambiaeGiles)和大鼠(Rattusnorve-gicusBerkenhout)的Cyt-b5可在原核表达系统中作为可视化的红色标签[7,12]。pGEX-Cyt-b5载体原核表达的GST-Cyt-b5融合蛋白可经谷胱甘肽-琼脂糖亲和层析柱纯化,并能通过免疫印迹法(Western blot)进行准确鉴定;此外,融合蛋白的Cyt-b5与谷胱甘肽-S-转移酶(glutathione-S-transferase,GST)的蛋白间相互作用很弱,Cyt-b5的存在并未对GST产生显著的结构和功能的改变[12]。
本研究选择南京农业大学昆虫生理生化与分子生物学实验室常用试虫[13]——二化螟(ChilosuppressalisWalker)的Cyt-b5基因为研究对象,将含Cyt-b5类血红素/类固醇结合域(Cyt-b5D)的表达片段分别用3种原核表达载体[pET-28a(+)、pET-41a(+)和pET-30a(+)]进行异源表达,筛选出显色稳定的基因片段以及菌液显色的培养时间;进一步将显色稳定的片段与二化螟γ-氨基丁酸受体亚基RDL1(resistance to dieldrin 1)基因进行融合表达,观察融合蛋白显色情况,从而明确选择片段与目的基因融合表达时显色的稳定性,筛选出可在3种pET载体上稳定显色的最小片段和最佳的显色时间点,以期为其成为原核表达系统可视化标签提供科学依据。
1 材料与方法
1.1 材料
Trizol试剂购于美国Invitrogen公司;Prime Script Ⅱ 1st Strand cDNA Synthesis Kit与ExTaq酶购于大连TaKaRa公司;pEASY-T3载体、BL21(DE3)感受态细胞、Trans2K DNA Marker、Trans5K DNA Marker、TransT1感受态细胞和DNA凝胶回收试剂盒等购于北京全式金生物技术有限公司;10× Fast Diagest Green Buffer、Fast DiagestBamHⅠ和Fast DigestXhoⅠ购于美国Thermo Scientific公司;10× T4DNA Ligase、10× T4DNA Ligase Buffer和质粒小量提取试剂盒购于美国Promega公司;抗His标签的鼠单克隆抗体和辣根过氧化物酶(Horseradish peroxidase,HRP)标记的羊抗鼠IgG购于金斯瑞生物科技有限公司;免疫化学印记化学发光试剂盒购于台湾生工科技有限公司;表达载体pET-28a(+)、pET-41a(+)和pET-30a(+)及二化螟由本实验室提供[14]。
1.2 方法
1.2.1 二化螟Cyt-b5氨基酸序列的划分根据二化螟Cyt-b5序列,对其氨基酸序列进行结构域分析,将其划分成O、A、B、C共4个区域(图1),选择含Cyt-b5的A(8~81 aa)、OA(1~81 aa)、AB(8~109 aa)、OB(1~109 aa)、AC(8~132 aa)及OC(1~132 aa)等6个长度不同的潜在显色片段用于后续试验。
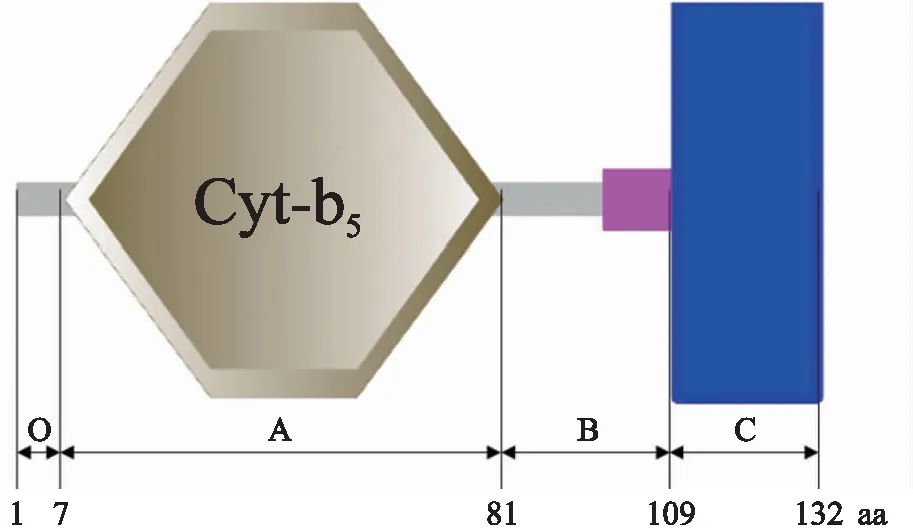
图1 细胞色素b5的结构域分析Fig.1 Domain analysis of cytochrome b5数字代表氨基酸位置;棕色六边形为Cyt-b5类血红素/类固醇结合域(Cyt-b5D);粉红色长方形为低复杂度结构域;蓝色长方形为跨膜结构域。The number indicates the location of the amino acid;the brown hexagon is cytochrome b5-like heme/steroid binding domain(Cyt-b5D);the pink rectangle is low complexity region;and the blue rectangle is transmembrane region.
1.2.2 二化螟Cyt-b5和RDL1基因的克隆采用Trizol法提取二化螟的总RNA,并用Prime Script Ⅱ 1st Strand cDNA Synthesis Kit合成cDNA。以cDNA为模板,利用ExTaq酶和特异性引物(表1)分别扩增目的基因片段。其中,A、OA、AB、OB、AC及OC片段的PCR反应程序为:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,循环35次;72 ℃ 10 min。RDL1的PCR反应程序为:94 ℃ 3 min;94 ℃ 30 s,47 ℃ 15 s,72 ℃ 1 min,循环35次;72 ℃ 5 min。经10 g·L-1琼脂糖凝胶电泳检测后,纯化和回收目的基因片段,并将其连接至pEASY-T3载体上,再转至TransT1感受态细胞中,涂板过夜培养;挑取单克隆白菌斑扩大培养后送至上海杰李生物技术有限公司进行测序;抽提测序正确的质粒,测定浓度后于-20 ℃保存备用。

表1 引物序列Table 1 Primer sequences used in this study
1.2.3 表达载体的构建及其异源表达利用相应的内切酶对测序正确的质粒以及原核表达载体pET-28a(+)、pET-41a(+)和pET-30a(+)进行双酶切,然后将6个目的片段分别与pET-28a(+)载体连接,转至BL21(DE3)感受态细胞内,加入1 mmol·L-1IPTG诱导表达6 h后,以pET-28a(+)空载体为对照,比较不同片段表达蛋白的菌液颜色。将筛选后的潜在显色片段A、OA和OB分别与pET-30a(+)载体连接,重复上述操作,收集0、1、2、4和8 h的菌液,并以pET-30a(+)空载体为对照,观察和比较其颜色变化。同时,将OA片段与pET-41a(+)载体连接,重复上述操作,收集0、1、2、3.5、5、7和14 h的菌液,并以pET-41a(+)空载体为对照,观察和比较其颜色变化,同时用分光光度计测定不同波长下菌液的吸光值。
1.2.4 显色片段与RDL1的融合表达将测序正确双酶切RDL1片段分别与pET-30a(+)-A、pET-30a(+)-OA和pET-30a(+)-OB连接,转入大肠杆菌,加入1 mmol·L-1IPTG诱导表达后,于0、1、2、4和8 h收集菌液,观察和对比颜色变化。
1.2.5 融合蛋白的纯化和检测将活化的菌液pET-30a(+)-A、pET-30a(+)-OA和pET-30a(+)-OB扩大培养至D600=0.6~0.8时,加入1 mmol·L-1IPTG诱导表达,并在200 r·min-1、37 ℃条件下培养8 h;然后在4 ℃、8 000g离心10 min,收集菌体。用含0.5 mmol·L-1PMSF的20 mmol·L-1Tris-HCl(pH7.4)缓冲液悬浮菌体,加入溶菌酶(终浓度为0.4 mg·mL-1),在冰浴条件下超声波破碎3次;在4 ℃、12 000g离心 30 min,收集上清液。将上清液通过镍亲和层析柱,用清洗缓冲液(20 mmol·L-1Tris-HCl,250 mmol·L-1NaCl,15 mmol·L-1咪唑;pH7.4)清洗层析柱,再用洗脱缓冲液(20 mmol·L-1Tris-HCl,250 mmol·L-1NaCl,400 mmol·L-1咪唑;pH7.4)洗脱目的蛋白。
目的蛋白经十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)方法初检后,使用Western blot方法进一步验证。具体操作如下:1)采用半干转移法,将蛋白转至PVDF膜上,用牛血清白蛋白(BSA)于4 ℃过夜封闭;2)以抗His标签的鼠单克隆抗体为一抗,稀释2 000倍,孵育1 h;3)PBS缓冲液洗膜3次,每次5 min,以HRP标记的羊抗鼠IgG为二抗,稀释10 000倍,孵育1 h;4)PBS缓冲液洗膜3次,每次5 min,利用免疫化学印迹化学发光试剂盒在UVP凝胶成像系统中显色观察。
2 结果与分析
2.1 显色片段筛选和表达载体普适性测定
2.1.1 Cyt-b5各片段的显色与对照pET-28a(+)空载体相比,在含有Cyt-b5D不同片段的菌液中,除A和AC片段表达的菌液显色不明显外,其他片段表达的菌液均呈红色,其中OA和OB片段显色最明显(图2)。

图2 pET-28a(+)载体上Cyt-b5各片段的显色Fig.2 Chromogenic results of each fragment of Cyt-b5 protein on pET-28a(+)vector A、OA、AB、OB、AC和OC分别为Cyt-b5的 8~81 aa、1~81 aa、8~109 aa、1~109 aa、8~132 aa和1~132 aa片段表达的蛋白;pET-28a(+)为对照。A,OA,AB,OB,AC and OC are the proteins expressed by 8-81 aa,1-81 aa,8-109 aa,1-109 aa,8-132 aa and 1-132 aa fragments of Cyt-b5;pET-28a(+)is the control.
2.1.2 OA片段在不同时间点表达菌液的显色及在不同波长下的吸光值将OA片段与pET-41a(+)载体连接并表达,通过比较不同时间点的菌液发现:培养2 h,菌液开始出现明显的红色,并随培养时间的延长逐渐变深;而空载pET-41a(+)菌体在14 h时仍无颜色变化(图3-A)。此外,不同时间点收集的菌液在420 nm波长处有1个明显的吸收峰,且吸光值与时间呈正相关趋势(图 3-B)。

图3 OA片段与pET-41a(+)连接表达菌液在不同时间点的显色反应(A)和吸光值(B)Fig.3 Chromogenic reaction(A)and absorbance(B)of pET-41a(+)-OA bacterial solution at different time points
2.1.3 显色片段与RDL1融合表达菌液的颜色变化将A、OA及OB片段分别与pET-30a(+)载体连接并进行蛋白表达,结果(图 4-A)表明:菌液培养2 h时,A片段显色不明显,而OA和OB片段开始显红色;而培养4和8 h时,A、OA和OB片段表达的菌液均呈现明显的红色。将A、OA和OB片段分别与RDL1融合表达,结果(图4-B)表明:菌液培养2 h时,RDL1-OA和RDL1-OB的菌液开始显红色,而RDL1-A的菌液无显色;同样,培养4和8 h时,3个片段与RDL1融合的菌液均呈现出明显的红色。
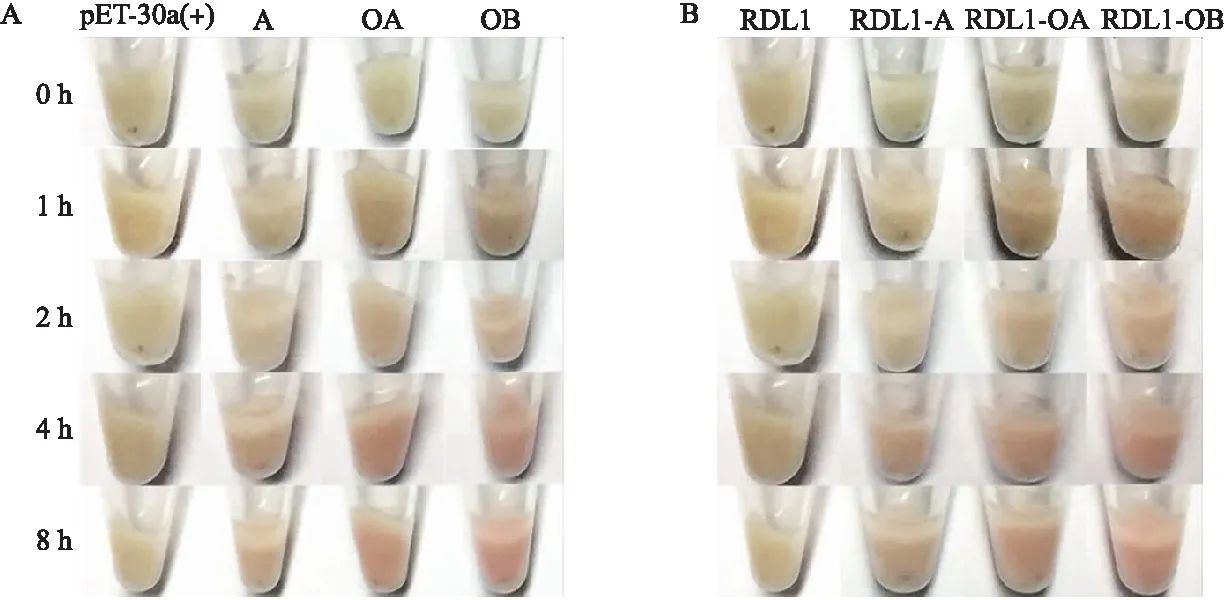
图4 Cyt-b5各片段表达菌体(A)及其与RDL1融合蛋白表达菌体(B)的实时显色Fig.4 Chromogenic results of each Cyt-b5 fragment(A)and co-expression of Cyt-b5 fragments with RDL1(B)at different time points
2.2 显色片段及其与RDL1融合表达蛋白的纯化和免疫印记分析
用镍离子亲和层析柱将裂解后的蛋白样品进行纯化。上样后,当层析柱开始出现红色时(图5-A),表示目的蛋白与层析柱结合;在使用洗脱液洗脱后,层析柱中不再有红色出现(图5-B),表明目的蛋白已经被洗脱完毕;洗脱后收集到的样品液呈红色(图5-C)。

图5 蛋白纯化过程中的显色Fig.5 Chromogenic results in the process of protein purificationA为上样后带蛋白的层析柱;B为蛋白洗脱后的层析柱;C为纯化后的样品液。A is the chromatographic column with protein after sample loading;B is the chromatographic column after protein elution;C is the protein sample after protein purification.
氨基酸序列分析结果表明,pET-30a(+)空载体、A、OA、OB、RDL1-A、RDL1-OA和RDL1-OB的蛋白相对分子质量分别为8.1×103、16.5×103、17.1×103、20.2×103、26.3×103、26.9×103和30×103。Western blot检测结果(图6)显示,洗脱得到的蛋白样品条带清晰,且目的条带与预测的蛋白相对分子质量大小相符。
3 结论与讨论
作为蛋白标签应该具备以下特点:1)一步吸附纯化;2)对标记蛋白的三级结构和生物活性影响较小;3)容易被特异性去除以产生天然的蛋白;4)在纯化过程中对重组蛋白的测定应该是简单且准确的;5)适用于多种不同的蛋白质[15]。为此,蛋白标签已被广泛应用于重组蛋白的纯化和鉴别。可视化标签作为一种简单有效的蛋白检测工具,可大幅度简化蛋白表达和纯化的过程。Cyt-b5已在诸多研究中作为显色标签使用。例如,用pLW01载体表达兔的Cyt-b5蛋白,发现表达细胞中有明显的粉红色颗粒[16];利用pHcb5载体表达人的Cyt-b5蛋白,经纯化后得到红色蛋白[17]。
本研究中,含Cyt-b5D的4个片段OA、AB、OB和OC分别与原核表达载体pET-28a(+)连接,其表达菌体均呈现明显的红色;将含Cyt-b5D的3个片段A、OA和OB分别与原核表达载体pET-30a(+)连接,其表达菌体亦呈现明显的红色。因此,选择在2种载体上显色稳定并片段较短的OA片段(1~81 aa)作为最佳显色片段。OA与pET-41a(+)连接,其表达菌液反应时间越长显色越明显;同时,该菌液在420 nm具有显著的吸收峰,且吸收值与表达时间呈正相关趋势,这与他人的研究结果[12,18]相符。Fox等[19]将人的Cyt-b5蛋白与麦芽糖结合蛋白(maltose binding protein,MBP)在原核表达系统融合表达,得到的His8-MBP-fl-Cyt-b5蛋白在420 nm波长处有1个明显的吸收峰。牛卫宁等[18]基于人的胱硫醚β-合酶血红素结合域片段基因的氨基酸序列开发出的血红素融合标签在420 nm处亦具有特征吸收峰,且融合蛋白表现为肉眼可见的鲜红色。Asher等[20]使用吡啶血红素吸光度法测定血红素浓度,进而用于血红素标记蛋白质的定量。因此,通过检测特征吸收峰下的吸光值差异,可快速计算表达蛋白的浓度,而其表达量与吸光值呈正相关[20-21],这将大幅度简化判断重组蛋白是否表达以及表达量变化的监测流程。
本研究还对显色蛋白及其与RDL1的融合蛋白进行纯化和鉴定。在使用镍离子亲和层析柱纯化过程中,可根据层析柱颜色的变化实时观察蛋白的纯化过程,最后通过Western blot准确鉴定出表达的目的蛋白。蛋白标签的分子质量大小与重组蛋白的溶解度紧密关联[15]。本研究结果表明,Cyt-b5蛋白可视标签的最佳片段OA表达蛋白的相对分子质量为17.1×103,小于GST(26×103),说明其有助于提高重组蛋白的溶解度,从而增加重组蛋白的产量[21]。此外,已有研究表明,融合蛋白的Cyt-b5与GST的蛋白间相互作用很弱,Cyt-b5的存在并未显著改变GST的结构和功能[12]。
综上所述,本研究利用二化螟Cyt-b5基因探究其不同长度显色片段在原核表达系统显色的稳定性和普适性。研究结果表明:OA片段为最佳选择,该片段具有显色稳定以及在不同表达载体上的普适性;同时,无论在原核表达培养阶段,还是蛋白纯化过程中,均可在自然光下实时观察融合蛋白的情况,这比荧光蛋白更为便捷。此外,OA片段表达的蛋白质相对分子质量明显小于GFP(26.9×103)和GST,这可能有利于降低标签蛋白对目的蛋白的影响,至少不影响对目的蛋白的Western blot鉴定。然而,在后续研究目标蛋白功能时,融合蛋白的可视化标签(Cyt-b5片段)是否需要切除,蛋白标签的切除与否对目的蛋白的功能是否存在影响,以及是否需要添加便于切割的标签序列等系列问题,仍需进一步研究。
