牛Nebovirus VP1 蛋白的表达及免疫原性研究
2021-01-26王珍贤
王珍贤,汤 承,岳 华
(西南民族大学畜牧兽医学院,四川成都 610041)
Nebovirus(NeV)是杯状病毒科(Caliciviridae)纽布病毒属(Nebovirus)的唯一成员,为无囊膜的单股正链RNA 病毒[1],可引起牛肠道损伤和严重腹泻[2-3],目前尚无该病毒的分离培养体系.目前该病毒已在巴西,意大利,美国等12 个国家的犊牛腹泻粪便样本中检出,检出率为 3. 0% ~ 25. 2%[2,4-11]. 本实验室证实,在国内奶牛和牦牛中存在的NeV 是国内致牛腹泻的新发病毒[12-13];本实验室进一步对新疆维吾尔自治区、四川、辽宁、河南、山东和陕西等省的奶牛、牦牛流行病学调查结果显示,奶牛腹泻样本中NeV 核酸平均检出率为48.1%,显著高于健康粪便样本5.7%的检出率[14];西藏、四川和云南等省区牦牛腹泻粪便样本中NeV 核酸平均检出率为22.0%,场阳性检出率为69.1%[13]. 上述结果表明该病毒已经在我国部分地区奶牛和牦牛中广泛流行且与腹泻密切相关.
VP1 是NeV 的主要结构蛋白,由 ORF1 编码,大小为549aa 或548aa,由围绕RNA 基因组形成衣壳内部的S 结构域和从衣壳出发并包含二聚体接触的拱状突起的P 结构域组成[15].P 结构域进一步分为相对保守的P1 结构和高度突变的P2 结构域,P2 结构域含有受体结合位点,参与受体识别并在启动宿主免疫反应中发挥重要作用[16-17]. 目前关于NeV VP1 蛋白功能研究的报道仅有一篇[16],但对人诺如病毒、兔出血症病毒等其它杯状病毒的研究表明,VP1 不仅参与受体结合,且诱导中和抗体产生[18-20],表明VP1 在病毒的感染和免疫过程中起重要作用.
目前关于NeV VP1 表达和应用的报道很少.2013年Thomas C 等人利用昆虫细胞-杆状病毒表达系统构建NeV VP1 的病毒样颗粒(Virus - like particles,VLPs),将其作抗原建立了检测抗体的间接ELISA 方法[17];2018 年 Cho EH 等人利用 VLPs 证实 NeV 衣壳蛋白能与组织血型抗原(histo -blood group antigens,HBGAs)结合,参与受体识别[16]. 本实验的目的是构建表达NeV VP1 蛋白的原核表达系统,并研究重组蛋白的免疫原性,为进一步研究VP1 功能和建立血清学检测方法奠定基础.
1 材料与方法
1.1 材料
1.1.1 菌种和血清
E.coliBL21(DE3)购自北京擎科新业生物技术有限公司;牛NeV 阳性血清,兔抗牛诺如病毒VP1 高免血清,兔抗牛冠状病毒高免血清,兔抗牛轮状病毒高免血清,兔抗牛病毒性腹泻病毒高免血清由本实验室保存;胎牛血清购自Quacell 生物技术有限公司.
1.1.2 主要试剂及仪器
羊抗牛HRP-IgG 二抗购于Abbkine 公司;Ultra-Signal 超敏ECL 化学发光底物购于四正柏生物科技有限公司,HisCap 6FF 镍离子纯化柱购于常州天地人和生物科技有限公司;Imidazole 购自德国BioFroxx 公司;BCA 蛋白浓度测定试剂盒购自Boster 公司;TMB、PageRuler Marker 购于 Thermo Fisher Scientific;IPTG购自Sigma 公司;电泳仪,凝胶成像系统购自上海天能科技有限公司;MONTANIDE ISA 201 VG 购自赛比科(上海)特殊化学品有限公司.
1.2 方法
1.2.1 NeVVP1 基因序列优化与合成
参照国内流行毒株NeV BO/LN -13/18/CH 的VP1 基因序列(GenBank 登录号 AYN 44906.1),大小为1 647 bp,,进行密码子偏好性优化、序列合成,并插入到pET28a( +)的NdeI 和XhoI 酶切位点间,由上海生工生物工程股份有限公司完成.重组NeVVP1 基因大小为1 707 bp,N 端携带His 标签及连接序列,重组蛋白总大小为59.7 kDa.
1.2.2 载体质粒的验证
以pET28a( +)载体通用测序引物 T7、T7ter 对pET28a-VP1 重组质粒进行PCR 扩增,同时PCR 产物送上海生工生物工程股份有限公司测序验证.
1.2.3 NeVVP1 载体质粒转化感受态细胞
通过热激法将1 μL 重组pET28a-VP1 质粒转化至E.coliBL21(DE3)感受态细胞,涂布于含有卡那霉素的LB 平板,37 ℃培养过夜,挑取单克隆菌落,震荡培养10 h 后,保存菌液.
1.2.4 NeV VP1 重组蛋白的诱导表达
挑取转化后单菌落于试管中(10mLLB 培养基,30 μg/mL 卡那霉素),220 rpm,37 ℃过夜培养. 向试管中以1%的浓度接种pET28a -VP1 重组菌,添加终浓度 30 μg/mL 卡那霉素,37 ℃,220 rpm 培养,当OD450nm值达到0.6 至0.8 时,以终浓度为0.5 mmol/L的IPTG 诱导表达,一组20 ℃诱导过夜,另一组37 ℃诱导6 h,同时以不添加IPTG 组作为阴性对照.
离心收集菌体,以PBS 1:100(W/V)重悬,超声破碎、离心后分别收集上清和沉淀,沉淀用包涵体溶解液(8 mol/L Urea,50 mmol/L Tris-HCl,300 mmol/L NaCl,pH8.0)1:20(W/V)溶解,以12%的分离胶进行SDS-PAGE 分析,蛋白胶经Image J 软件分析.
1.2.5 NeV VP1 重组蛋白的纯化及复性
大量诱导表达NeV VP1 重组蛋白,制备包涵体溶解液,按照镍琼脂糖亲和层析蛋白纯化说明书使用方法以5mLHisCap 6FF 镍离子纯化柱进行纯化,以12%分离胶进行SDS-PAGE 分析,蛋白胶经Image J软件分析.
收集到的组分进行SDS -PAGE 检测后,纯度最好的几组分经 6 mol/L、4 mol/L、2 mol/L、0 mol/L 尿素梯度透析复性,最终透析至50 mmol/L Tris,300 mmol/L NaCl,pH8.0 溶液中,经过 PEG20000 浓缩,0.45 μm 滤膜过滤后分装 1mL/管, -80 ℃冻存,按照BCA 蛋白浓度测定试剂盒说明书使用方法进行复性后重组蛋白的浓度测定.
1.2.6 NeV VP1 重组蛋白 Western Blot 检测
取纯化后的重组蛋白样品,以12%的分离胶进行SDS-PAGE,然后将重组蛋白转移至硝酸纤维素膜,用5%脱脂牛奶进行封闭过夜处理;分别加入1:500 倍稀释的牛NeV 阳性血清和胎牛血清,37 ℃摇床孵育 2 h,TBST 洗涤 3 次,10 min/次;加入 1∶5 000倍稀释的HRP 标记的羊抗牛二抗,37 ℃摇床孵育1 h,TBST 洗涤 3 次后进行 ECL 显色.
1.2.7 抗NeV VP1 抗体ELISA 方法的建立
(1)ELISA 方法条件筛选
以兔抗NeV VP1 高免血清作为标准阳性血清,健康家兔血清作为标准阴性血清,NeV VP1 重组蛋白作为包被抗原,采用方正法筛选ELISA 最优条件. 以大于等于Cut off 值(阴性孔OD450值×2.1)判定为阳性,反之判定为阴性.
(2)特异性试验
采用所建方法对兔抗牛冠状病毒高免血清、兔抗牛轮状病毒高免血清、兔抗牛病毒性腹泻病毒、兔抗牛诺如病毒VP1 高免血清、兔抗NeV VP1 高免血清进行检测,同时设立标准阴、阳性对照,测定OD450nm.
(3)敏感性试验
采用所建方法对一份兔抗NeV 阳性血清进行检测,按 1∶80 000、1∶100 000、1∶120 000、1∶140 000、1∶160 000 比例稀释阳性血清,以ELISA 检测结果阳性的最大稀释比作为敏感度.
(4)稳定性试验
采用所建ELISA 对同一批样品进行3 次检测,不设复孔,统计每个样品3 次测定的OD450nm变异系数.
1.2.8 重组NeV VP1 重组蛋白免疫接种家兔及抗体检测
6 只成年健康家兔分2 组,每组3 只.将纯化复性后的 VP1 重组蛋白与MONTANIDETMISA 201 VG佐剂按1∶1(V/V)比例混合,实验组颈背部皮下注射重组蛋白(1 mg/只),首免两周后进行二免,随后隔一周免疫一次,共免疫4 次;对照组注射同体积的PBS.首免前 1d 和首免后第 7 d、14 d、21 d、28 d、35d 对兔耳缘静脉采血并分离血清,将NeVVP1 重组蛋白作为包被抗原,进行间接ELISA,测定血清抗体水平.
2 结果
2.1 NeV VP1 载体质粒的鉴定
琼脂糖电泳结果显示在接近2 000 bp 处有特异性条带,与预期相符(图1),测序结果也证实目的序列正确插入pET28a( +)载体.
2.2 NeV VP1 重组蛋白的诱导表达
重组菌经IPTG 诱导表达的产物经SDS -PAGE检测,在约60 kDa 处有特异性条带,蛋白定位于包涵体沉淀,且重组菌在20 ℃诱导过夜较37 ℃诱导6 h蛋白表达量更高(图2),目的蛋白在包涵体总蛋白中占比约45.31%.
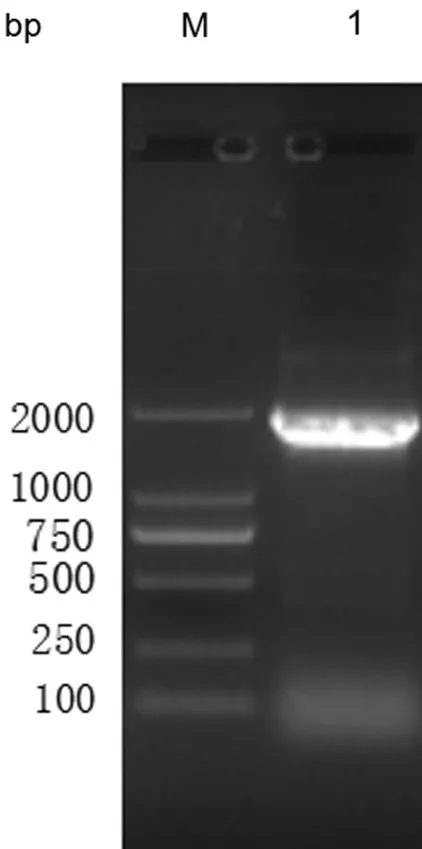
图1 重组质粒pET28a-VP1 PCR 扩增产物电泳图Fig.1 Electrophoresis of PCR product for recombinant plasmid pET28a-VP1
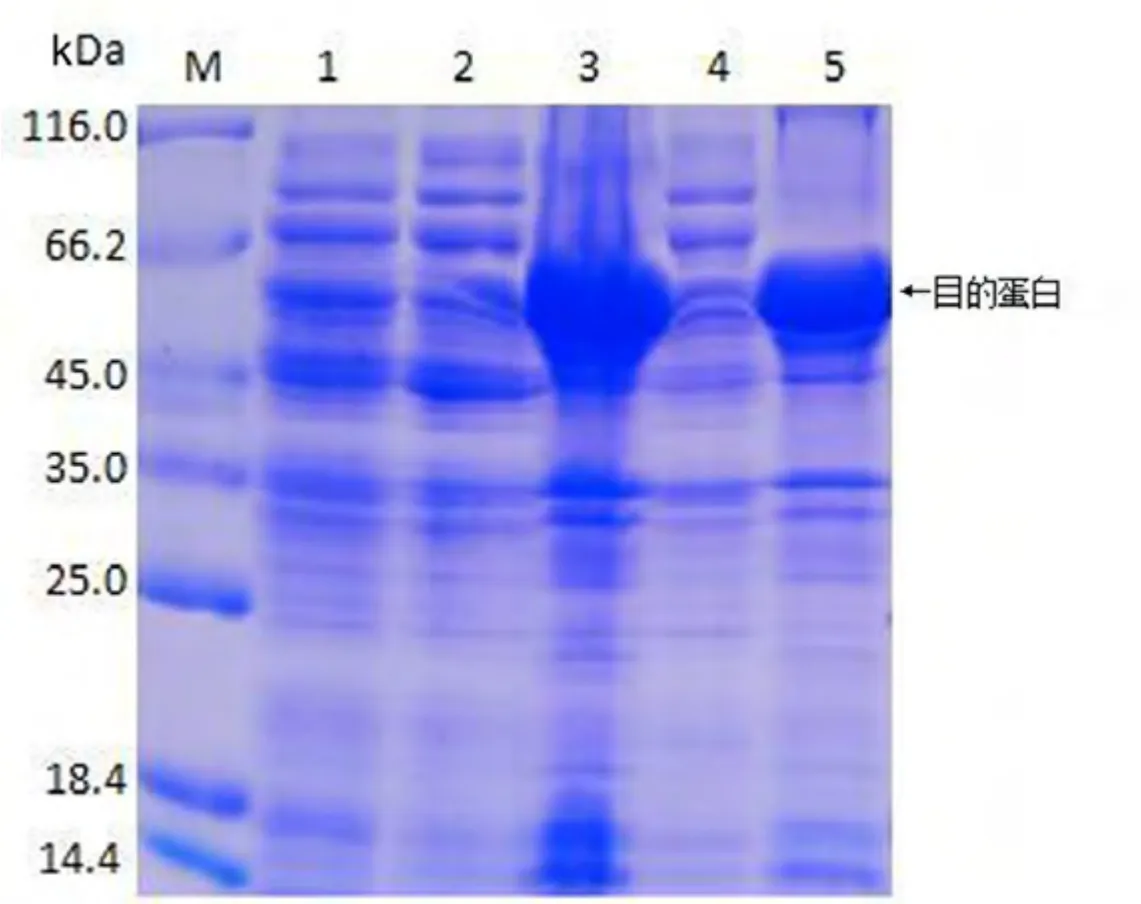
图2 重组蛋白表达分析Fig. 2 Analysis of recombinant protein expression
2.3 NeV VP1 重组蛋白的纯化及复性
大量培养pET28a-VP1 重组菌,收集蛋白样品,参照镍琼脂糖亲和层析蛋白纯化说明书对蛋白进行纯化后得到目的蛋白,结果见图3. 纯化的VP1 重组蛋白SDS-PAGE 显示呈单一电泳条带,BCA 试剂盒测定重组蛋白浓度为0.78 mg/mL,纯度约89.41%(表1).
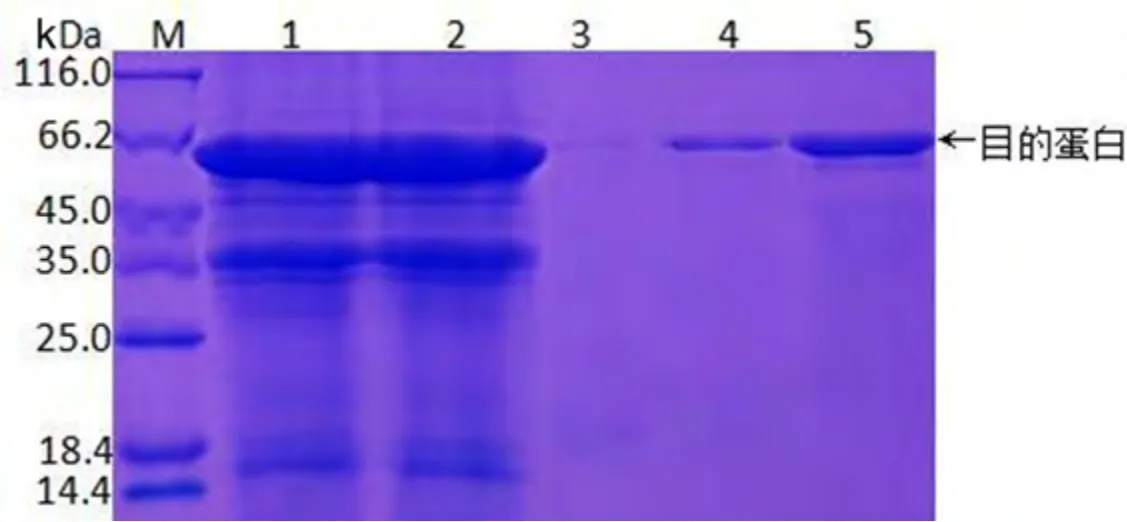
图3 重组蛋白的纯化分析Fig. 3 Purification and analysis of recombinant protein
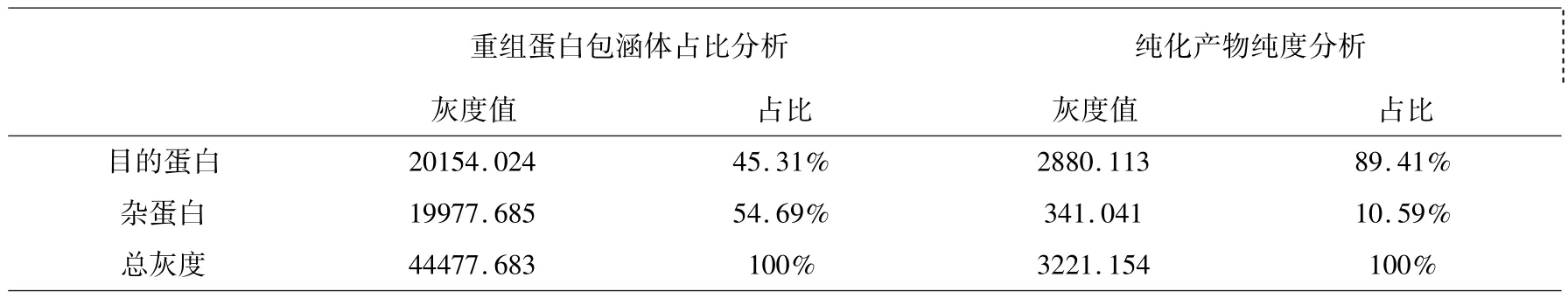
表1 Image J 灰度分析Table 1 Image J grayscale analysis
2.4 重组NeV VP1 蛋白Western Blot 检测结果
Western Blot 检测显示,在目的蛋白处有特异性条带,重组蛋白能够与牛NeV 抗体产生结合反应(图4).
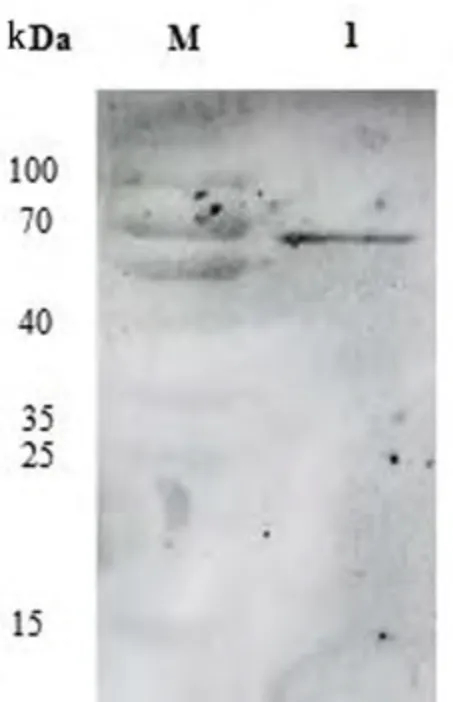
图4 NeV VP1 蛋白 Western Blot 验证Fig. 4 Western Blot of NeV VP1 protein
2.5 抗NeV VP1 抗体ELISA 方法的建立
经筛选,最优包被条件为,包被抗原浓度0.5 μg/mL,37 ℃,2 h;最优封闭条件为,4% PEG6000,37 ℃,2 h;一抗最优反应条件为1% BSA 稀释1∶80 000 倍,37 ℃,1 h;HRP 标记的羊抗兔IgG 二抗最优反应条件为,1∶50 000 倍稀释,37 ℃,1 h;TMB 显色,室温,15 min;2 mol/L 浓硫酸终止反应. Cut off 值为 0. 118(OD450nm).
利用建立方法检测兔抗牛冠状病毒、兔抗牛轮状病毒、兔抗牛病毒性腹泻病毒、兔抗牛诺如病毒VP1高免血清,结果均为阴性,表明所建立的方法特异性好.对一份兔抗NeV VP1 阳性血清按不同比例稀释进行检测,本方法灵敏度为1∶140 000.重复试验变异系数在2.62% ~5.86%之间,表明所建立的方法的稳定.
2.6 NeV VP1 重组蛋白免疫后抗体水平检测
对实验动物免疫前后各个阶段进行血清特异性抗体检测,结果显示,免疫组在免疫前OD450nm值为0.055,一免2 周时升高至0.857,随着免疫次数的增加抗体水平随之升高,在三免时达到最大为1.572,之后趋于稳定. 对照组OD450nm值维持在0.056 ±0.002(图5).
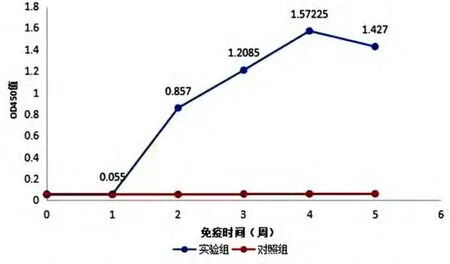
图5 血清抗体消长曲线Fig. 5 Kinetic level of serum antibody
3 讨论
目前尚无NeV 分离培养体系,但通过排除了其他病毒的含NeV 腹泻粪便无菌处理后感染新生无菌小牛,引起肠道损伤(尤其在十二指肠和空肠最严重)和严重腹泻[2-3],证明其是致腹泻病毒,目前已在包括我国在内的13 个国家检出并流行[2-4-12]. VP1是NeV 的主要结构蛋白即衣壳蛋白,目前GenBank 中有73 条NeV 完整VP1 序列.根据VP1 基因的遗传多样性,NeV 可分为3 个基因型(基因1 -3 型),其中基因1 型又分为 4 个谱系(谱系 1 ~ 4)[13,21]. 不同基因型之间氨基酸相似性为69.5% ~78.5%[22]. 本实验室前期调查表明,基因1 型谱系1 为我国NeV 流行的主要基因型,在奶牛中还检出有基因1 型(谱系3、谱系4)和基因2 型,在牦牛中检出了基因3 型[23].
本研究参照NeV BO/LN -13/18/CH 毒株(VP1基因1 型谱系1)VP1 基因序列,成功构建pET28a -VP1 原核表达载体,用Image J 软件分析,目的蛋白占包涵体总蛋白的45.31%,表达量高,每升菌液可纯化并复性约7 mg 的NeV VP1 重组蛋白.Western Blot 结果显示纯化的VP1 重组蛋白能够与牛NeV 抗体产生特异性反应,说明重组蛋白具有反应原性;以此为基础,成功建立了检测兔抗NeV 血清的间接ELISA 方法,可以敏感特异地检测兔血清中相应抗体,为进一步建立检测牛NeV 病毒的血清学方法奠定了基础.
原核表达系统相对于真核表达系统而言,操作简单成本低.虽然原核系统表达的VP1 重组蛋白不能像真核系统一样自发组装成VLPs,但研究表明原核表达的诺如病毒、猫杯状病毒等其它杯状病毒VP1 蛋白具有同样的抗原性和结合受体的特性,被广泛应用于ELISA 检测方法的建立,及衣壳蛋白功能研究[24-27].在人诺如病毒中,Yoda 等发现与杆状病毒表达系统相比,原核表达系统诱导产生的抗体对同一亚型的不同毒株表现出更为广谱的免疫反应性,可以在一定程度上解决抗体检测中病毒变异大和同一基因组血清型存在差异的问题[27-29],分析认为这是由于原核表达的衣壳蛋白相较于VLPs 暴露出较为保守且比C 端富含抗原表位的N 段,因此免疫动物产生的抗体可以识别衣壳蛋白的各区,包括了N 端和C 端[27-29].
本研究结果表明,纯化复性后的VP1 重组蛋白能够刺激家兔产生强的体液免疫应答,检测发现特异性抗体在一免7 天后开始上升,三免7 天后达到最大值并趋于稳定,血清抗体140 000 倍稀释后仍可通过间接ELISA 方法稳定检测,说明VP1 重组蛋白具有良好的免疫原性. 由于目前尚无NeV 病毒的分离培养体系,因而无法通过实验直接证明VP1 重组蛋白诱导的抗体具有中和活性.但对人诺如病毒,猫杯状病毒,兔出血症病毒等其他杯状病毒的研究表明,衣壳蛋白VP1 是诱导中和抗体产生的重要蛋白[19-20,30]. 尽管原核表达的重组蛋白在组装和整体结构上与VLPs 存在差异,但复性的重组蛋白可以基本还原VP1 单体的原有结构并诱导中和抗体的产生[31],和本试验相似的大肠杆菌原核表达系统表达的兔出血症病毒衣壳蛋白制作的亚单位疫苗,能够抵抗兔瘟病毒的攻击,免疫效果良好[31]. 因此,可在本研究基础上,进一步研究NeV VP1 重组蛋白作为亚单位疫苗的潜力,对于NeV 的免疫防控有重要意义.
4 小结
本研究以pET28a( +)为载体,BL21(DE3)为表达工程菌成功高效表达了NeV VP1 蛋白,该蛋白具有良好的免疫原性和反应原性,为进一步研究NeV血清学检测方法和亚单位疫苗奠定了基础.
