基于G 四联体的检测汞和铅的适配体传感器
2021-01-26袁子岚刘弘锌吴艳萍邓锐杰
袁子岚,刘弘锌,吴艳萍,邓锐杰
(四川大学轻工科学与工程学院,四川 成都610065)
汞,一种有毒有害的重金属元素,自然界中存在三种形式,即甲基-汞(MeHg)、金属汞和Hg2+,这三种形式的汞都对自然环境产生不利影响,对人类健康构成严重威胁.有研究显示,未成年时期就暴露于高汞含量的环境中的人在以后的生活得患糖尿病的风险可能更高[1],特别是汞对胎儿的影响十分恶劣,汞可通过胎盘从母体转移至胎儿,而且胎儿更容易受到汞及其生物活性化合物的不良影响,往往导致智力发育迟滞,脑瘫等严重的后果[2-4],且这三种形式的存在的汞很可能损害人类的中枢神经系统,导致心血管、呼吸系统等疾病[5-7].铅,同样是具有剧毒毒性的重金属,随着对铅的开采,因其广泛存在于环境中与不易降解的特性,极低剂量的铅污染都能对人体造成严重的危害[8],主要造成智力下降、异食癖、不孕不育、破坏神经系统导致神经病变以及高血压等危害[9-10],且对于孕妇来说其血铅水平的增加会导致流产、早产、出生体重过轻,以及随后孩子的发育迟缓等严重后果[11-12].汞和铅污染都严重危害到人体健康和生态环境,因此构建高精确度、高灵敏性、高特异性的对汞和铅的检测技术,对环境中的汞与铅实现精确、灵敏、便捷的检测与分析具有十分重要的意义.
近几年,核酸适配体因具有体外合成简单、成本低廉、无需动物实验、热稳定性好、高亲和性、高特异性、低毒性等特性[13],已经广泛应用于生命科学、临床诊断、药物筛选和环境科学等等领域[14-16]. 如在Hg2+检测方面,Liu[17]和Jiang[18]等利用Hg2+可以形成T-Hg-T 结构,实现对Hg2+的高特异性和高灵敏度的检测;在Pb2+检测领域,Lu 等[19]通过Pb2+能诱导富G 核酸链-TBAA 特异性形成G -四联体结构,从而实现Pb2+的高特异性和高灵敏度的可视化检测.刘红文[20]等构建了基于Pb2+诱导PS2.M 构象改变的过氧化物酶活性“Turn-off”型比色传感器,开展了氡的非标记荧光传感生物分析新方法研究.
本研究采用富G 和T 的核酸适配体Hg-A,采用K+使其形成稳定的G 四联体结构,加入Pb2+和Hg2+后,分别形成更稳定的G 四联体和T -Hg -T 结构,改变原有的G 四联体构型,从而实现对Pb2+和Hg2+的检测.
1 实验部分
1.1 仪器和试剂
Hg2+和 Pb2+核 酸 适 配 体 Hg - A 序 列 为GGGTTTTGGGTTTTGGGTTTTGGG(TsingKe Biological Technology Co., 北 京); 通 过 酶 标 仪 Synergy H1(BioTek, 美国)量化适配体的浓度;N -methyl mesoporphyrin IX(NMM)染液(Santa Cruz Biotechnology,Inc., 美国);Thermo Scientific 10 × Reaction Buffer(Thermo Fisher,美国);汞标准液(Acros Organics Co., 美国); Pb(CHCOO)2购自 Alfa Aesar(上海,中国);分析纯 Al(NO3)3、NiCl、CoCl2、MnCl2、CuSO4(Chengdu Kelong reagent Co., 中国);灭菌超纯水(Corning, 美国);实验室自来水.
1.2 Hg2+、Pb2+的测定
在反应管中,依次加入24 μL H2O、4 μL Thermo Scientific 10X Reaction 缓冲液、4 μL 核酸适配体(Hg-A)、一定浓度的4 μL Hg2+或4 μM Pb2+、最后加入一定浓度的NMM 染液,充分混匀.同时以灭菌超纯水代替在Hg2+、Pb2+溶液配制空白对照.25 ℃环境下反应1 h. 取30 μL 注入384 孔板中,选择激发波长为399 nm,设置扫描范围500 nm ~700 nm,扫描步幅2 nm,通过酶标仪Synergy H1 (BioTek)测定各溶液的荧光强度(F),测定空白溶液的背景荧光值(F0),计算体系的F0/F.
2 结果与讨论
2.1 Hg2+、Pb2+的传感原理
荧光染料N - methyl mesoporphyrinIX(NMM)在游离状态时荧光微弱,但能够特异性识别G 四联体结构,结合至G 四联体后荧光急剧增加[21].未加入Pb2+或Hg2+时,反应体系中的K+使核酸适配体Hg-A 形成稳定的G 四联体结构,NMM 结合至G 四联体,发出强烈荧光.加入Pb2+后,Pb2+与K+竞争结合至Hg-A,导致G 四联体构象改变,从而形成更稳定的G四联体[22].由Pb2+稳定形成的G 四联体不能与NMM结构,游离状态的NMM 荧光微弱,故加入Pb2+后体系荧光降低.加入Hg2+后,Hg2+与核酸适配体上T 形成T-Hg-T 结构,破坏了原有的G 四联体结构,不能结合NMM,因而荧光降低.
如图1 所示,在激发波长为399 nm 的条件下,不加Hg2+或Pb2+时,体系中的K+稳定核酸适配体形成的G 四联体与NMM 结合,NMM 发出强烈荧光(曲线1).在Hg2+(曲线2)存在下,Hg2+与核酸适配体上T形成T-Hg-T 结构,破坏了原有的G 四联体结构,不能结合NMM,荧光急剧降低.在Pb2+(曲线3)存在下,Pb2+形成结构更加稳定的G -四联体结构,此反应体系之下的荧光强度有一个很大幅度的减弱. 据此,建立基于Hg2+或Pb2+可诱导核酸适配体Hg -A构象改变的荧光传感器,用于检测Hg2+和Pb2+.

图1 不同体系的荧光信号光谱图Fig.1 Fluorescence emission spectra of different systems
2.2 实验条件的优化
荧光强度首先作为孵育时间的函数来研究反应体系在不同时间的荧光强度变化,检测了分别在Hg2+(图 2)和 Pb2+(图 3)浓度为 1 μM 和 10 μM 下的时间曲线. 如图 2 所示,添加 1 μM Hg2+后,NMM荧光呈缓慢增加趋势,且40 min 后增加很小,基本趋于平稳. 添加10 μM Hg2+后,NMM 荧光迅速降至较低水平,且在1 h 后荧光强度稳定不变.如图3 所示,添加1 μM 和10 μM Hg2+后,体系荧光强度均明显降低,且在反应达到10 min 后荧光保持不变. 结果表明,在Hg2+和Pb2+的所有测定浓度下,反应时间达到1 h 后,体系均已达到平衡. 因此,选择1 h 作为该适配体传感器的反应时间.
NMM 作为信号指示剂,其浓度对适配体对Hg2+和Pb2+的响应有一定的影响.如图4 和图5 所示,当NMM 浓度由 0.5 μM 增加至 8 μM 时,F0/F 呈现先增大后减小的变化趋势. 实验结果表明,NMM 浓度为1 μM 时体系对 Hg2+和 Pb2+的荧光响应均达到最大值.因此,选择 NMM 浓度为 1 μM 作为检测 Hg2+和Pb2+的最优反应条件.

图2 Hg2+浓度分别为1 μM 和10 μM 体系下的反应时间曲线Fig. 2 Reaction time curves for Hg2+ concentrations at 1 μM and 10 μM
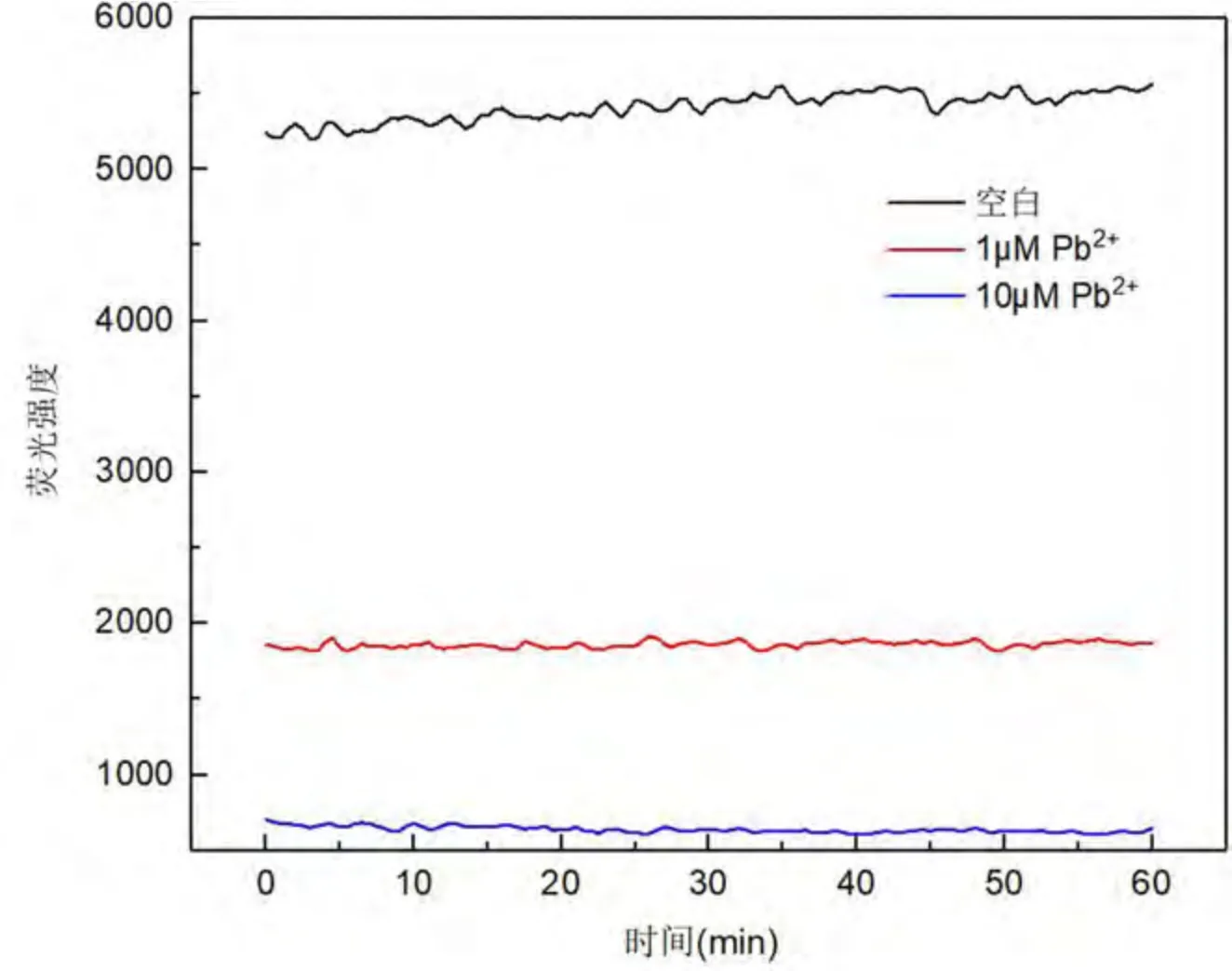
图3 Pb2+浓度为1 μM 和10 μM 体系下的反应时间曲线Fig. 3 Reaction time curves for Pb2+ concentrations at 1μM and 10 μM
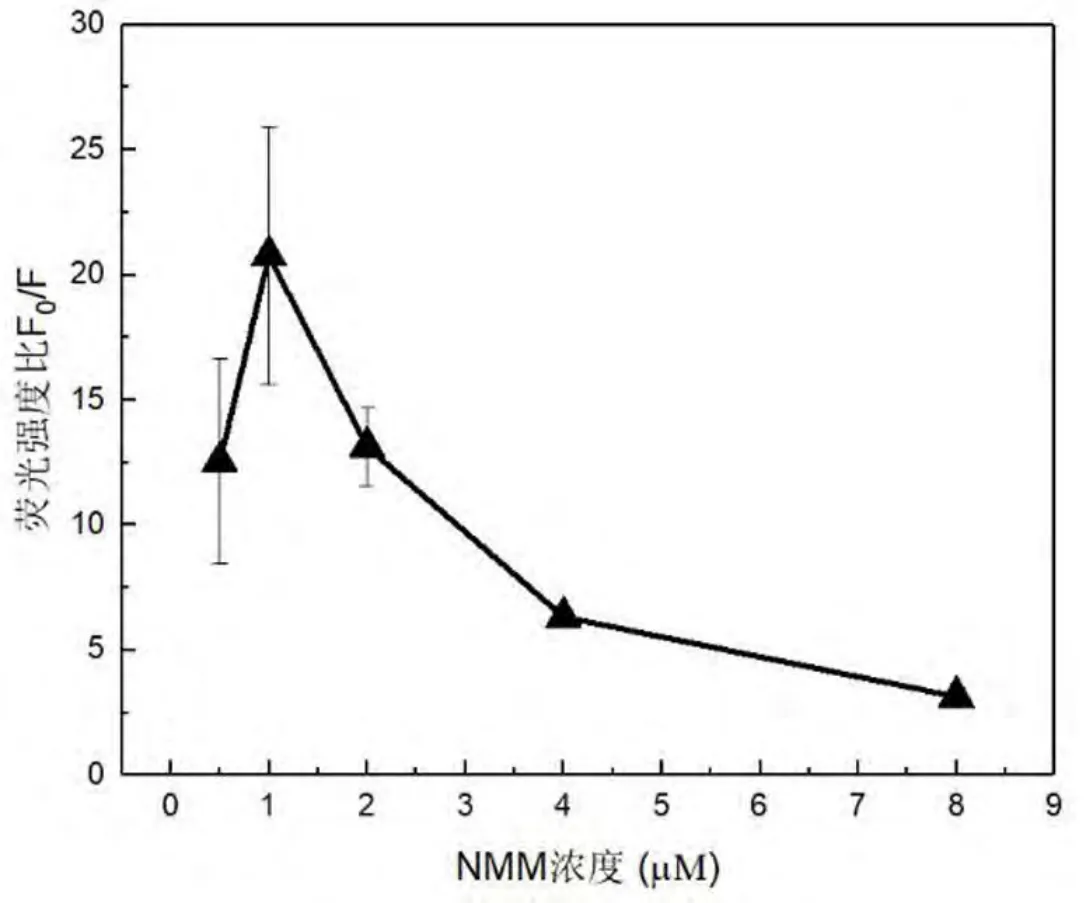
图4 不同NMM 浓度时适配体对Hg2+的荧光响应Fig. 4 Fluorescence response of aptamer probe towards Hg2+ using different concentrations of NMM
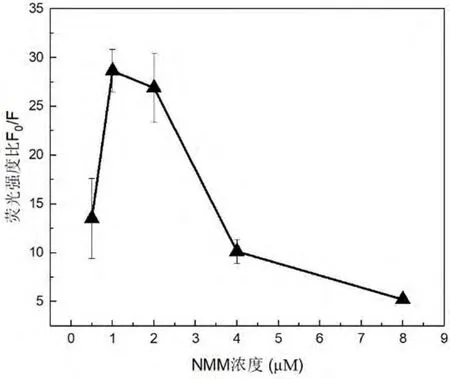
图5 不同NMM 浓度时适配体对Pb2+的荧光响应Fig. 5 Fluorescence response of aptamer probe towards Pb2+ using different concentrations of NMM
2.3 标准曲线
分别测定Hg2+和Pb2+系列标准溶液的荧光强度F 与未加Hg2+和Pb2+的试剂空白溶液的荧光强度F0.计算各反应的F0/F 值,绘制标准曲线. 如图6 所示,体系的荧光信号比与Hg2+浓度在0.5 ~4 μM 范围内呈现良好的线性关系,回归方程为F0/F =0.56+0.51CHg,相关系数R =0.9975.计算空白溶液的标准偏差为SD=0.121,将标准偏差乘以3 加上空白溶液时的 F0/F 值,带入线性回归方程中,计算得出Hg2+的最低检测限为1.57 μM.如图7 所示,体系的荧光信号比与Pb2+浓度在0.5 ~4 μM 范围内呈现良好的线性关系,回归方程为F0/F =-3.37 +9.00CPb,相关系数R =0.9976.计算空白溶液的标准偏差为SD=0.073,将标准偏差乘以3 加上空白溶液时的F0/F值,带入线性回归方程中,计算得出Pb2+的最低检测限为0.51 μM.如表1 所示,对比目前现有技术检测Hg2+或Pb2+,在均相检测以及探针的复杂程度方面上考虑,本方法在检测Hg2+或Pb2+占优.
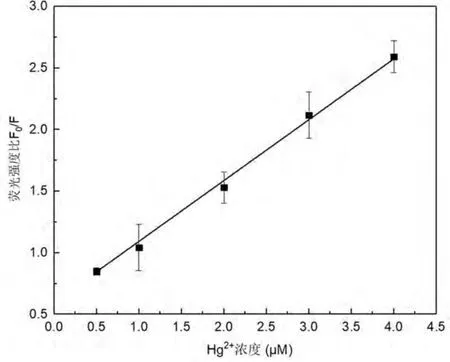
图6 测定Hg2+的标准曲线Fig. 6 Calibration curve for detection of Hg2+
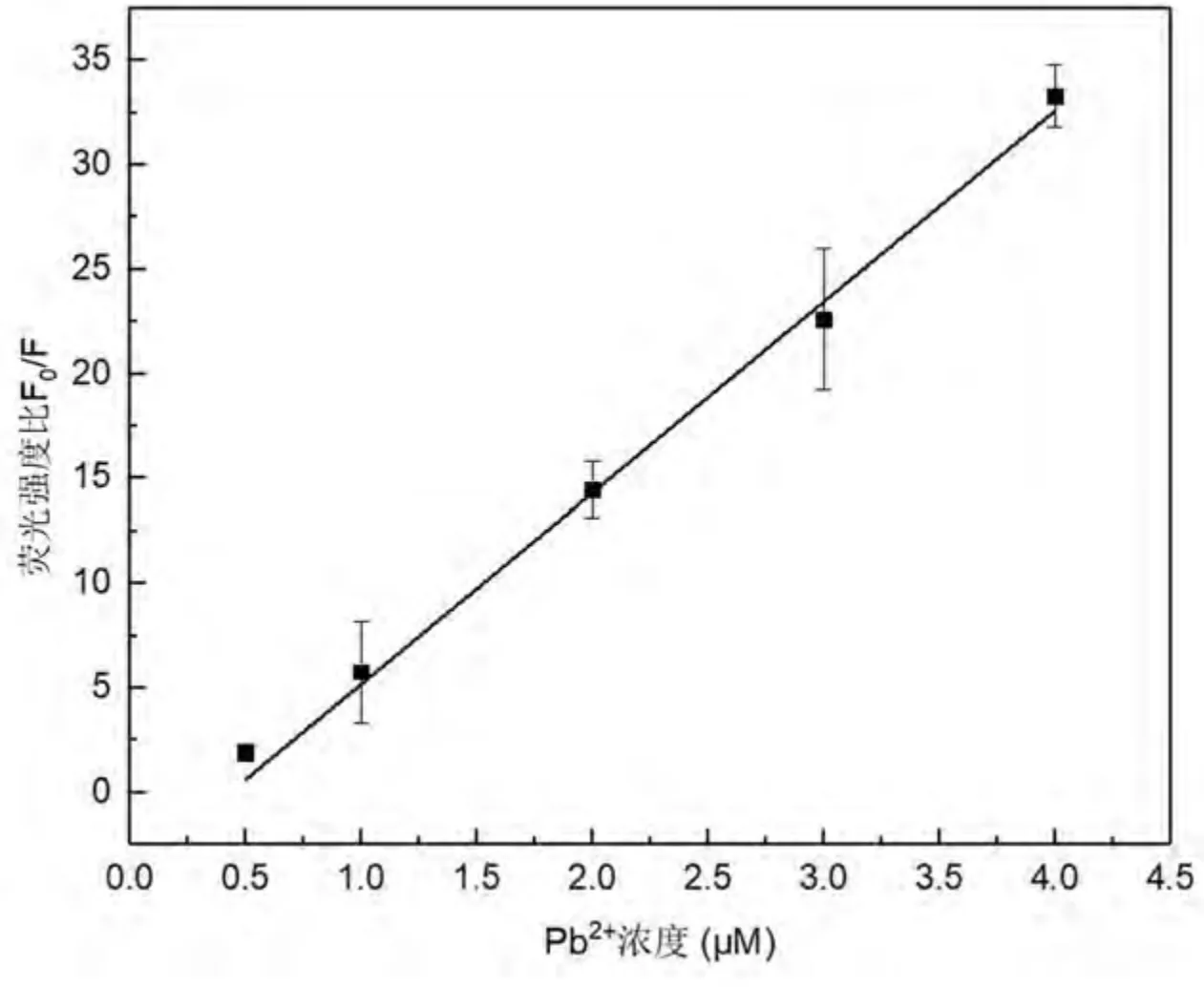
图7 测定Pb2+的标准曲线Fig. 7 Calibration curve for detection of Pb2+
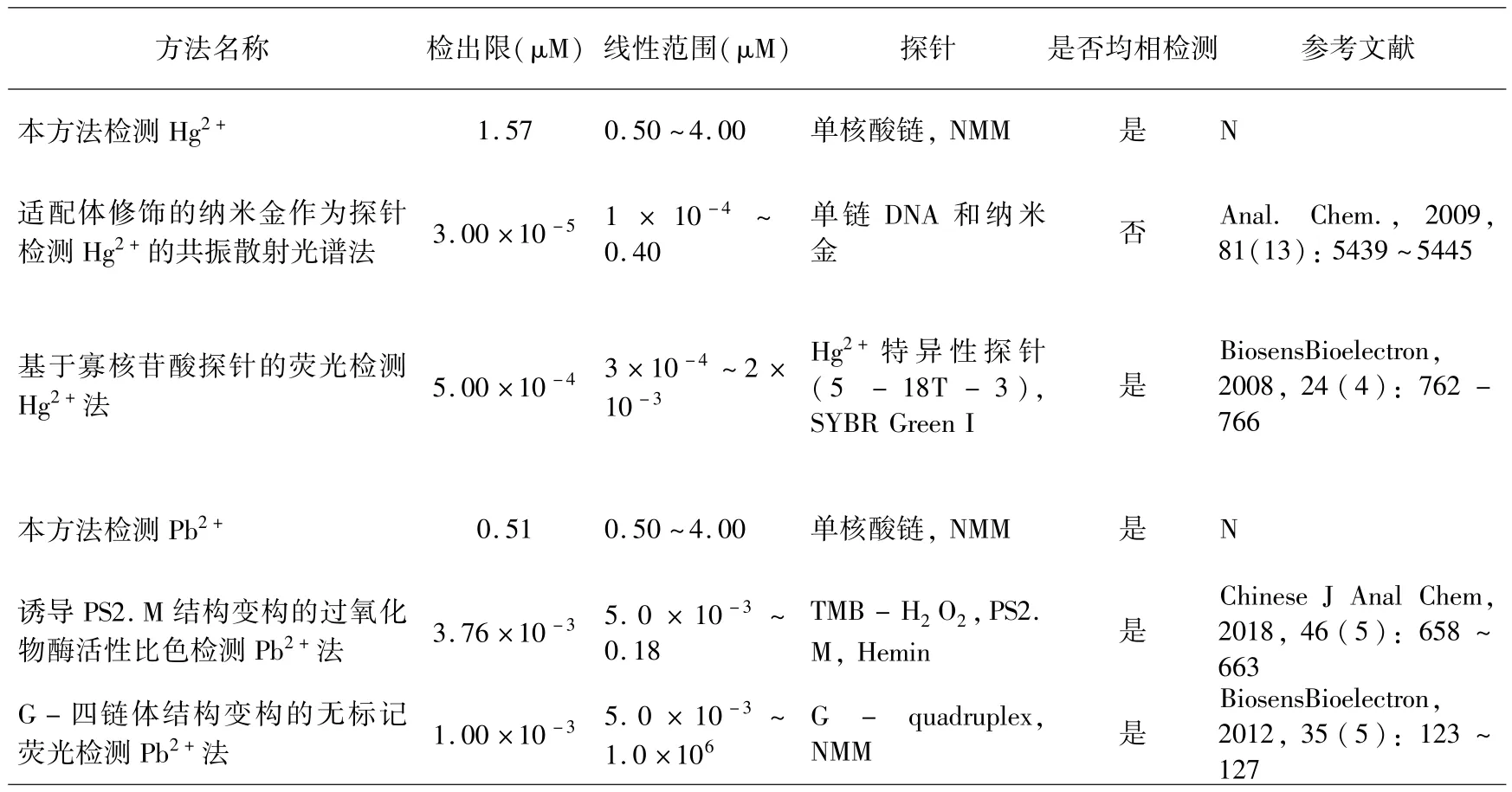
表1 目前现有技术检测Hg2+或Pb2+Table 1 Comparison of the current technology for detection of Hg2+or Pb2+
2.4 选择性
通过测定适配体传感器对其他金属离子(Mn2+,Co2+, Ni+, Al3+, Cu2+)的荧光强度变化来评价该荧光传感器的选择性.如图8 所示,实验结果表明,在所有金属离子浓度均为10 μM 的情况下,其他金属离子导致适配体探针产生与背景信号(不加任何金属离子时的荧光信号)接近的荧光信号,只有Hg2+和Pb2+引起相当大的荧光信号比(F0/F). 除Hg2+和Pb2+外,适配体传感器对其他受试离子无响应. 因此,该荧光传感器对Hg2+和Pb2+的检测具有很高的特异性.

图8 适配体传感器对不同金属离子的荧光响应Fig. 8 The fluorescence response of the aptasensor towards metal ions
2.5 自来水中Hg2+和Pb2+的检测
为了评价该荧光传感器的应用潜力,我们使用该荧光传感器分析了在自来水中Hg2+和Pb2+的浓度.自来水取自四川大学实验室.将Hg2+和Pb2+分别添加至自来水中,终浓度为3 μM 和4 μM.按照1.2 中描述的方法,使用荧光传感器测定加标后的自来水样品中的 Hg2+和 Pb2+浓度. 结果如表 2 所示,检测Hg2+的加标回收率为87.32% ~104.53%,检测Pb2+的加标回收率为88.07% ~94.21%.结果表明,该荧光传感器准确率高,可以用于检测和分析环境样品中的Hg2+和Pb2+.
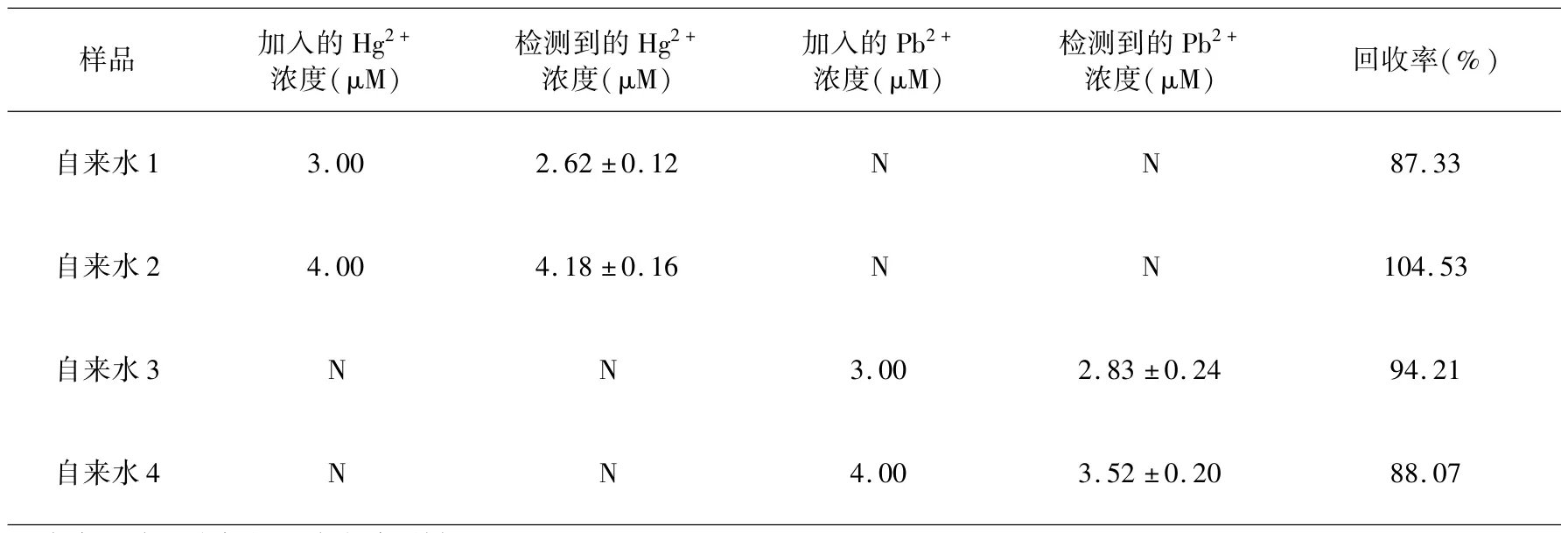
表2 通过荧光传感器检测自来水中Hg2+或Pb2+的浓度Table 2 Analysisof Hg2+or Pb2+in tap water samples by the proposed aptasensor
3 结论
综上,本研究建立了一种基于核酸适配体Hg -A探针与NMM 的Hg2+和Pb2+的荧光传感器,该传感器具有简单方便、高灵敏度、高选择性等优点.该反应体系不需要复杂的实验技术对核酸探针进行任何化学修饰,这在技术和操作上具有简单的特点,从应用来看具有广阔的前景. 该传感器可用于环境中Hg2+和Pb2+的检测与分析. 同时,本研究也进一步推动了适配体传感器在环境监测、食品安全等领域的重金属检测中的应用.
