一种多菌灵酶联免疫快速检测方法的建立
2021-01-25蒋文慧吴小胜彭正学崔海峰万宇平
蒋文慧 吴小胜 崔 娜 张 瑜 彭正学 崔海峰 万宇平
(1.浙江省杭州市人民检察院,浙江 杭州 310012;2.北京勤邦生物技术有限公司,北京 102206;3.北京市食品安全免疫快速检测工程技术研究中心,北京 102206;4.北京望尔生物技术有限公司,北京 102206)
多菌灵(carbendazim)即N-(2-苯并吡唑基)氨基甲酸甲酯,属于苯并吡唑类,是一种病害防治杀菌剂,被广泛应用于农作物。然而施用多菌灵的目标物会长期残留该药物,人、畜食用后,会引起头晕、恶心、呕吐、抽搐等一系列中毒症状[1-2]。
GB 2763—2019《食品安全国家标准 食品中农药最大残留限量》规定了果蔬、茶叶中多菌灵的最大残留限量(Maximum Residue Limit,MRL)范围为:0.02~5.00 mg/kg。目前中国的检测标准有:GB/T 5009.188—2003《蔬菜、水果中甲基托布津、多菌灵的测定》、GB/T 23380—2009《水果、蔬菜中多菌灵残留的测定 高效液相色谱法》、SN/T 3650—2013《药用植物中多菌灵、噻菌灵和甲基硫菌灵残留量的测定 液相色谱—质谱/质谱法》、SN/T 0162—2011《出口水果中甲基硫菌灵、硫菌灵、多菌灵、苯菌灵、噻菌灵残留量的检测方法 高效液相色谱法》、SN/T 1753—2016《出口浓缩果汁中甲基硫菌灵、噻菌灵、多菌灵和2-氨基苯并咪唑残留量的测定 液相色谱—质谱/质谱法》、SN/T 0220—2016《出口水果中多菌灵残留量的检测方法》、NY/T 1680—2009《蔬菜水果中多菌灵等4种苯并咪唑类农药残留量的测定 高效液相色谱法》、NY/T 1453—2007《蔬菜及水果中多菌灵等16种农药残留测定 液相色谱—质谱—质谱联用法》。上述标准均为仪器分析法,同时,通过查阅文献发现,前人研究多菌灵检测方法较多地偏重仪器方法,已报道的仪器方法有:超高效液相色谱法[3]、QuEChERS—高效液相色谱法[4-5]、液相色谱—质谱/质谱法[6]、紫外分光光度法[7]、液相色谱法[8-9]、高效液相色谱法[10-11]、SERS法[12]等,分析对象主要为蔬菜、水果。此外,也有报道[13-14]利用酶联免疫法快速检测多菌灵的残留量,但分析对象为土壤和水,目前尚未检索到农产品中检测多菌灵残留量的快速检测方法。而且仪器分析法成本高、步骤复杂,对检测人员有较高的技术要求,不便于基层实验室和中小型生产企业实施检测。因此,研究拟采用酶联免疫吸附法对烟叶、苹果、白菜、茶叶中多菌灵残留量进行检测,以期提供一种成本低、效果好的方法,为农药残留监管提供技术支撑。
1 材料与方法
1.1 材料与仪器
多菌灵、噻苯达唑、甲基托布津、托布津、2-氨基苯并咪唑标准品:纯度≥95%,北京标准物质研究中心;
牛血清白蛋白:纯度≥98%,美国Sigma公司;
卵清蛋白:纯度≥98%,美国Sigma公司;
三氟乙酸、三氟乙酸酐、硝酸铵、氢氧化钠、二氯甲烷、乙酸乙酯、氯化锡、碳二亚胺、石油醚、硫化铵、二甲基甲酰胺、碳酸钾:分析纯,北京百欣试剂公司;
果蔬、茶叶、烟叶:市售;
Balb/c小鼠:斯贝福(北京)生物技术有限公司;
单克隆杂交瘤细胞株:实验室自制;
酶标仪:MK3型,上海雷勃分析仪器有限公司。
1.2 抗原制备
1.2.1 半抗原制备 取三氟乙酸20 mL,加三氟乙酸酐2 mL,冰水浴至0 ℃,加硝酸铵0.5 g,搅拌1 h,加入含多菌灵1.0 g的三氟乙酸溶液,继续搅拌反应2 h。停止搅拌,用1 mol/L氢氧化钠溶液调节pH至7.0,加200 mL二氯甲烷萃取,加水300 mL,充分搅拌,转入分液漏斗中,静置30 min,分层,分去上层水相,所得二氯甲烷溶液,旋蒸(40 ℃),50 mL乙醚打浆,得到化合物a 0.76 g,收率67%[15]。在上述三氟乙酸和三氟乙酸酐体系下,用硝酸铵对多菌灵进行硝化反应,在苯环上引入硝基,萃取前进行中和,便于萃取。1H NMR(CDCl3,300 MHz)δ:8.31(1H,dd,J=1.616,J=1.239),7.69(1H,dd,J=8.716,J=1.616),7.64(1H,dd,J=8.716,J=1.239),3.85(3H,s)。
取化合物a 0.7 g用乙醇溶解,加含0.43 g氯化锡的水溶液10 mL,通入氮气,加热回流反应3 h;旋蒸(60 ℃)、除去乙醇,加水200 mL,加乙酸乙酯100 mL,充分搅拌,静置,分去水相,有机相旋蒸(55 ℃)以除去大部分乙酸乙酯,利用石油醚—乙酸乙酯(V石油醚∶V乙酸乙酯=1∶1)对其进行洗脱分离,得到b产物(半抗原化合物)0.54 g,收率为83%。1H NMR(CDCl3,300 MHz)δ:3.79(3H,s),6.27(2H,s),6.90(1H,dd,J=2.225,J=1.850),6.46(1H,dd,J=8.422,J=2.225),7.34(1H,dd,J=8.422,J=1.850),5.00(1H,s),9.15(1H,s)。上述产物经核磁共振氢谱测定,在化学位移δ=6.27处存在苯环上芳香胺的共振吸收峰,说明半抗原合成成功。多菌灵半抗原合成路线见图1。
1.2.2 免疫原制备 称取牛血清白蛋白50 mg,使之充分溶解在3.8 mL 0.1 mol/L 磷酸盐缓冲液(pH 7.2)中,得到溶液A;用0.2 mL H2O 溶解1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和N-羟基琥珀酰亚胺各30 mg,加入至溶液A中,搅拌30 min;取15 mg半抗原,溶解于1 mL 二甲基甲酰胺溶液中,然后缓慢加入到溶液A中溶解,搅拌24 h。透析后分装,-20 ℃保存。
1.2.3 包被原制备 称取卵清蛋白50 mg,使之充分溶解在3.8 mL 0.1 mol/L 磷酸盐缓冲液(pH 7.2)中,得到溶液B;用0.2 mL H2O 溶解1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和N-羟基琥珀酰亚胺各30 mg,加入至溶液B中,搅拌30 min;取13 mg半抗原,溶解于1 mL 二甲基甲酰胺中,然后缓慢加入到溶液B中溶解,搅拌24 h。透析后分装,-20 ℃保存。

图1 多菌灵半抗原合成Figure 1 Synthesis of carbendazim hapten
1.3 酶标记抗抗体制备
利用1.2得到的免疫原免疫Balb/c,制备杂交瘤细胞株,纯化出多菌灵单克隆抗体[16],免疫无病原体羊,得到羊抗鼠抗抗体[17],再用辣根过氧化物酶进行标记[18],得到酶标记抗抗体。
1.4 抗原包被浓度、单克隆抗体浓度选择及酶标板制备
(1) 对制备的抗原依次进行1∶2 000,1∶4 000,1∶8 000的梯度稀释,对制备的单克隆抗体依次进行1∶10 000,1∶20 000,1∶40 000,1∶80 000的梯度稀释,测定波长为450 nm,按式(1)计算百分吸光率。
(1)
式中:
K——百分吸光率,%;
B——标准品或样本溶液的平均吸光度值;
B0——0 μg/L标准溶液的平均吸光度值。
(2) 包被酶标板的抗原包被液体积为100 μL,需在37 ℃下孵育2 h,再加入150 μL 0.02 mol/L PBS缓冲液,其中牛血清白蛋白的质量分数为0.05%,37 ℃下孵育2 h[19],即完成酶标板制备。
1.5 烟叶中多菌灵残留量测定
利用RIDAWIN数据分析软件建立标准曲线,分别以待测药物的标准品浓度、Logit(B/B0)为标准曲线的横、纵坐标,将待测样本的吸光度值代入该曲线,即可测定出多菌灵残留量。
1.6 关键指标检测
1.6.1 检测限 取20份经过确证的空白样本,利用1.5的方法检测样本浓度,并计算20份样本浓度的标准差,所测样本浓度的平均值与其3倍标准差之和即为检测限[20]。
1.6.2 精密度和准确度 将多菌灵标准品添加至烟叶样本,添加浓度分别为300,600,1 200 μg/kg,检测3个浓度的烟叶样本回收率。烟叶样本做4个平行,计算相对标准偏差(RSD)。
1.6.3 稳定性 将试验制备的试剂盒于4 ℃下存放,每月固定日期测定最大吸光度值(0 μg/L)、试剂盒IC50以及烟叶样本的回收率,连续测定12个月。
1.6.4 抗体特异性 噻苯达唑、甲基托布津、托布津、2-氨基苯并咪唑与多菌灵的结构类似,测定上述药物的IC50,根据式(2)计算噻苯达唑、甲基托布津、托布津、2-氨基苯并咪唑的交叉反应率。引起50%抑制的多菌灵浓度与引起50%抑制的多菌灵类似物浓度的百分比,即为交叉反应率。
(2)
式中:
R——交叉反应率,%;
C1——引起50%抑制的多菌灵浓度,μg/L;
C2——引起50%抑制的多菌灵类似物浓度,μg/L。
2 结果与分析
2.1 抗原包被浓度、单克隆抗体浓度选择
测定浓度为0.0,0.1 μg/L的多菌灵标准品的吸光度值(见表1),根据式(1)计算B(0.1 μg/L)/B0(0.0 μg/L)的百分吸光率。理论上在抗原数量一定的情况下,抗体只有达到一定数量才能有效结合,然而实际应用中,抗原和单克隆抗体作为制备酶联免疫试剂盒的最关键原料,理想情况是在能够保证有效反应的情况下,抗体量最小;稀释倍数越大,同样产量的原料能够制备的试剂盒就越多。根据已有的研究[21],如果能够达到B(0.1 μg/L)/B0(0.0 μg/L)的百分吸光率在70%~85%的要求,那么稀释倍数越大,原料就能节省得越多。因此,选择抗原稀释倍数为8 000,单克隆抗体稀释倍数为80 000。
2.2 标准曲线
利用RIDAWIN数据分析软件建立标准曲线(见图2),标准曲线的范围为0.0~8.1 μg/L,试剂盒的半数抑制浓度(IC50)为0.851 μg/L;得到的线性方程为:y=-1.686x+1.117,决定系数R2为0.995。
2.3 检测限
由表2可知,该方法对烟叶、苹果、白菜及茶叶样本的检测限分别为266.3,421.0,349.1,484.4 μg/kg。优于吴燕等[12]针对茶叶建立的基于表面增强拉曼光谱测定方法(定量限为2 000 μg/L)。GB 2763—2019《食品安全国家标准 食品中农药最大残留限量》规定了多菌灵对苹果、白菜、茶叶的最大残留限量均为5 mg/kg(暂未对烟叶进行规定)。因此,该方法能够满足对多菌灵的检测要求。

表1 抗原、抗体的浓度选择(OD450 nm)Table 1 Optimal concentration of antigen and antibody (OD450 nm)
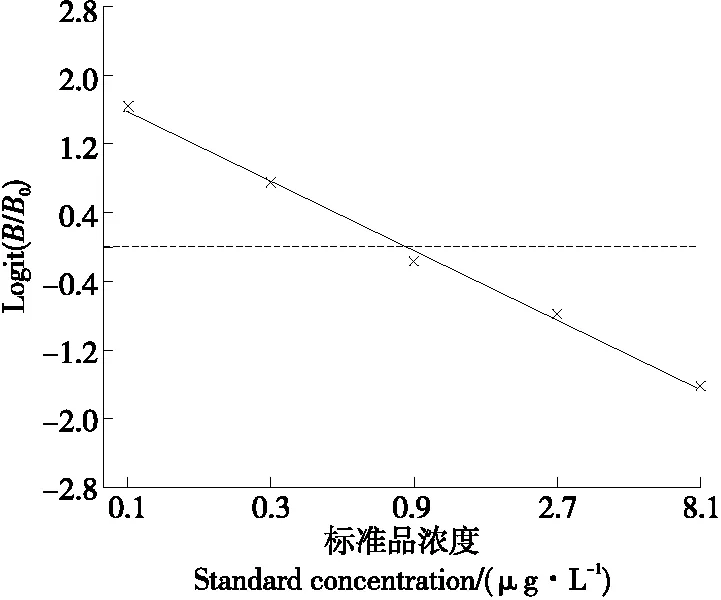
图2 多菌灵标准曲线Figure 2 Standard curve of carbendazim
2.4 精密度和准确度
由表3可知,不同添加水平多菌灵的烟叶样本的回收率为76.0%~102.2%,批内相对标准偏差为4.8%~9.7%,批间相对标准偏差为8.0%~8.6%。酶联免疫试剂盒的准确性与精密度有关,批内与批间的相对标准偏差均在10%以内,能保证测试的准确性。
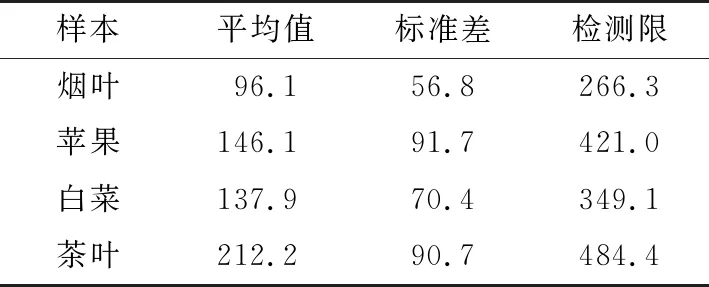
表2 样本的检测限测定Table 2 Determination of detection limit of samples (n=20) μg/kg
2.5 稳定性
由表4可知,试剂盒于4 ℃保存能够正常检测12个月,试验期间其最大吸光度值(0 μg/L)范围为1.59~1.91,IC50范围为0.367~0.772 μg/L,烟叶样本的回收率范围为72.6%~95.3%,均未显示异常。说明该酶联免疫试剂盒的稳定性良好,在4 ℃下能够保存12个月。

表3 精密度及准确度试验Table 3 Precision and accuracy test

表4 稳定性试验Table 4 Stability of the kit at 4 ℃
2.6 抗体特异性
噻苯达唑、甲基托布津、托布津、2-氨基苯并咪唑为应用广泛的杀菌剂。通过测定多菌灵抗体与噻苯达唑、甲基托布津、托布津、2-氨基苯并咪唑的交叉反应率,发现多菌灵抗体与噻苯达唑、甲基托布津、托布津、2-氨基苯并咪唑的交叉反应率<1%,说明多菌灵抗体的特异性良好。
3 结论
试验建立了一种烟叶、苹果、白菜、茶叶中多菌灵残留的酶联免疫吸附方法,通过制备出特异性良好的多菌灵单克隆抗体,将其应用于酶联免疫试剂盒的制备。结果表明,该方法稳定性好,检测时间仅为45~60 min,并且不需要昂贵的仪器,适用于基层实验室对烟叶、苹果、白菜、茶叶中多菌灵残留量进行批量检测。GB 2763—2019《食品安全国家标准 食品中农药最大残留限量》规定了多菌灵对6种谷物、4种油料油脂、16种蔬菜、28种水果等食品类别的最大残留限量,而试验研究样本仅限于苹果、白菜等果蔬,今后可根据市场需求,结合该标准对样本进行拓展。
