c-Myc、RhoA、YAP 在腺嘌呤诱发慢性肾病中的表达意义
2021-01-25莉何涛康婷熊琳朱婷婷欧三桃
文 莉何 涛康 婷熊 琳朱婷婷欧三桃∗
(1.西南医科大学附属医院肾病内科,四川泸州 646000; 2.四川省肾脏疾病临床医学研究中心,四川泸州 646000)
慢性肾病(chronic kidney disease,CKD)是一种严重危害人类健康的常见的慢性疾病,而肾小管间质纤维化(tubulointerstitial fibrosis,TIF)是各种肾疾病进展到终末期的共同途径和主要病理学特征之一[1]。 CKD 进展过程中,肾小管上皮细胞和肾间质成纤维细胞可以转化为肌成纤维细胞,进而合成和分泌大量细胞外基质促使肾小管间质纤维化[2-3]。肾小管间质纤维化程度可以反映肾功能下降严重程度,并可作为判断患者预后最重要的指标之一[4],了解其发病机制对指导治疗十分重要。
肾间质纤维化病变机制复杂,受多种细胞因子和多条信号通路的调控,目前研究较多的是TGF-β/Smad3、JAK/STAT 和 PI-3 K 通路等[5-6]。过去关于c-Myc、RhoA 和YAP 的研究多集中在肿瘤的发生发展领域,但是近年来也有研究发现,c-Myc 和RhoA 均具有促纤维化作用[7-8],YAP 的持续过度活化也可促进肾间质纤维化的发生[9-10],但关于三者在慢性肾病肾间质纤维化模型中的表达情况,以及其与肾间质纤维化的相关关系尚无报道。 RhoA-YAP 信号轴可促进多囊肾(Autosomal dominant polycystic kidney disease,ADPKD) 的发展,而c-Myc-YAP 相互作用可促进肿瘤进展,故推测在慢性肾病肾间质纤维化方面,c-Myc-RhoAYAP 之间可能也存在一定联系进而加速肾纤维化进程。 因此,本研究主要观察c-Myc、RhoA 和YAP在腺嘌呤诱发慢性肾病大鼠肾小管间质纤维化中的表达情况,并分析其与肾小管间质纤维化之间的关系。
1 材料和方法
1.1 实验动物
SPF 级雄性 SD 大鼠 30 只,体重(200±10) g,8周龄,购自西南医科大学实验动物中心[SCXK(川)2018-17]。 于西南医科大学附属中医医院中西医结合研究中心动物房饲养并取材[SYXK(川)2018-065]。 本实验经西南医科大学实验动物伦理委员会审批(20180306114),并按实验动物使用的3R 原则给予人道的关怀。
1.2 主要试剂与仪器
腺嘌呤(货号V900471,批号XWBC5614 V,规格100 g,Sigma 公司,美国);天狼星红染色液(批号:19.09,货号:BM1403-2×50 mL,规格 2×50 mL,合肥博美公司);RhoA 抗体、c-Myc 抗体、α-SMA 抗体(批号分别为:00048176、00060703、00070177,货号分别为:10749-1-AP、10828-1-AP、14395-1-AP,规格:50 μL,武汉三鹰公司);YAP 抗体(货号:BS1701,规格:50 μL,bioworld 公司,美国);Col1 抗体(货号:XS20180914013,bioworld 公司,美国);即用型ABC 试剂盒(bioworld 公司,美国),DAB 显色试剂盒(货号:c02-04001,武汉博士德公司);荧光定量PCR 试剂盒(Thermo scientific,美国),上下游引物:c-Myc、RhoA、YAP、Vimentin、Col1、α-SMA、GAPDH 均购自上海生物工程有限公司。
高速冷冻离心机(Eppendorf 公司,德国);全自动生化分析仪(西门子,德国);石蜡切片机(Thermo公司,美国);光学显微镜(Nikon 公司,日本);POLYTRON®台式匀浆机(Kinematica 公司,瑞士);逆转录仪(Eppendorf 公司,德国);实时荧光定量 PCR 仪(Eppendorf 公司,德国)
1.3 实验方法
1.3.1 分组及造模
30 只8 周龄雄性SD 大鼠适应性喂养1 周,大鼠依次编号后随机将编号进行分组,分为对照组(n=15)和模型组(n=15)。 腺嘌呤溶于蒸馏水,制成2.5%混悬液,CKD 组第1 ~4 周每日定时给予腺嘌呤混悬液 250 mg/(kg·d)灌胃,第 5 ~8 周腺嘌呤混悬液200 mg/(kg·d)隔日灌胃;对照组给予等体积生理盐水灌胃,两组均予以普通饲料喂养。 所有大鼠自由进食及饮水,光照时间明暗各半,室温18℃~25℃。
1.3.2 标本采集
分别于第4、6、8 周末处死大鼠,经腹主动脉采血,测定肾功(血清尿素氮BUN、肌酐 SCr、胱抑素CysC);留取24 h 尿液做24 h 尿蛋白定量(24 h Pro)检测;留取肾组织置于10%中性福尔马林液中固定,制成石蜡切片,另一部分肾组织冻存于-80℃冰箱中用。
1.3.3 HE 染色观察肾病理改变
取大鼠肾组织石蜡块切片(4 μm),常规脱蜡,至水后苏木精液染色、透明、封片,观察肾病理改变,包括肾小球、肾小管和肾间质等,重点观察小管间质情况。 参考Radford 等[11]肾间质损伤的评分标准,每张标本随机选取皮质区的10 个不含肾小球的非重复视野(×200),根据以下8 个参数判定肾小管间质损伤情况(肾小管上皮细胞空泡变性、坏死;肾小管扩张;小管萎缩;红细胞管型;蛋白管型;间质水肿;间质细胞浸润;间质纤维化程度),具体评分细则见表1。 每个视野小管间质评分 0 ~24 分,以10 个视野的均值作为该标本的肾间损伤指数。
1.3.4 天狼星红染色观察肾间质纤维化
肾组织固定,常规脱水包埋,切片,常规脱蜡至水;天狼星红染色液滴染1 h;流水稍微冲洗,去除切片表面染液;Mayer 苏木素染色液染细胞核5 ~8 min;流水冲洗10 min;常规脱水透明,中性树胶封固、观察。
参照胶原纤维相对面积的评定方法[12],评估天狼星红染色胶原纤维沉积情况:每例切片选取10 个非重复视野(×200),以红色染色为阳性表达。 着色面积评分标准:每个视野中,无损伤,间质纤维化少于皮质区5%=0 分;轻度损伤,间质纤维化占皮质区的6%~25%=1 分;中度损伤,间质纤维化占皮质区26%~50%=2 分;中度损伤,间质纤维化大于皮质区50%=3 分。 把10 个视野总分值求和后取平均值,得到该切片的纤维化程度评分。
1.3.5 免疫组化检测大鼠肾组织 c-Myc、RhoA、YAP、Col1、α-SMA 蛋白表达
肾组织石蜡切片经脱蜡至水处理后,按照ABC法依次行热修复抗原,3% H2O2灭活内源性过氧化物酶10 min,山羊血清封闭非特异抗原,滴加一抗、二抗、ABC 复合物、DAB 显色液,苏木素复染,常规脱水、透明、中性树胶封片,显微镜下观察,出现棕黄色颗粒为阳性信号。

表1 肾小管间质损伤指数评分标准Table 1 Scoring criteria of renal tubulointerstitial injury
1.3.6 RT-PC 检测 c-Myc、RhoA、YAP、Col1、α-SMA、Vimentin mRNA 水平
根据试剂盒说明书提取肾组织总RNA,再用逆转录试剂盒将mRNA 反转录为cDNA。 再采用PCR 仪进行PCR 反应,扩增条件为:95℃预变性10 min,40 个循环(95℃ 5 s,55℃ 15 s,72℃ 30 s)。 实时记录cDNA 的扩增,然后进行常规溶解曲线分析。 依据样本PCR 反应的CT 值,以2-△△CT表示目的基因的相对表达量。
引物序列:c-Myc 上游:5’-TTCTATCACCAG CAACAGCAGAGC-3’ 下 游: 5’-CGTAGCGACCGC AACATAGGAC-3’; RhoA 上 游: 5’-GCTTGTGGT AAGACATGCTTGCTC-3’ 下 游: 5’-GGCCTCAGA CGGTCATAATCTTCC-3 ’; YAP 上 游: 5 ’-GCCATGAACCAGAGGATCACTCAG-3’ 下 游: 5’-AGCCTCTCCTTCTCCATCTGTAGC-3’; Col-1 上 游:5’-TGTTGGTCCTGCTGGCAAGAATG-3’ 下游:5’-GTCACCTTGTTCGCCTGTCTCAC-3’;α-SMA 上游:5’-GCGTGGCTATTCCTTCGTGACTAC-3’ 下游:5’-CCATCAGGCAGTTCGTAGCTCTTC-3’; Vimentin 上游:5’-GTCCGTGTCCTCGTCCTCCTAC-3’ 下游:5’-TAGAGGCTGCGGCTAGTGCTG-3’。
1.4 统计学方法
采用SPSS 22.0 软件进行统计学分析,符合正态分布的计量资料采用平均数±标准差(±s)表示,两组间比较采用独立样本t检验,两变量间的相关性分析用Pearson检验,以P<0.05 为有统计学差异。
2 结果
2.1 两组大鼠不同时间点血、尿指标情况
与对照组比较,CKD 组各时间点血BUN、Scr、CysC 均明显升高,CKD 组大鼠24 hPro 水平从 6 周开始较对照组升高,差异有统计学意义(P<0.01;图1)。
2.2 大鼠肾组织HE 染色和肾间质损伤评分情况
HE 染色结果:对照组大鼠整体肾组织结构清晰,皮、髓质分界清楚,肾小球、肾小管和肾间质的形态结构均无明显异常;CKD 组肾组织:第4 周末可见肾小管扩张,以近端小管为主,管腔内可见棕褐色物质沉积;第6 周末可见远端肾小管和肾小球囊腔扩张;第8 周末,肾组织结构紊乱,肾小球部分萎缩,肾小管扩张明显,小管上皮细胞变性坏死,有较多炎细胞浸润(图2)。
与对照组比较,CKD 组大鼠肾间质损伤评分明显增高(P<0.01),且肾间质损伤评分随时间延长而逐渐升高,CKD 组6 周肾间质损伤评分较4 周有所增加,但差异无统计学意义;CKD 8 周较6 周肾间质损伤评分显著增高,差异具有统计学意义(P<0.05;图3)。

注:与 CKD 组比较,#P<0.05;与 Con 组比较,∗∗P<0.01。图1 两组大鼠不同时间点血、尿生化指标变化Note.Compared with the CKD group, #P<0.05.Compared with the Con group, ∗∗P<0.01.Figure 1 Changes of blood and urine biochemical indexes in the two groups of rats at different time points
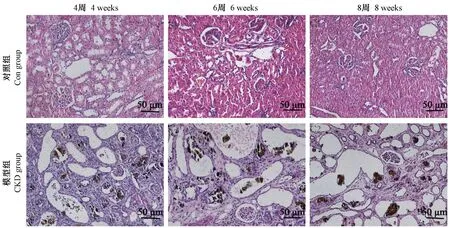
图2 两组大鼠肾组织HE 染色Figure 2 HE staining of renal tissue in two groups of rats
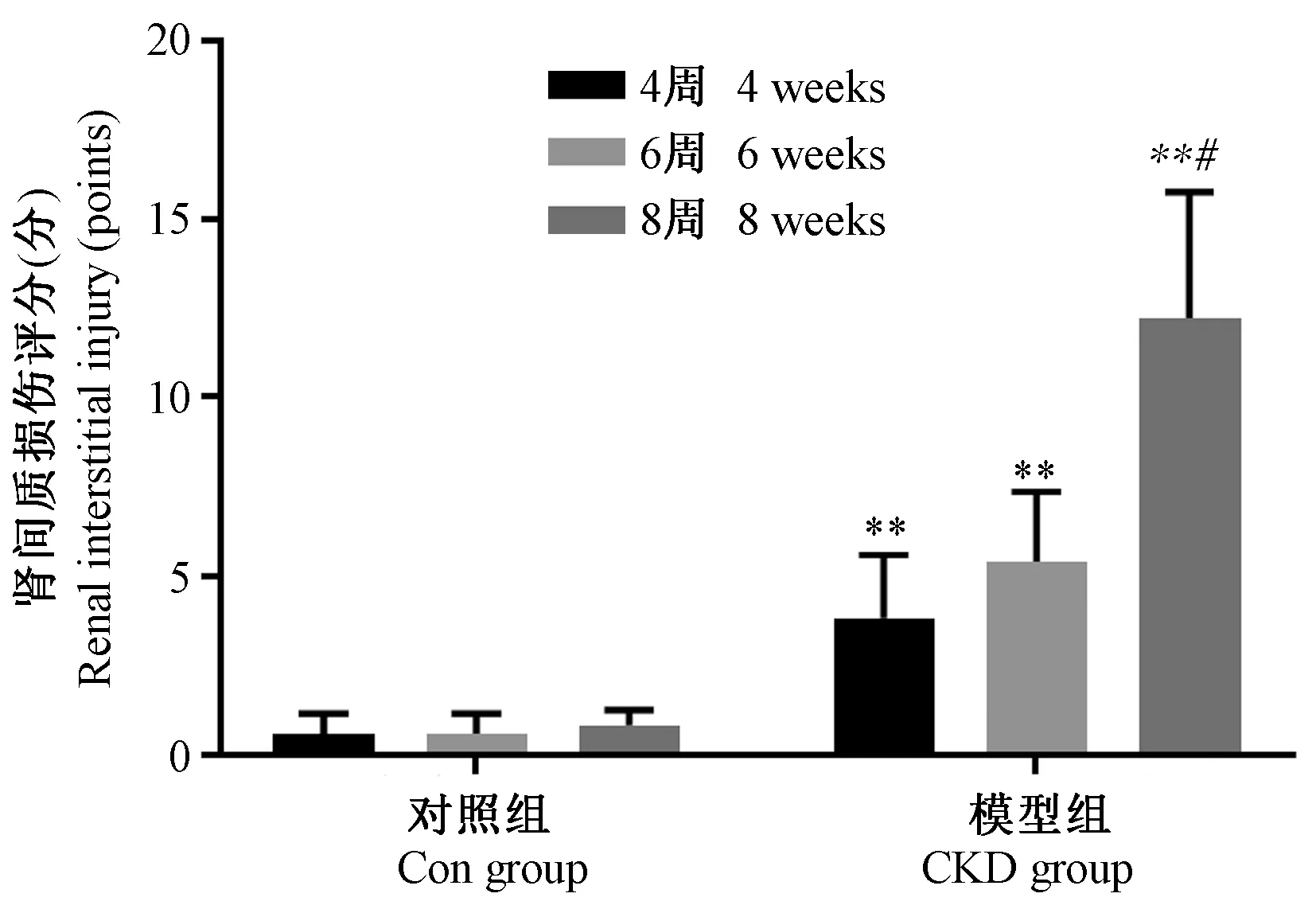
注:与CKD 组前一时间点比较,#P <0.05;与Con 组同一时间点比较,∗∗P <0.01图3 肾间质损伤评分Note.Compared with the previous time point of CKD group, #P <0.05.Compared with the same time point of Con group, ∗∗P <0.01.Figure 3 Renal interstitial injury score
2.3 大鼠肾组织天狼星红染色情况及肾间质纤维化评估
天狼星红染色结果可见:对照组大鼠肾组织无明显胶原纤维沉积;CKD 组自第4 周开始可见肾间质少许淡红色胶原纤维沉积;随着造模时间的延长,CKD组6 周时肾间质红染胶原纤维较前增多,8 周时可见肾间质有大量淡红色胶原纤维沉积(图4)。 天狼星红染色半定量评分结果显示,自第6 周开始肾间质胶原面积较对照组明显增加,差异具有统计学意义(P<0.05;图5),而CKD 组不同时间点胶原面积虽然是逐渐增加的,但差异并无统计学意义。
2.4 两组大鼠肾组织免疫组化染色结果
对照组大鼠肾组织中RhoA 和c-Myc 在肾小球和肾小管细胞胞核中几乎不表达;而CKD 大鼠肾小球细胞胞核可出现RhoA 和c-Myc 表达,而肾小管细胞胞核中表达较对照组均明显增加,差异具有统计学意义(P<0.05),但各时间点之间无明显差异。对照组大鼠肾小球细胞无YAP 表达,肾小管细胞胞质中仅有YAP 少量表达;CKD 大鼠肾小球细胞核中也有少量YAP 表达,第4 周和6 周肾小管细胞胞质和胞核中YAP 表达均有所增加,但差异无统计学意义;第8 周 CKD 大鼠肾小管细胞胞质和胞核中YAP 表达明显增加,且差异具有统计学意义(P<0.05),以胞核表达增加更为显著。 另外,对照组大鼠肾间质中几乎不表达Col1 和α-SMA,但在CKD大鼠中肾间质Col1 和α-SMA 表达明显增加,差异具有统计学意义(P<0.05),且 CKD 大鼠肾小球Col1 表达也明显增加,见图6。
2.5 大鼠肾组织 c-Myc、RohA、YAP、Col1、α-SMA和 Vimentin 的 RT-PCR 结果
RT-PCR 结果显示:CKD 组大鼠肾组织各时间点 c-Myc、 RohA、 YAP、 Col1、 α-SMA 和VimentinmRNA 表达量均较对照组显著增高,差异均有统计学意义(P<0.05;图7)。
2.6 相关性分析
c-Myc、RhoA 和 YAP mRNA 表 达 与 α-SMA mRNA 表达水平均呈显著正相关关系(r=0.818,P=0.004;r=0.77,P=0.009;r=0.83,P=0.003),与Col1mRNA 的表达水平也呈明显正相关(r=0.988P=0.000;r=0.745P=0.013;r=0.927P=0.000),表明 RhoA、YAP 和 c-Myc 表达与肾纤维化程度密切相关。 为了进一步探讨这三者之间的关系,进行 c-Myc、YAP 与 RhoA 相关性的分析,结果显示:YAP 与 RhoA、c-Myc 与 RhoA 之间同样存在着明显的正相关关系(r= 0.661P= 0.038;r=0.721P=0.019;图8)

图4 大鼠肾组织天狼星红染色Figure 4 Sirius red staining of rat kidney tissue

注:与 Con 组同一时间点比较,∗∗P <0.01。图5 天狼星红染色胶原面积半定量评分Note.Compared with the same time point of Con group, ∗∗P<0.01.Figure 5 Semi-quantitative scoring of collagen area by Sirius red staining
3 讨论
肾小管间质纤维化是终末期肾疾病的主要病变之一,主要表现为肾损伤后过量的细胞外基质(ECM)的合成和聚集,其病变机制复杂,可受多种细胞因子和信号通路的调控。 近年来有学者提出Hippo 信号通路在肾间质纤维化过程中扮演着重要角色,其中 YAP 是关键因素。 c-Myc、RhoA 与 YAP在肿瘤的发生发展过程中存在着联系,也有研究表明他们可能参与肾纤维化进程,但关于这三者在慢性肾病肾小管的表达情况及其与肾间质纤维化之间的关系尚未开展研究。 肾纤维化动物模型造模方法众多,包括药物或毒物诱导、手术以及基因敲除等[13]。 在本研究中,我们选用腺嘌呤诱发的大鼠慢性肾病肾纤维化模型,通过检测尿素氮、肌酐、胱抑素C 和24 h 尿蛋白定量等肾损伤的指标,再结合肾组织HE 染色结果等证实CKD 动物造模成功;天狼星红染色显示模型大鼠肾间质出现明显淡红色胶原纤维沉积,α-SMA、Col1 和 Vimentin 纤维化相关标志物的mRNA 水平较对照组明显增加,证实腺嘌呤诱发慢性肾病的大鼠出现了肾小管间质的纤维化,且随时间延长逐渐加重。 肾纤维化的分子机制较为复杂,其中肾小管上皮细胞的损伤、修复功能障碍是导致肾纤维化的重要机制之一[14]。 因此,本研究的研究重点主要是在肾小管间质部分。
c-Myc 是Myc 家族中最重要的成员,作为一种原癌基因,它可以刺激细胞过度生长和增加新陈代谢[15-16]。 Kim 等[17]发现在肿瘤细胞中,c-Myc 的表达激活可导致RhoA 表达增加,而c-Myc 的缺失可导致RhoA 的缺失。 在我们的研究中,c-Myc 在腺嘌呤诱发慢性肾病大鼠的肾小管细胞胞核中高表达,其mRNA 相对表达量与纤维化相关因子呈明显正相关,且c-Myc 和RhoA mRNA 之间也存在着明显的正相关关系,提示肾间质纤维化进程中也可能存在c-Myc-RhoA 信号轴的激活,该过程可能还伴有TGF-β 信号通路的活化[18],但具体机制还有待进一步的研究。
RhoA 是RhoA-GTP 酶的家族成员之一,它的表达受 c-Myc、HIF-1α/2α、Stat 6 和 NF-κB 等几种microRNA 的调控[19],又可调控YAP 活性,但 YAP的激活又可诱导ARHGAP29 转录从而抑制RhoA活性[20]。 在我们的研究中,RhoA 和YAP 在腺嘌呤诱发CKD 大鼠肾小管细胞胞核中均高表达,且mRNA 相对表达量与 α-SMA、Col1mRNA 的相对表达量均呈明显正相关关系,表明二者可能参与了肾小管间质纤维化进程,且可能是通过RhoA 转录调控YAP 活性而实现的。

注:与CKD 组前一时间点比较,#P<0.05;与Con 组同一时间点比较,∗P<0.05,∗∗P<0.01。图7 mRNA 相对表达量Note.Compared with the previous time point of CKD group, #P <0.05.Compared with the same time point of Con group, ∗P<0.05, ∗∗P<0.01.Figure 7 Relative mRNA expression

图8 相关性分析Figure 8 Correlation analysis
目前针对YAP 在肾损伤中所扮演的角色尚无统一定论。 Leach 等[21]人认为,在缺血损伤的心肌细胞中抑制YAP 活性,可以促使心肌细胞再生并改善心功能,并认为这可能同样适用于肾损伤及其修复。 但也有人认为,心脏特异YAP 的表达缺失会阻碍心肌再生,导致心肌纤维化[22]。 我们的研究结果显示,在腺嘌呤诱发的CKD 大鼠模型中,YAP 在肾小管细胞胞核中的表达量是明显增加的,YAP mRNA 表达量较对照组也明显增加,8 周末达到最高。 将8 周末YAP mRNA 表达水平与纤维化标志物α-SMA 和Col1mRNA 的表达水平进行相关性分析,结果显示YAP mRNA 表达量与纤维化标志物mRNA 呈明显正相关关系,表明在慢性肾病中YAP的表达活化可能促进肾间质纤维化。 但需要注意的是,YAP 在肾小管上皮细胞中的早期表达可能是帮助AKI 所致肾小管损伤修复的[23],但当其表达超过某一界限值则可导致肾间质纤维化的发生,因此如何界定其界限范围尚有待更进一步的研究。
综上所述,c-Myc、RhoA、YAP 在腺嘌呤诱发CKD 大鼠的表达可能促进了肾小管间质纤维化过程。 此外,RhoA 和 c-Myc、YAP 之间也存在正相关关系,推测RhoA 可能是联系c-Myc 和YAP 的桥梁,调控c-Myc-RhoA-YAP 信号轴的活化可能延缓肾间质纤维化进程,但具体的机制有待进一步深入研究证实。
