埃克替尼联合放射性粒子植入对老年非小细胞肺癌的EGFR、VEGF和免疫状态的影响
2021-01-23孙颖颖王艺璇张春艳
孙颖颖,王艺璇,张春艳
1.河南科技大学第一附属医院肿瘤科,河南 洛阳 471000;2.河南科技大学第一附属医院手术室,河南 洛阳 471000;3.河南科技大学第一附属医院肾脏内科,河南 洛阳 471000
非小细胞肺癌(NSCLC)是肺癌中最常见的类型,近年来,其发病率和死亡率不断提高[1]。大部分患者在确诊时已发展至III、IV期,无法进行手术治疗。125I粒子植入是治疗肿瘤的重要方法,其对于NSCLC也有较好疗效,通过提高局部放射剂量,确保肿瘤周围组织进行可耐受治疗,有效杀伤肿瘤细胞,达到治疗目的[2]。埃克替尼是一种选择性EGFR 酪氨酸激酶抑制剂,属于小分子靶向抗肿瘤药,具有特异性高、效果好、毒副作用少的优点[3]。为了探讨埃克替尼联合放射性粒子植入对老年NSCLC的EGFR、VEGF和免疫状态的影响,本文选取河南科技大学第一附属医院收治的126例老年NSCLC患者进行研究,获得满意效果。
1 资料与方法
1.1 一般资料
研究对象选自2016 年8 月—2018 年1 月河南科技大学第一附属医院收治的126 例老年NSCLC 患者。纳入标准:年龄≥60 岁;经组织学或细胞学检查确诊为III~IV 期;卡氏评分(KPS)>60 分;东部肿瘤协作组(ECOG)评分0~2分;预计生存期超过3 个月;至少有一个可测量病灶。排除标准:严重心肝肾等脏器疾病;合并慢性阻塞性肺疾病等其他肺部疾病;既往接受过其他分子靶向药物治疗;精神疾病;对研究药物过敏。根据随机数字表法将所有患者分为观察组和对照组,各63例。其中观察组有男性34例,女性29 例,年龄61~80 岁,平均年龄(71.53±7.14)岁;对照组有男性36 例,女性27 例,年龄60~82 岁,平均年龄(70.96±6.98)岁。本研究经过医院伦理委员会批准,患者及家属均签署知情同意书。两组基本资料差异均无统计学意义(P>0.05),具有可比性,见表1。
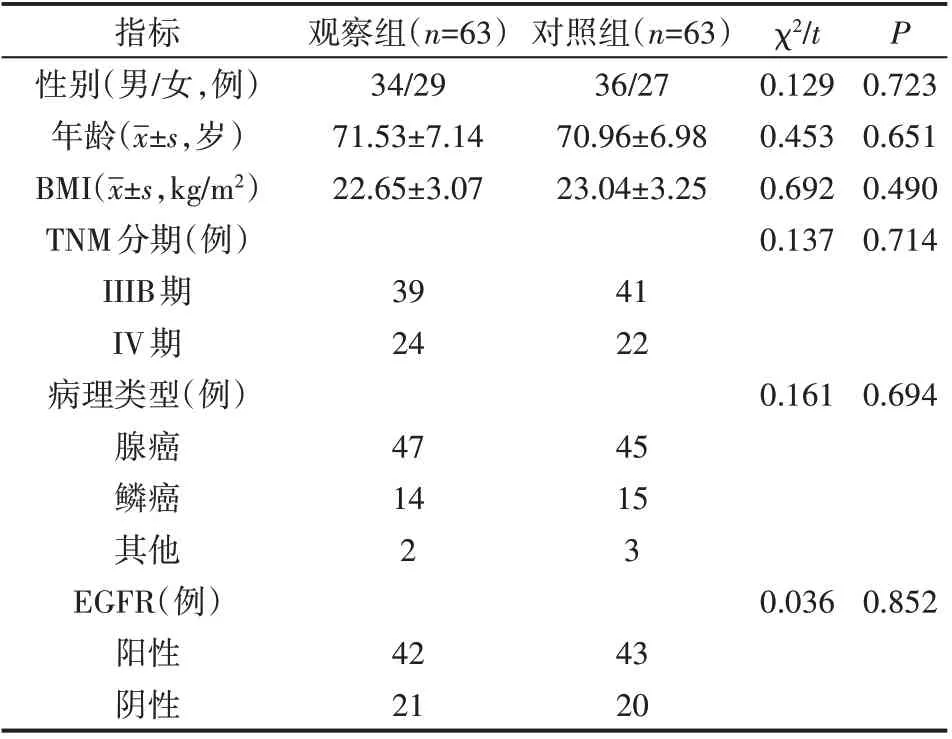
表1 两组患者基本资料比较
1.2 治疗方法
对照组采用多西他赛联合放射性粒子植入治疗。放射性125I 粒子植入:选择和佳放射性粒子治疗系统(HGGR-3000 型);125I 粒子源为赛德(天津)生物制药有限公司,半衰期为59.6 d,组织穿透距离1.7 cm,粒子活度平均(0.8±0.1)mCi;德国SIEMENS公司螺旋CT。术前先通过螺旋CT 薄层扫描,将图像传入三维治疗计划系统(TPS)中,对肿瘤靶区进行三维重建,逆向计算出处方剂量为100~130 Gy。对患者进行局麻,取俯卧位或仰卧位,在CT 扫描下定位,确定穿刺部位和进针方向,再次通过CT 确认穿刺部位已进入肿瘤。然后插植粒子针,每间隔0.5 cm~1.5 cm 植入1 粒放射性粒子,植入深度为距离肿瘤深处边缘0.5 cm。植入完成后逐步退针,根据TPS 行剂量验证,如有遗漏则立即补植。术后常规应用抗菌药,对气胸、血胸、疼痛等并发症进行处理。多西他赛(深圳万乐药业有限公司,国药准字H20060127)每个周期第1 天75 mg/m2,静脉滴注,以21天为一个周期,连续治疗4个周期。观察组采用埃克替尼联合放射性粒子植入治疗。放射性粒子植入方法同对照组,埃克替尼(浙江贝达药业有限公司,国药准字H20110061)口服125 mg,每天3次,直至疾病进展或出现不可耐受的不良反应。
1.3 观察指标
(1)临床疗效:治疗结束后,根据疗效标准进行评价;(2)肺癌治疗状态评价量表(FACT-L4.0)和肺癌患者生存质量量表(QLICP-LU)[4]:FACT-L4.0 由美国研发,中文版信度和效度为0.76~0.82,内容包括生理状况、社会/家庭状况、情感状况、功能状况及肺癌相关状况,共有36个小条目,采用国际统一计分方法进行计分,分数越高,表明患者生活质量越高。QLICP-LU 评分:由我国自主研发,内容包括躯体活动、心理状态、社会功能、共性症状及不良反应、特意模块5 个维度,分数越高,表明患者生活质量越高。(3)肿瘤标志物:所有患者在治疗前后抽取清晨空腹静脉血4 ml,以3 000 r/min 离心15 min,分离获得血清,置于-80℃保存待检。表皮生长因子受体(EGFR)、血管内皮生长因子(VEGF)均采用酶联免疫吸附法检测,试剂盒来自艾博抗(上海)贸易有限公司;(4)免疫功能指标:所有患者在治疗前后抽取清晨空腹静脉血4 ml,采用美国BD FACSCanto II 流式细胞仪检测CD3+、CD4+、CD8+、CD4+/CD8+;(5)毒副作用发生情况:在治疗过程中,记录两组患者的毒副作用,如气胸、咯血、白细胞减少、胃肠道反应、肝损伤、皮疹等。
1.4 疗效评价
参照WHO 实体瘤疗效评价标准进行临床疗效评价[5]:完全缓解(CR):肿瘤完全消失,时间维持在1个月以上;部分缓解(PR):肿瘤缩小体积缩小超过50%,时间维持在1 个月以上;疾病稳定(SD):肿瘤体积减少不足50%,增大不足25%;进展(PD):肿瘤体积增大超过25%,或有新病灶出现。客观缓解率(ORR)=CR+PR,疾病控制率(DCR)=CR+PR+SD。
1.5 统计学方法
采用SPSS 19.0 统计学软件对结果进行分析和处理,FACT-L4.0 和QLICP-LU 评分、肿瘤标志物、免疫功能指标为计量资料,用t检验方法分析;临床疗效、毒副作用发生情况为计数资料,用χ2检验方法分析。当P<0.05 表示差异有统计学意义。
2 结果
2.1 两组患者临床疗效比较
观察组ORR 和DCR 均显著高于对照组,差异有统计学意义(P<0.05),见表2。
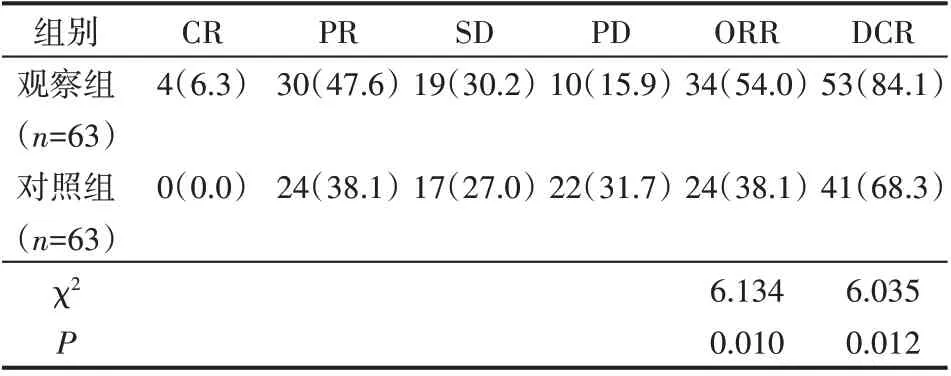
表2 两组患者临床疗效比较 例(%)
2.2 两组患者FACT-L4.0评分比较
治疗前两组患者FACT-L4.0 各维度及总分评分差异无统计学意义(P>0.05),两组患者治疗后FACT-L4.0各维度及总分评分均高于治疗前(P<0.05),且观察组FACT-L4.0各维度及总分评分显著高于对照组(P<0.05),见表3。
2.3 两组患者QLICP-LU评分比较
治疗前两组患者QLICP-LU 各维度及总分评分差异无统计学意义(P>0.05),两组患者治疗后QLICP-LU 各维度及总分评分均优于治疗前(P<0.05),且观察组QLICP-LU各维度及总分评分显著优于对照组(P<0.05),见表4。
表3 两组患者FACT-L4.0评分比较(±s) 分
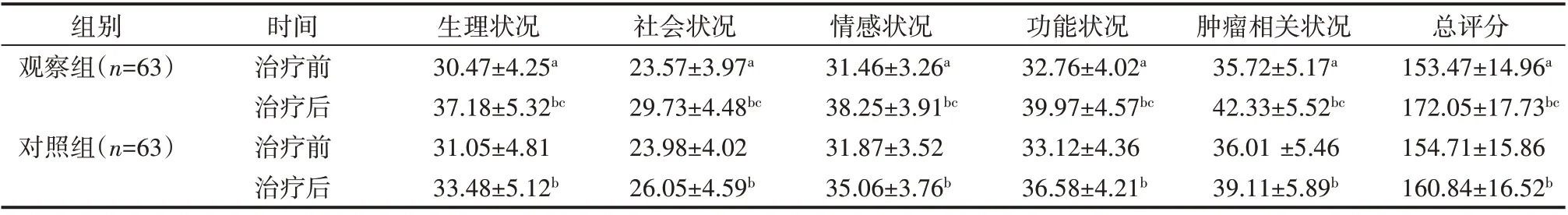
表3 两组患者FACT-L4.0评分比较(±s) 分
注:两组治疗前比较,aP>0.05;治疗前后比较,bP<0.05;两组治疗后比较,cP<0.05
组别观察组(n=63)对照组(n=63)时间治疗前治疗后治疗前治疗后生理状况30.47±4.25a 37.18±5.32bc 31.05±4.81 33.48±5.12b社会状况23.57±3.97a 29.73±4.48bc 23.98±4.02 26.05±4.59b情感状况31.46±3.26a 38.25±3.91bc 31.87±3.52 35.06±3.76b功能状况32.76±4.02a 39.97±4.57bc 33.12±4.36 36.58±4.21b肿瘤相关状况35.72±5.17a 42.33±5.52bc 36.01 ±5.46 39.11±5.89b总评分153.47±14.96a 172.05±17.73bc 154.71±15.86 160.84±16.52b
表4 两组患者QLICP-LU评分比较(±s) 分
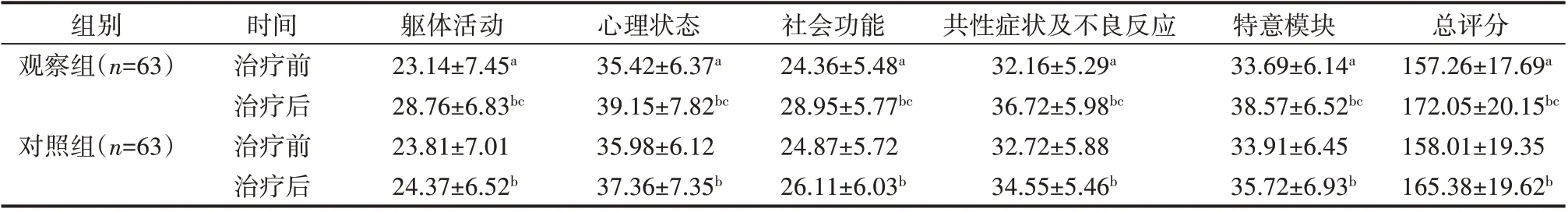
表4 两组患者QLICP-LU评分比较(±s) 分
注:两组治疗前比较,aP>0.05;治疗前后比较,bP<0.05;两组治疗后比较,cP<0.05
组别观察组(n=63)对照组(n=63)时间治疗前治疗后治疗前治疗后躯体活动23.14±7.45a 28.76±6.83bc 23.81±7.01 24.37±6.52b心理状态35.42±6.37a 39.15±7.82bc 35.98±6.12 37.36±7.35b社会功能24.36±5.48a 28.95±5.77bc 24.87±5.72 26.11±6.03b共性症状及不良反应32.16±5.29a 36.72±5.98bc 32.72±5.88 34.55±5.46b特意模块33.69±6.14a 38.57±6.52bc 33.91±6.45 35.72±6.93b总评分157.26±17.69a 172.05±20.15bc 158.01±19.35 165.38±19.62b
2.4 两组患者血清肿瘤标志物比较
治疗前两组患者血清EGFR、VEGF差异无统计学意义(P>0.05),两组患者治疗后血清EGFR、VEGF 水平均低于治疗前(P<0.05),且观察组血清EGFR、VEGF 水平显著低于对照组(P<0.05),见表5。
表5 两组患者肿瘤标志物比较(±s)
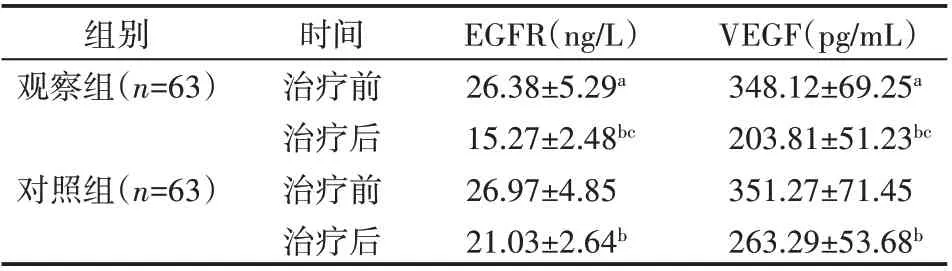
表5 两组患者肿瘤标志物比较(±s)
注:两组治疗前比较,aP>0.05;治疗前后比较,bP<0.05;两组治疗后比较,cP<0.05
组别观察组(n=63)对照组(n=63)时间治疗前治疗后治疗前治疗后EGFR(ng/L)26.38±5.29a 15.27±2.48bc 26.97±4.85 21.03±2.64b VEGF(pg/mL)348.12±69.25a 203.81±51.23bc 351.27±71.45 263.29±53.68b
2.5 两组患者免疫功能指标比较
治疗前两组患者免疫功能差异无统计学意义(P>0.05),两组患者治疗后免疫功能均优于治疗前(P<0.05),且观察组CD3+、CD4+、CD4+/CD8+显著高于对照组,CD8+显著低于对照组(P<0.05),见表6。
2.6 两组患者毒副作用发生率比较
观察组毒副作用发生率(12.7%)显著低于对照组(27.0%),差异有统计学意义(P<0.05),见表7。
3 讨论
近年来,靶向治疗不断应用于临床上肿瘤治疗,其可使分子靶向药物直接于靶点,发挥杀灭肿瘤细胞效果,而对正常细胞无影响,针对性强,且毒副作用少[6]。EGFR是一种糖蛋白,其过度激活后,可与络氨酸蛋白激酶作用,促进肿瘤细胞的增殖、分化、黏附、活动及侵袭,导致细胞正常的周期发生紊乱,引发肿瘤疾病[7]。埃克替尼是我国自主研发的小分子靶向药物,其可阻断肿瘤信号传导过程中的酪氨酸激酶,抑制肿瘤的增殖、生长及转移,促进肿瘤细胞的凋亡,从而发挥抗肿瘤作用[8]。汪建等[9]研究表明,埃克替尼对晚期NSCLC的临床效果肯定,可下调血清细胞角蛋白19 片段(Cyfre21-1)、肿瘤坏死因子-α(TNF-α)、基质金属蛋白酶-9(MMP-9)、VEGF 等肿瘤标志物水平。
125I 放射性粒子植入是一种局部放疗技术,其穿透力极弱,杀伤范围小,比其他放射性物质更安全,具有组织损伤小、术后恢复快、并发症少等优点。其作用机制为粒子通过电子捕获而衰减,持续释放特征为27.4~31.5keV 的X 射线和35.5keV 的γ 射线,X 射线可产生间接电离,产生氧自由基,促使肿瘤细胞凋亡,γ 射线可产生直接电离作用,可使肿瘤细胞DNA 单链或双链断裂[10]。因此通过持续低剂量125I 放射性粒子能有效抑制肿瘤细胞的有丝分裂,进而杀伤肿瘤细胞。李妮等[11]研究表明,放射性125I粒子植入联合化疗治疗老年早期NSCLC疗效较好,且安全、微创、不良反应轻,可有效提高患者的生活质量。
本研究结果表明,观察组ORR 和DCR 均显著高于对照组。说明埃克替尼联合放射性粒子植入对老年NSCLC具有较好疗效,因为放射性粒子植入通过持续的局部放射治疗,增加肿瘤细胞对射线的敏感性,破坏肿瘤细胞的DNA链,抑制肿瘤细胞的增殖,达到治疗的目的。而埃克替尼可靶向性抑制酪氨酸激酶,阻止肿瘤细胞内信号的传递,抑制肿瘤细胞的生长,同时其还可改善机体的免疫状态,加强联合治疗的效果。本研究还表明,观察组FACTL4.0、QLICP-LU 各维度及总分评分均显著高于对照组。提示经过联合治疗后,患者的生存质量明显提高,因为放射性粒子植入是一种局部治疗法,仅针对肿瘤病灶,对正常组织无影响,因此不良反应少。埃克替尼也是一种靶向药物,还能增强机体免疫功能,使患者耐受性提高,因此联合治疗后肿瘤得到有效控制,患者的生活质量明显提高。
表6 两组患者免疫功能比较(±s)
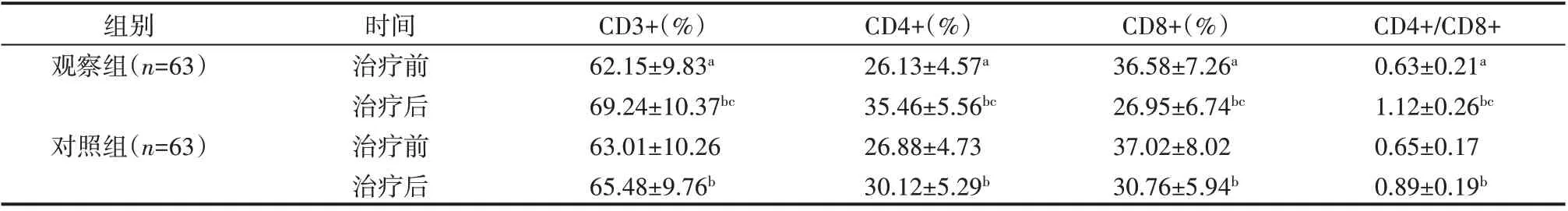
表6 两组患者免疫功能比较(±s)
注:两组治疗前比较,aP>0.05;治疗前后比较,bP<0.05;两组治疗后比较,cP<0.05
组别观察组(n=63)对照组(n=63)时间治疗前治疗后治疗前治疗后CD3+(%)62.15±9.83a 69.24±10.37bc 63.01±10.26 65.48±9.76b CD4+(%)26.13±4.57a 35.46±5.56bc 26.88±4.73 30.12±5.29b CD8+(%)36.58±7.26a 26.95±6.74bc 37.02±8.02 30.76±5.94b CD4+/CD8+0.63±0.21a 1.12±0.26bc 0.65±0.17 0.89±0.19b
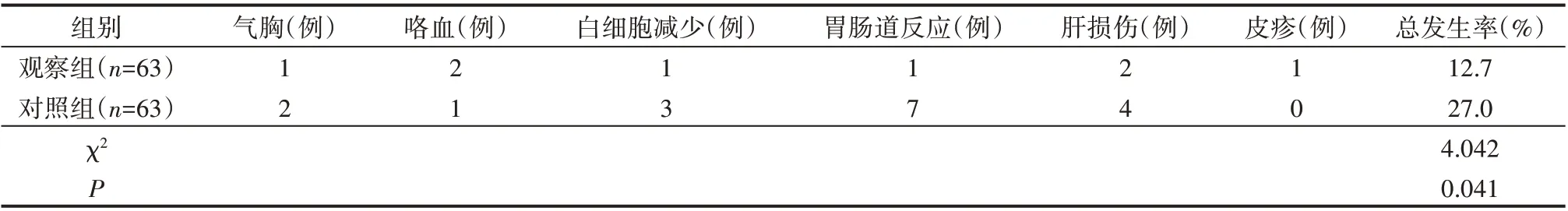
表7 两组患者毒副作用发生率比较
在大部分NSCLC患者中EGFR表达是增高的,EGFR是表皮生长因子细胞增殖和信号传导的受体,当其过度表达时,可激活细胞下游通路,导致细胞过度生长,形成肿瘤[12]。VEGF是已知的作用最强的促血管生成因子,可刺激肿瘤新生血管内皮细胞的增殖,诱导血管的形成,促进肿瘤的转移[13]。本研究结果显示,观察组血清EGFR、VEGF水平显著低于对照组。说明联合治疗降低肿瘤组织EGFR、VEGF的生成,通过同时抑制EGFR 和VEGF,有效杀伤肿瘤细胞,还能抑制其侵袭性,阻止其向其他组织转移。
在机体抗肿瘤免疫过程中,T 淋巴细胞亚群起重要作用,机体免疫功能的下降,可促进肿瘤的发生、发展。CD3+参与T细胞信号传导,CD4+辅助T细胞识别抗原的受体,CD8+直接参与杀伤病毒和肿瘤细胞。在正常情况下,CD4+/CD8+保持着动态平衡,肿瘤患者往往都存在CD4+/CD8+的失衡。本研究结果中,观察组CD3+、CD4+、CD4+/CD8+显著高于对照组,CD8+显著低于对照组。提示治疗后提高了患者的免疫功能,有利于控制肿瘤,降低肿瘤发生转移的风险。另外,观察组毒副作用发生率显著低于对照组,提示联合治疗较为安全,患者可以耐受。
综上,埃克替尼联合放射性粒子植入对老年NSCLC的疗效显著,可有效改善患者的免疫功能,提高生活质量。
