叶绿素结合蛋白CP24介导光照响应基因StRSM 1调控叶绿素积累
2021-01-22撒世娟伍涵宇张晓萍郑蕊姚新灵
撒世娟 伍涵宇 张晓萍 郑蕊,2 姚新灵,2
(1. 宁夏优势特色作物现代分子育种重点实验室 宁夏大学,银川 750021;2. 西部特色生物资源保护及利用教育部重点实验室 宁夏大学,银川 750021)
拟南芥基因组注释中最早识别了RSM(RADIALIS-like SANT/MYB)的存在,RSM仅含有单个MYB结构域,这是其不同于其它MYB转录因子的组成特征[1],在已测序的植物基因组中均有RSM基因;在比较拟南芥和水稻MYB转录因子进化关系研究中,就RSMR是否属于MYB基因家族存在不同观点[1-2]。
早期有研究将拟南芥中含有单个MYB结构域的4个RSM蛋白(RSM 1、RSM 2、RSM 3和RSM 4)归为单MYB转录因子家族;研究显示,RSM 1(AT4G39250)过量表达幼苗生长顶端弯钩缺失,下胚轴变短,早期光形态建成时对红光过敏;推测RSM 1参与早期光形态建成调控[3];RSM 1参与了光照诱导顶端分生组织的细胞分裂调控和形态建成。
上调水稻(Oryza sativa)OsRL3(RADIALIS-LIKE3)表达,加速叶片黑暗下衰老;osrl3突变体黑暗下叶片叶绿素滞留,光合能力增强,叶绿素降解相关基因表达水平低于野生型[4]。水稻OsRL3反向调控叶绿素代谢,但调控机理未知。
研究已明确,一定数量的叶绿素等色素分子与叶绿素结合蛋白24(CP24)结合,保持其稳定性和活性;弱光下更多叶绿素与CP24结合,行使吸收光子功能,强光下更多胡萝卜素与CP24结合,发挥光保护作用,黑暗下叶绿素和CP24积累迅速减少[5-11]。CP24响应光照和黑暗直接参与叶绿素代谢,哪些基因参与CP24表达尚未见报道。
拟南芥RSM1参与其光形态建成和水稻OsRL3调控叶绿素代谢的结果,明确了RSM是光照和黑暗响应基因;但转录因子RSM1如何响应光照和黑暗变化有待研究确定。为了确定转录因子RSM1决定的表型及响应光照和黑暗变化的路径,本研究基于反向遗传学思路,以功能未知的马铃薯(Solanum tuberosumL.)基因StRSM1为研究对象,运用基因转化、阳性转化株系表型测定和目的基因表达定性测定等方法,揭示了StRSM1通过调控CP24表达及叶绿素积累响应光照和黑暗变化。
1 材料与方法
1.1 材料
供试材料为实验室自行保存和维护的普通烟草(Nicotiana tabacumL.)K326和马铃薯品种紫花白组培苗,以其作为野生型对照和目的基因转化受体;根癌农杆菌(Agrobacterium tumefaciens)菌株GV3101、大肠杆菌重组菌BL-pC-35S均由本实验室保存,委托上海生工生物科技公司合成本研究所用引物,其系列如表1所示。

表1 引物序列
转化株系及WT室内培养条件为(24±2)℃,10 h光照,14 h黑暗,光照强度为100 μmol·m-2·s-1,相对湿度60%-80%,土壤水含量70%±5%。采集移栽生长第30天的幼叶置于液氮,用于RNA提取。
1.2 方法
1.2.1 重组StRSM1构建和体内转化 委托上海生工生物科技公司合成StRSM1基因全长ORF cDNA,完成重组载体pC-StRSM1+和pC-StRSM1-构建,构建过程如图1所示。电激转化重组载体于根癌农杆菌菌株GV3101,卡娜霉素和潮霉素抗性筛选和SRSMF/R引物PCR鉴定,获得重组菌株GV-StRSM1+和GV-StRSM1-;分别按照已报道的外源基因马铃薯(Solanum tuberosum)和本氏烟草(Nicotiana benthamiana)体内转化方法[12],重组菌侵染外植体、愈伤诱导、阳性苗GUS染色选择后,用特异引物SRSMF/SRSMR和叶片RNA建立RT-PCR反应,确认阳性株系StRSM1表达,依此获得本氏烟草和马铃薯体内StRSM1过量和抑制表达株系,两者转化株系中,选取StRSM1过量和抑制表达株系各2株进行以下实验。
用引物qRSMF/R建立PCR反应体系,以L25为内参基因,完成RSM1 mRNA积累的实时荧光定量PCR测定,反应条件为95℃ 5min预变性后,95℃ 15 s,62℃ 30 s,45个循环,熔解曲线65℃-95℃;3次样品重复测定3次,用比较Ct值法计算StRSM1相对表达量。
1.2.2 目的株系生理表型测定 用日本KONICA MINOLTO公司生产的SPAD-502 Plus型叶绿素仪,测定普通烟草WT和其转化株35 d幼苗全部叶片及马铃薯WT和其转化株40 d幼苗全部叶片叶绿素含量,测定重复3次,每次测定重复3次,以SPAD作为叶绿素含量计量单位。
1.2.3StRSM1过量表达而变化的叶绿素代谢及结合蛋白的基因识别 室内培养条件下,设定14 h光照(CL)和10 h黑暗(CD)作为对照光照,8 h光照(SL)和16 h黑暗(LD)作为短光照处理,在对照和处理光照下,培养StRSM1过量表达株系35 d幼苗5 d,幼苗苗龄40 d时,采集其叶片样品3份,用上述同样方法,提取和处理叶片RNA,反转录获得cDNA。
基于StRSM1过量表达改变了叶绿素积累,检索马铃薯基因组数据库,获得参与叶绿素代谢和结合的基因cDNA序列,依据序列设计叶绿素代谢和结合的基因特异引物,用光照处理叶片RNA和合成的特异性引物,建立RT-PCR反应。依据StRSM1过量表达株系光照处理样品RT-PCR产物的变化,确定StRSM1过量表达变化的叶绿素代谢和叶绿素结合蛋白的基因。
其中,依据马铃薯基因组数据库记载的CP24(ID:DMG400012591)DNA序列设计并合成其特异引物612F/R,以L25为内参基因完成PCR,反应条件为95℃预变性3 min、94℃变性30 s、50℃退火35 s、72℃延伸1min的条件下循环25次后,72℃延伸10 min,4℃保存;反应产物用1%琼脂糖胶电泳观察不同处理下CP24定性表达结果。
1.2.4 数据分析 用Statistical Program for Social Sciences(SPSS)V19.0中t检验完成所有测定数据的统计分析。
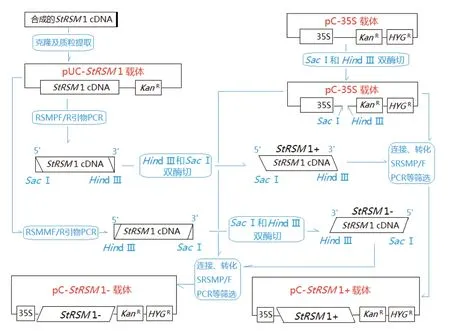
图1 载体pC-StRSM 1+和pC-StRSM 1-构建过程示意图
1.2.5 序列检索及分析 用茄科基因组数据库https://solgenomics.net/和马铃薯基因组数据库http://solanaceae.plantbiology.msu.edu/、Uniprot数据库https://www.uniprot.org检索相关序列、clustal Omega在线http://www.clustal.org/软件序列比对分析。
2 结果
2.1 StRSM 1及其茄科同源物具有茄科特异性
本实验室前期研究光照周期处理马铃薯,转录组测序识别了StRSM1和StRSM1含有255 bp的开放阅读框,编码84个氨基酸组成的蛋白质;预测氨基酸序列检索马铃薯基因组数据库,识别了4个与StRSM1一致性大于56%的氨基酸序列,比对结果如图2-A所示,其中与StRSM1氨基酸序列最接近的DMP400001385(DMG400000709)一致性仅为65%;与StRSM1同源的拟南芥序列为蛋白质RADIALIS-like 1(AT4G39250),两者氨基酸序列比对如图2-B所示,两者一致性仅为69%。
番茄(Solanum lycopersicum)、野生烟草(Nicotianaattenuata)、普通烟草(Nicotiana tabacumL.)和甜椒(Capsicum annuum)等茄科植物的StRSM1同源物序列比对,如图2-C所示,其一致性大于80%,且功能结构域高度保守。

图2 StRSM 1与不同同源物氨基酸序列比对
检索结果发现,与StRSM1同源的拟南芥序列一致性较低,而其茄科同源序列高度保守,表明StRSM1及其茄科同源基因具有茄科特异性,StRSM1是马铃薯基因组中的单拷贝基因,其功能有待确定。
2.2 StRSM 1表达反向调控叶绿素积累
以pC-35S和StRSM1 cDNA构建其过量和抑制表达载体pC-StRSM1+和pC-StRSM1-,载体酶切分析和测序证实后,分别转化普通烟草和马铃薯基因组,依据报告基因GUS染色和RSM1表达定量结果进行选择,获得了RSM1过量表达普通烟草阳性转化株系ntrsm+1和ntrsm+2、抑制表达阳性转化株系ntrsm-1和ntrsm-2,马铃薯过量和抑制表达StRSM1株系strsm+1和strsm+2及strsm-1和strsm-2。
RSM1表达RT-qPCR相对定量结果如图3-A和3-B所示,过量表达株系ntrsm+1和ntrsm+2及strsm+1和strsm+2 中RSMmRNA积累倍数极显著高于WT(P≤0.01),表明RSM+cDNA体内表达促进了NtRSM1和StRSM1同源mRNA表达;抑制表达阳性株系ntrsm-1和ntrsm-2及strsm-1和strsm-2叶片RSMmRNA积累倍数极显著低于WT(P≤0.01),表明RSM-cDNA体内表达抑制了NtRSM1和StRSM1同源mRNA表达。
普通烟草和马铃薯叶片过量和抑制表达StRSM1,改变了两者叶片颜色,如图3-C所示,与WT相比,过量StRSM1表达马铃薯阳性株系叶色较浅,但抑制StRSM1表达马铃薯阳性株系叶片绿色明显加深。
叶绿素含量(SPAD)测定结果如图3-D和3-E所示,普通烟草和马铃薯StRSM1抑制表达阳性株系ntrsm-1和ntrsm-2及strsm-1和strsm-2叶片叶绿素含量极显著高于对照(P≤0.01),ntrsm+1和ntrsm+2及strsm+1和strsm+2株系叶片叶绿素含量极显著低于对照(P≤0.01);结果表明,StRSM1过量表达减少了叶绿素积累;抑制StRSM1表达,叶绿素积累则会增加;抑制StRSM1表达的结果,与已报道的RSM3突变体倒置使黑暗诱导的叶绿素减少的研究结果一致。
2.3 随StRSM表达变化而改变的叶绿素代谢和叶绿素结合蛋白基因
检索数据库识别了72个叶绿素代谢和叶绿素结合蛋白(CMB)编码基因,用这些基因各自特异引物进行RT-PCR,依此作为CMB基因表达定性结果,比较对照和光照处理条件下StRSM1过量表达株系中CMB基因随黑暗和光照的表达变化,确定随StRSM1过量表达而改变表达的CMB基因。
RT-PCR结果显示,72个CMB基因中,叶绿素合成酶、叶绿素b还原酶、叶绿素酶、原叶绿素氧化还原酶等编码基因表达在处理和对照间无可见稳定变化,其中叶绿素结合蛋白CP24基因在光照处理和对照间表现稳定变化。
如图4所示,在马铃薯和普通烟草的野生型(WT)中,RT-PCR仅检测到CP24在对照光照(CL)条件下表达,对照黑暗(CD)未检出可见产物;StRSM1过量表达马铃薯和普通烟草株系中,CL和CD条件下均获得明显可见的RT-PCR产物;StRSM1过量表达株系在LD和SL条件下,CP24呈现与CL和CD条件下相同的表达模式。结果表明,StRSM1过量表达改变了CP24的表达模式,即增加了黑暗条件下CP24的表达量。

图4 随RSM 1过量表达的CP24基因RT-PCR产物
3 讨论
早期许多研究报道了光照对叶绿素积累的影响[13-14],其后的研究就此得到的基本结论认为,强光条件下,叶绿体中类胡萝卜素组分积累增加,发挥光保护作用;弱光条件下,叶绿素积累相对增加;黑暗下,叶绿素和叶绿素结合蛋白积累迅速减少[5-6]。不同植物色素吸收光谱不同,光照强弱变化改变了LHC中的色素组成。
叶绿体和类胡萝卜素合成均来自类异戊二烯(MEP)途径,两者有共同的合成底物[15-16];弱光条件下,叶绿素积累增加[5-6];尽管需更多实验证据支持,但依此有理由推测,高光照诱导类胡萝卜素等光保护色素积累增加,其合成消耗了更多合成底物,叶绿素合成相对减少;弱光下,光保护色素合成减少,更多合成底物用于叶绿素合成,叶绿素相对增加。RSM1表达减少增加叶绿素积累的结果与弱光条件下叶绿素积累增加一致,RSM1表达减少促进叶绿素积累的结果也表明,RSM1反向调控叶绿素积累。该结果与已报道的水稻RSM3突变体倒置使黑暗诱导叶绿素减少的结果一致。
叶绿素结合蛋白CP具有聚集和结合色素及传递电子等功能,色素聚集并结合于CP[9],维持色素活性和可测状态,黑暗下叶绿素和CP24积累迅速减少[11-14],这些结果同时也表明,除了不同色素合成平衡响应光照外,CP在响应光照变化中发挥更重要作用。本研究黑暗(CD)下未检测到WT中CP24存在,证实了黑暗下CP24积累迅速减少;StRSM1过量表达株系中CD和LD下CP24存在的原因是StRSM1过量表达,结果明确了StRSM1参与CP24积累。
天线蛋白聚集色素形成光子吸收和电子传递复合体,光照调控色素与其结合蛋白积累变化,维持复合体光保护和光合的动态;天线蛋白结构及功能的研究已较多,但其如何受到上游基因表达调控还不是很清楚。
本研究初步揭示了StRSM1随光照调控CP24表达,继而改变叶绿素积累;该结果建立了光照、RSM1转录因子、CP24和叶绿素积累间的联系,结果对于进一步明确RSM1如何响应光照和深刻理解RSM1参与的光照响应具有作用。
StRSM1及其茄科同源基因均含有高度保守的单个MYB结构域,StRSM1在马铃薯基因组中是单拷贝,其与拟南芥同源基因相似性较低,这表明了其差异进化的特征;单个MYB结构域重复形成了其它MYB转录因子的事实,表明了StRSM1是更早出现在基因组中的基因,StRSM1功能的初步确定有助于揭示光合作用这一古老生理现象。
研究中发现,过量表达RSM1,增加了马铃薯和普通烟草体内光照和黑暗下CP24 mRNA的积累,尤其是黑暗下CP24积累增加明显可见;普通烟草转化株系中,短光照(SL)和对照光照(CL)下未出现CP24 mRNA积累的可见差异,但长黑暗(LD)下,CP24 mRNA积累明显更多,其原因有待进一步研究。
4 结论
本研究发现,茄科植物特异单MYB转录因子StRSM1光照响应,反向调控叶绿素积累,叶绿素结合蛋白CP24参与了StRSM1对叶绿素积累的调控。
