基于SSR分子标记的73份山葡萄及杂交后代的遗传多样性分析
2021-01-22王衍莉杨义明范书田赵滢许培磊路文鹏李昌禹
王衍莉 杨义明 范书田 赵滢 许培磊 路文鹏 李昌禹
(中国农业科学院特产研究所,长春 130112)
山葡萄(Vitis amurensisRupr)又名东北山葡萄,是葡萄科落叶藤本植物,是葡萄属中最抗寒的种,其野生资源主要分布于我国东北、俄罗斯远东和朝鲜半岛。在东北地区山葡萄是酿造葡萄酒的主要原料[1-2]。近年的研究还发现其山葡萄果实中含有18种游离氨基酸,富含丰富的白藜芦醇和花色素苷等成分,是抗氧化、防癌的有效成分,可用于保健品和化妆品的研发[3-4]。过去由于野生山葡萄生存环境的破坏,导致山葡萄浆果蕴藏量,山葡萄遗传多样性不断下降,为了扩大山葡萄产量,提高山葡萄品质,丰富山葡萄资源的遗传多样性,20世纪60年代研究人员对野生山葡萄资源进行资源收集、家植驯化、杂交育种获得了许多具有优良性状的山葡萄资源,以发现的两性花山葡萄“双庆”为亲本,选育了抗性较强的酿酒品种“北冰红”、“左优红”等[5]。目前不同山葡萄品种间的果实产量和品质仍存在较大差异,了解不同品种山葡萄的遗传背景,引进具有优良性状的山葡萄品种,有目的地选择育种亲本培育优质新品种,丰富山葡萄种质资源依然是山葡萄栽培利用研究的重要内容之一[6-7]。
SSR分子标记技术因其共显性遗传、多态性位点多、信息含量丰富并且所需DNA量少,目前广泛被用于分子标记开发、种质鉴定、遗传多样性分析、数量性状基因座(QTL)分析、基因定位、亲缘关系鉴定等[8-9]。本研究利用SSR分子标记技术分析团队从俄罗斯引进的葡萄栽培品种和野生葡萄资源与东北山葡萄选育品种之间的遗传差异,明确种质间的亲缘关系和遗传分化程度,旨在为山葡萄资源评价、良种选育及分子标记辅助育种奠定基础。
1 材料与方法
1.1 材料
选取葡萄植株新稍上大小约2 cm2的叶片,放入-80℃冰箱保存备用。葡萄资源信息见表1。
植物DNA提取相关试剂购自上海生工,生工植物基因组提取试剂盒,三氯甲烷,无水乙醇,异丙醇。
所用仪器有JY-CZ-BL电泳仪,Biorad-PCR扩增仪,紫外分光光度计,Biorad凝胶成像系统等。
1.2 方法
1.2.1 基因组DNA的提取 采用生工植物基因组提取试剂盒,提取山葡萄基因组DNA,应用琼脂糖凝胶电泳及紫外分光光度计检测DNA质量。将质量合格的基因组DNA放入-20℃冰箱保存。
1.2.2 SSR引物筛选 选取“双庆”、“双丰”、“北国蓝”、RS1201、RS1402、RS1509、RS1801和RS-1807的DNA为模板,根据石广丽[6]的山葡萄PCR体系反应程序,对30对SSR引物进行筛选,选择扩增条带清晰且具有多态性的引物,用于73份葡萄资源的遗传多样性分析,引物信息见表2。

表1 73份葡萄材料的信息
1.2.3 73份葡萄资源的PCR扩增及丙烯酰胺凝胶电泳检测 根据石广丽[6]的PCR扩增反应体系优化后的反应体系(16 μL):上下游引物(5 μmol/L)各0.3 μL,2×Taq PCR StarMix 8 μL,基因组DNA 1.5 μL,ddH2O 5.9 μL。反应程序:94℃预变性5 min,94℃变性 40 s,59℃-63℃复性 40 s,72℃延伸 40 s,共30个循环;72℃延伸 7min。

表2 11对引物信息
扩增产物用6%的变性丙烯酰胺凝胶电泳检测,电泳电压250 V,时间2.5 h,采用银染法,对丙烯酰胺凝胶进行染色,拍照。
1.2.4 数据分析 采用0、1二元数据记录SSR条带,有条带记为“1”,无条带记为“0”,数据缺失记为“9”,应用NTsys软件对73份山葡萄材料进行聚类分析,使用POPGENE32软件计算观察等位基因数Na、有效等位基因数Ne、引物多态性信息含量PIC、观测期望杂合度He、Shannon信息指数I、Nei’s遗传多样性指数,遗传分化系数Fst以及群体的遗传距离和遗传相似性。
2 结果
2.1 山葡萄及杂交后代的PCR扩增
30对SSR引物中共筛选出11对扩增条带清晰且具有多态性的引物。11对多态性SSR引物对73份山葡萄及杂交后代进行PCR扩增,经丙烯酰胺凝胶电泳检测,结果见图1。

图1 部分SSR位点的PCR扩增结果
2.2 山葡萄及杂及杂交后代的SSR遗传多样性分析
使用POPGENE32对11对SSR引物的扩增结果进行分析,分析结果见表3。11对引物共扩增到75个等位基因,每个位点扩增3(VVIN31)-10(VVS2)个等位基因,平均等位基因6.8182个,各位点多态性信息含量(PIC)变化范围为0.2337(VVIN31)-0.8098(VVS2)表明VVIN31、VMCA12位点只具有低中度多态性,其余9个位点都具有高度多态性;有效等位基因(Ne)在5.280(VVS2)-1.3050(VVIN 31)之间,平均值为3.5196,与观察到的等位基因数存在着较大的差距,说明等位基因在群体内的分布不均匀;基因多样性指数(I)范围1.8830(VVS2)-0.4678(VVIN31),平均值1.3736;Nei’s遗传多样指数在0.8098(VVS2)-0.2337(VVIN31)之间,平均值0.6444,以上指标在群体内存在较大差异,表明不同位点的遗传变异差异较大;观测杂合度变化范围为0.1667-0.9315,平均值0.4642,期望杂合度变化范围0.8154-0.2353,平均值为0.6489,不同位点杂合度差异较大,平均观测杂合度低于期望杂合度,表示种群内存在一定的近交率,杂合子缺失,纯合性比较高。

表3 11个SSR位点的遗传变异和杂合性
2.3 种质间亲缘关系及遗传分化分析
应用Ntsys软件分析73份种质的遗传距离和遗传相似性,73份种质的遗传聚类变化范围01.708,遗传相似系数为0.68-1.0表明各种质间亲缘关系差异较大,根据遗传相似系数对73份种质做聚类分析,结果见图2。由图可知,相似系数0.690处,73份山葡萄及杂交后代聚为2类,俄罗斯选育葡萄品种RS1402、RS1403、RS1404、RS1405、RS1410、RS1511聚为Ⅰ类,在相似系数0.711处73份葡萄资源被分为3大类,第Ⅱ类包含1份从俄罗斯引种的“哈桑”、东24-13-1和10份俄罗斯葡萄品种RS1201、RS1202、RS1203、RS1204、RS1401、RS1406、RS1407、RS1408、RS1409以及1份俄罗斯野生葡萄资源RS1819,第Ⅲ类包含山葡萄选育品种9份和45份俄罗斯野生葡萄资源。采用F统计法,分析73份山葡萄及杂交后代资源的遗传变异及基因流,分析结果见表4。由表4可知群体内的平均近交系数为0.1777,整个群体近交系数为0.2753,表示群体杂合子缺失,遗传分化系数为0.1183,基因流为1.8641,表明群体间遗传中度分化,基因流较丰富。
2.4 多样性在不同种质类型的葡萄资源间的分布
将73份山葡萄及杂交后代资源按照种质类型分成3个群体:山葡萄选育品种、俄罗斯选育葡萄品种、俄罗斯野生葡萄品种进行多样性分析,结果(表5)发现,3个群体中俄罗斯野生葡萄品种的等位基因数最高,山葡萄选育品种的等位基因最少;期望杂合度表明俄罗斯选育葡萄品种的杂合度最高,并且根据Shannon信息指数和Nei’s遗传多样性指数都表明俄罗斯选育的葡萄品种有更高的遗传多样性。3个群体的遗传距离数据见表6,结果表明山葡萄选育品种与俄罗斯野生葡萄品种的遗传距离更近,俄罗斯选育葡萄品种与前2个群体的遗传距离较远,这与73份葡萄资源的聚类分析结果基本一致,说明山葡萄选育品种与俄罗斯野生葡萄品种的相似性更高,亲缘关系更近。
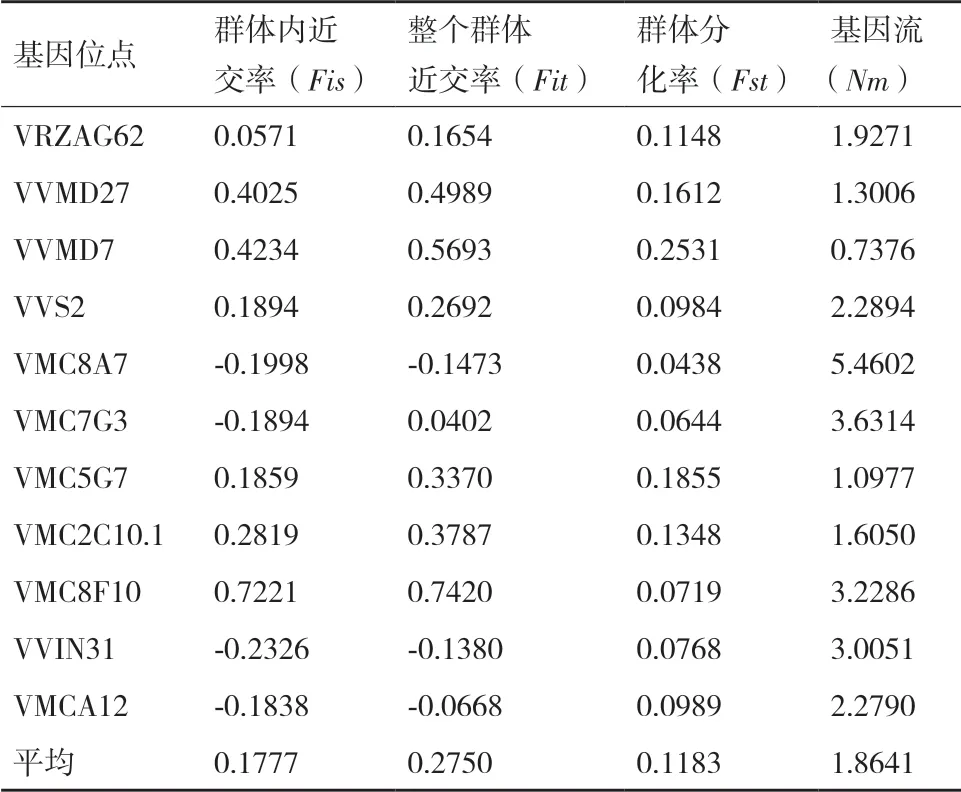
表4 位点的F统计量和基因流
3 讨论
遗传多样性是生物多样性的重要组成部分,遗传多样性是指种内不同居群之间或者一个居群内的不同个体之间的遗传变异的总和。一个物种的遗传多样性能够反映该物种在特定环境中的基因丰富程度,了解一个物种的遗传多样性,对种质资源的评价、保护和利用、创新提供重要依据[10-11]。遗传多样性评价参数能够反映种内不同居群之间及居群内不同个体之间的遗传变异水平,多态信息含量(PIC)反映SSR位点变异程度,数值越大,变异越多;观测等位基因数和有效等位基因数反映等位基因分布的均匀程度,2个指标越接近,说明等位基因分布越均匀;Fis、Fit表示群体近交系数,数值大于零,表示居群内纯合体多,反之则杂合体过量[12-14]。
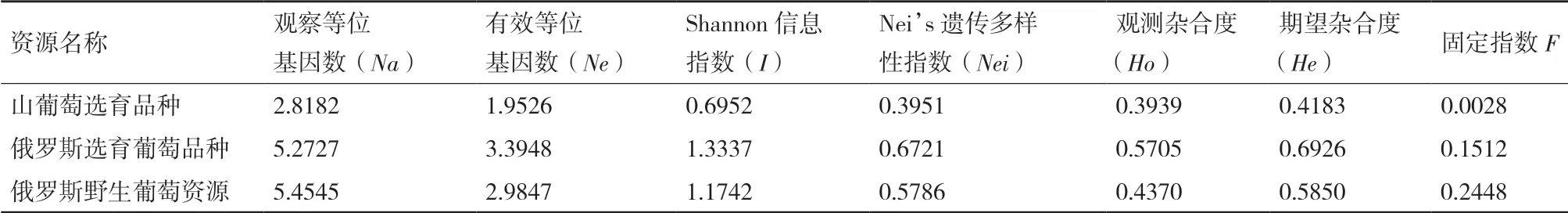
表5 不同群体的葡萄资源的遗传变异和杂合性
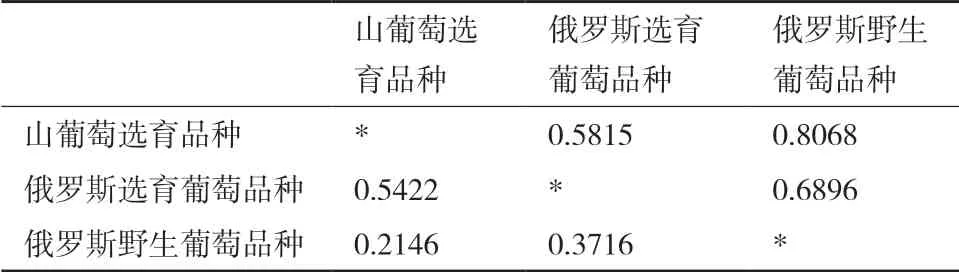
表6 群体遗传距离和遗传相似系数
SSR分子标记技术能够揭示葡萄不同种质间的遗传差异及亲缘关系[15]。张子龙[16]利用SSR分子标记分析了14个酿酒葡萄品种的亲缘关系,并通过不同引物组合鉴定了14个酿酒葡萄品种;张萌[17]用15对SSR引物分析79份葡萄资源的亲缘关系发现,中国野生葡萄资源与欧亚种和欧美杂交种葡萄亲缘关系较远,同时用8对引物分析黄山、湖南和福建地区的刺葡萄资源的遗传多样性,发现黄山地区刺葡萄遗传差异较少,刺葡萄基因流限制于短距离。温景辉等[18]利用19对SSR引物对20个葡萄品种聚类分析,发现欧亚种与美洲种葡萄亲缘关系较近,山葡萄与欧亚种和美洲种的亲缘关系较远;方连玉等[19-20]利用11对SSR引物分析15个葡萄品种的遗传多样性,结果显示,山葡萄与山欧杂交葡萄品种聚为一类,而美洲葡萄和欧亚种葡萄聚为一类,本研究的聚类结果与之相似。杨航宇等[21]利用6对SSR引物很好地区分了43份酿酒葡萄品种和鲜食葡萄品种,聚类结果并也证实葡萄种群的形成与其起源地的地理位置和气候环境有着密切的关系。
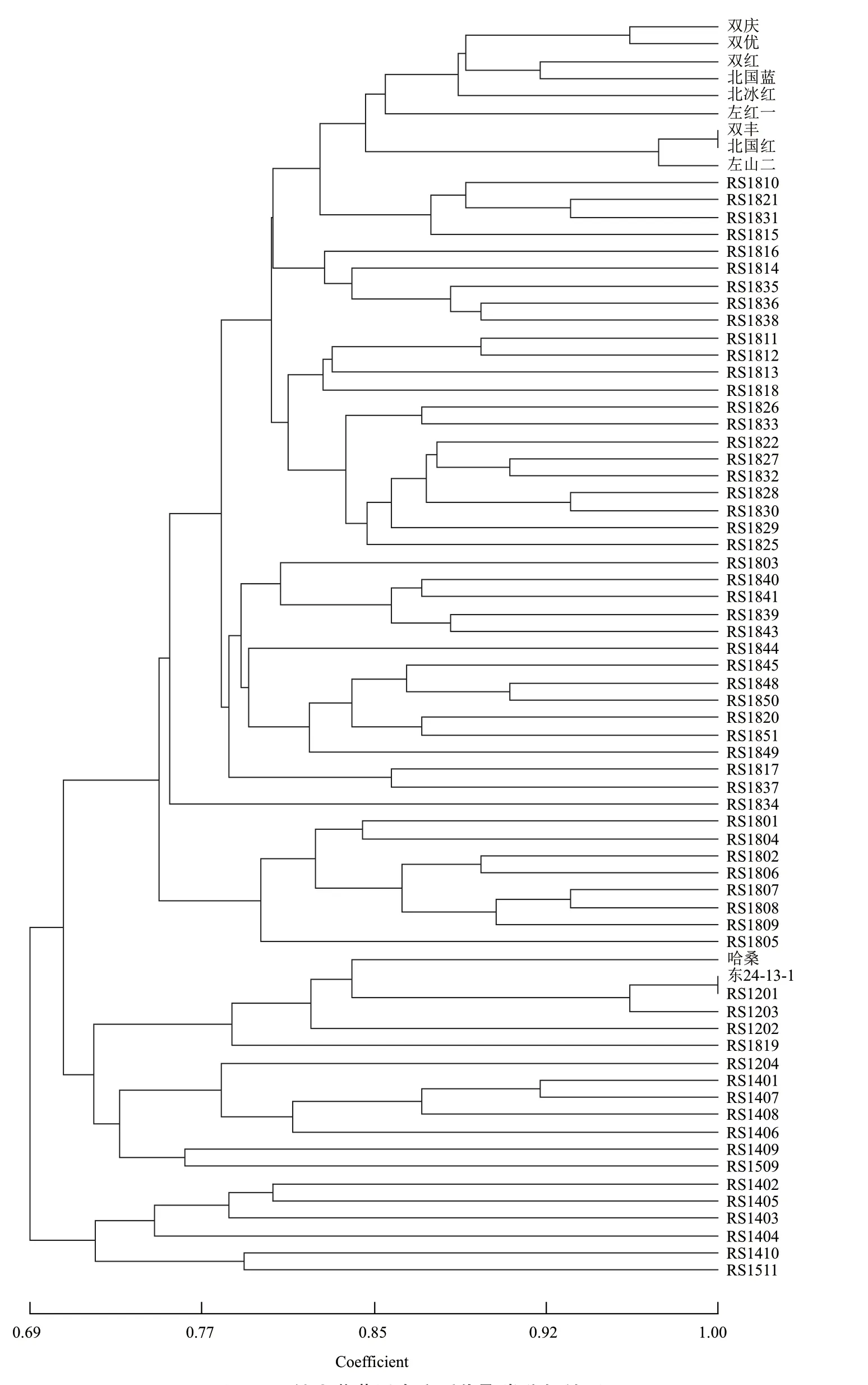
图2 73份山葡萄及杂交后代聚类分析结果
遗传距离和遗传一致性反映群体亲缘关系,亲缘关系越近,遗传距离越小,遗传一致性越大[13-14],本研究中东北山葡萄与俄罗斯野生葡萄资源的遗传距离为0.2146,小于东北山葡萄选育品种与俄罗斯山葡萄选育品种之间的遗传距离0.5422,也小于俄罗斯选育品种与俄罗斯野生资源间的遗传距离0.3716。这说明俄罗斯野生葡萄资源和东北山葡萄的遗传差异较小,亲缘关系较近,应该是由于俄罗斯海参崴地区与中国东北地区地理位置较近,气候环境比较相似。本研究分析不同居群间的遗传多样性发现东北选育山葡萄资源的等位基因数在2-5个,低于俄罗斯选育葡萄品种(3-7个)和俄罗斯野生葡萄资源(2-8个),这证实了吴子龙等[22-23]的研究结果:东北山葡萄中的等位基因数目一般在2-4个。3个群体的俄罗斯选育葡萄品种的平均期望杂合度0.6887和Nei’s遗传多样性指数最高,表明这一群体的遗传多样性更加丰富,而东北山葡萄选育品种的各项指标都最低,这应该是由于东北山葡萄分布区域较小,群体数少,群体内基因交流缺乏的原因。2007年,吴子龙[7]对黑龙江、吉林、辽宁地区的野生葡萄资源做过遗传多样性分析,结果发现黑龙江野生葡萄资源的平均有效等位基因2.4499个,期望杂合度0.5585,吉林野生葡萄资源的平均有效等位基因2.4452个,期望杂合度0.5475,辽宁野生葡萄资源的平均有效等位基因2.3632个,期望杂合度0.53873,而本研究中的俄罗斯野生葡萄资源的有效等位基因2.9847,期望杂合度0.5850,说明俄罗斯野生葡萄资源的遗传多样性要高于东北地区的野生葡萄资源。下一步应结合不同葡萄品种的农艺性状对俄罗斯选育葡萄资源的遗传背景做进一步分析,为山葡萄种质利用与创新提供依据。
4 结论
本研究所用11对SSR引物具有丰富的多态信息。73份山葡萄及杂交后代聚为3类。3个群体的群体内纯合体过量,杂合体缺失,群体间存在中度遗传分化,基因交流较丰富。东北山葡萄选育品种与俄罗斯野生葡萄资源的遗传距离最近,亲缘关系较近,与俄罗斯选育葡萄品种的亲缘关系较远,俄罗斯选育葡萄品种的遗传多样性丰富。
