单细胞转录组测序技术在心脏发育、疾病以及医学中的应用
2021-01-22朱庆元李天晴
朱庆元 李天晴
(昆明理工大学生命科学与技术学院,昆明 650093)
相对于Bulk RNA-seq测量的是测序组织所有细胞同一基因混在一起平均化后的表达水平,scRNAseq技术以其高分辨率和测序深度对每个细胞的转录组进行测序,对心脏研究领域产生了深远影响。在胚胎发育过程中,心脏迅速地完成了高度精细复杂的心脏发生过程[1-2],在妊娠大约21 d就开始跳动,是第1个发挥生理功能的实质脏器[3]。目前通过单细胞测序,在小鼠模型上,已经对心脏发生在时空层面已经有了更好的理解[4],同时人鼠心脏发育具有巨大物种差异,对人类胎心的单细胞测序也在心脏发育的时间层面上以及细胞类型之间发现了人鼠特异基因的表达[5],这些对体外心肌分化研究也有非常重要的意义[6]。本文概述了scRNA-seq技术在心脏发育、疾病以及医学中的应用及作出相应展望。
1 scRNA-seq测序技术的进展
2009年,Tang等[7]首次报道了3'偏倚的全长单细胞转录组测序方法。2011年,Islam等[8]建立了STRT-seq(Single-cell tagged reverse transcription sequencing),能够在逆转录过程中给每个细胞加上条形码,从而能够同时对更多量的各种混合细胞样本 测 序。2012年,Smart-seq(Switching mechanism at 5'end of the RNA transcript)出现,不仅能够检测mRNA的全长,而且有更高的转录本序列覆盖度[9]。同 年,Hashimshony等[10]开 发 出CEL-seq(Cell expression by linear amplification and sequencing),进行双端深度测序能够准确检测两条链的序列,并且给每个细胞加上条形码,实现了混样单细胞的多重分析和研究。2013年,Picelli等[11]开发出 Smartseq2技术,相比Smart-seq技术,产物无需纯化,产量提升。
同年,第一台商业化单细胞转录组制备系统Fluidigm C1面世,能够自动捕获单个细胞并完成Smart-seq操作。2014年,Jaitin等[12]建立了MARSseq(Massively parallel single cell RNA-seq)技术,可分析上千个单细胞在体转录状态。2015年,单细胞转录组测序技术中引入微流控技术,利用微流体装置将带有条形码的微珠和细胞一起包裹进油滴,随后条形码连接到反转录后的cDNA上进行标记。其中Marc领导开发的inDrop只有约15万个条形码,处理的细胞数少,但捕获效率高,适用于细胞数量少珍贵的样本[13]。而Steven等开发的Drop-seq有1600万个条形码,可以处理大量细胞[14]。2017年,商业化的10×Genomics技术出现,其在微流控技术基础上引入16个碱基总计400万个细胞身份条形码,进一步降低了技术门槛,使得更多实验室可以进行大规模单细胞测序的研究[15]。
在技术实现高通量后,针对scRNA-seq成本高昂的问题,降低测序成本的相关技术得到发展。2017年,Gierahn等[16]开发Seq-Well技术,利用每个纳米孔中捕获1个细胞和1个带条形码微珠,使每个细胞的成本低于1美元。随后2018年,Han等[17]的Microwell-seq测序平台利用琼脂糖材料,使得单细胞建库测序的成本进一步降低。同年,使用SPLit-seq技术可以无需对单个细胞进行分离,而是形成单独的RNA“隔离室”,为每个细胞的RNA引入一个独特的组合条码,可以特异性地标记百万数量级的细胞[18]。
此外,空间转录组迅速发展,目前Slide-Seq技术可以将RNA从组织样本转移到覆盖有已知位置的DNA条形码珠子的表面,从而允许通过测序确定RNA的空间位置[19]。这种方法将转录组映射的空间分辨率提高到10 μm,以接近单细胞的分辨率为scRNA-seq技术提供了空间维度。随着scRNAseq技术门槛及测序成本降低(表1),小鼠和人的心脏单细胞测序陆续地发表出来,让更多实验室可从心脏单细胞水平研究心脏发育、疾病以及医学中的应用。
2 scRNA-seq测序技术探究胚胎心脏发育
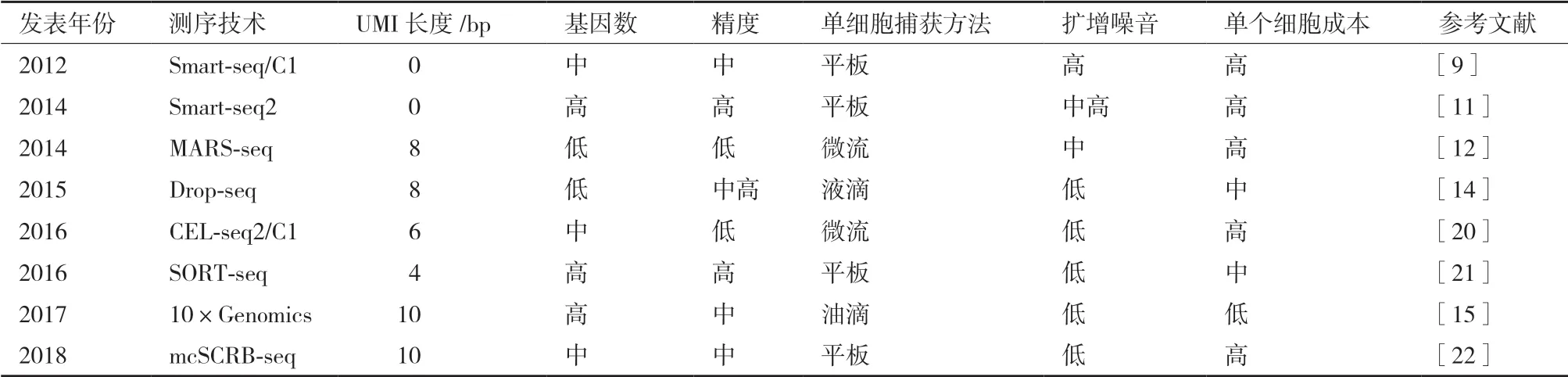
表1 主要scRNA-seq测序技术
目前运用到心脏研究中的主流的scRNA- seq技术 有Smart-seq2、10×Genomics和Smart-seq/C1等(图1)。2016年,Li和DeLaughter等分别独立采用Smart-seq/C1技术发表了世界上前两篇小鼠心脏单细胞测序文章,通过对不同发育阶段的胚胎心脏的特定几个解剖区域进行单细胞测序,第一次得到了主要心脏细胞类型的单细胞图谱[23-24]。Li等[23]使用随机森林算法分析了胚胎第8.5-10.5天的小鼠心脏的转录图谱,并以超过91%的准确率成功预测心肌单细胞在发育过程中的解剖位置,并以谱系示踪技术证实了Isl1标记的细胞主要分布在流出道和右心室处。DeLaughter等[24]则进行了胚胎第9.5天到出生后第21天的心脏细胞的测序,阐释了胎心成熟过程中心肌细胞转录谱的变化。此外这两项研究都阐释了胚胎发育过程中心肌细胞类型的异质性并发现Nkx2.5的缺陷会导致心肌细胞成熟障碍。
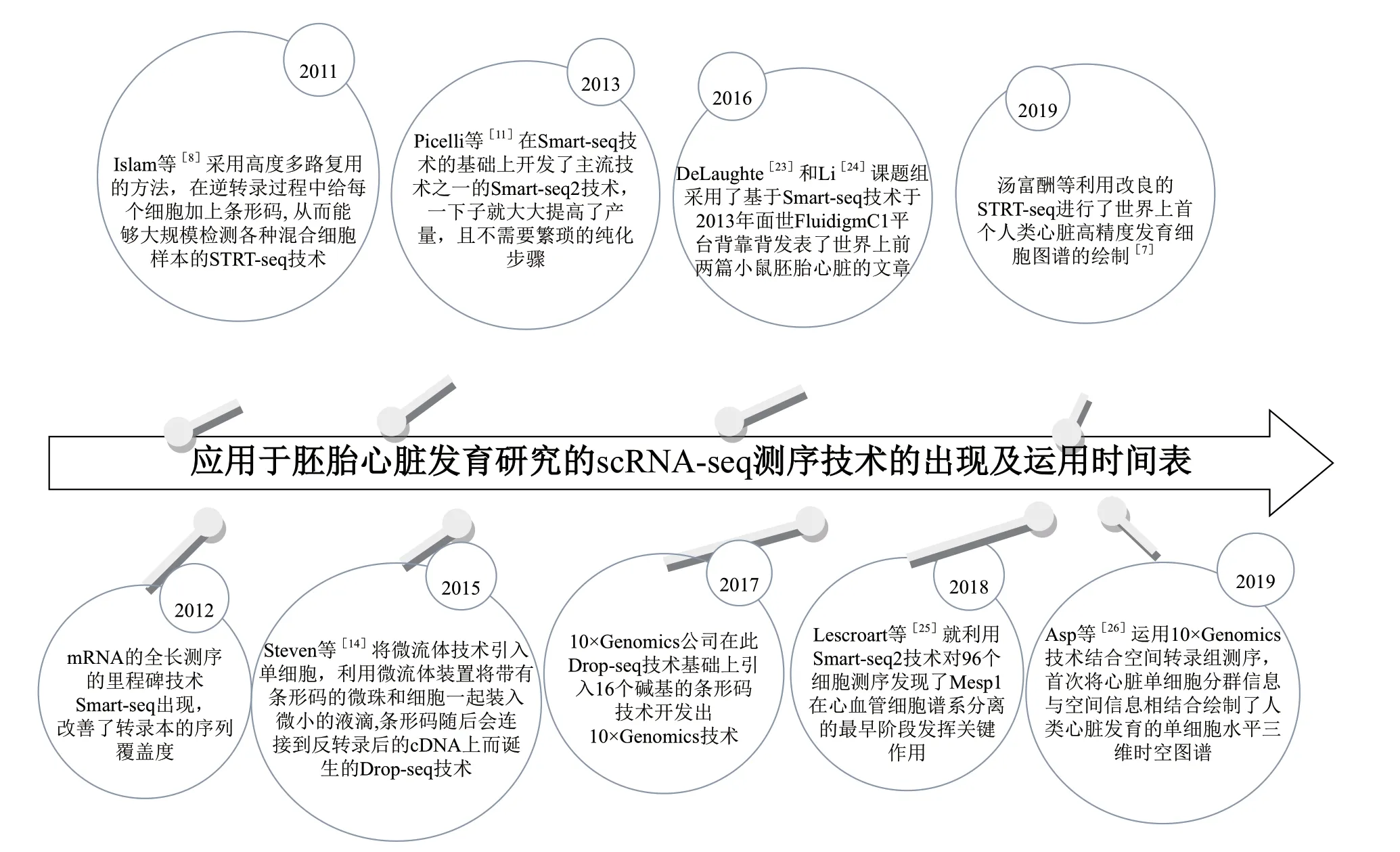
图1 胚胎心脏研究中用到的scRNA-seq技术的开发和运用时间表
2018年,Lescroart 等[25]利用Smart-seq2技术对96个细胞测序发现了Mesp1在心血管细胞谱系分离的最早阶段发挥关键作用,通过对比小鼠野生型的和Mesp1阴性的心血管祖细胞的单细胞转录谱,发现Mesp1是祖细胞退出多能性和在早期原肠形成过程中诱导心脏基因表达所必需的,并且不同的Mesp1前体细胞群对应于不同的细胞谱系和不同解剖区域的心脏祖细胞。
2019年,Cui等[5]利用改良的STRT-seq进行了首个人类心脏高精度发育细胞图谱的绘制。该研究通过对来自18个人类胚胎(孕期从5周到25周)的大约4000个解剖学定义的心脏细胞单细胞测序,鉴定出心肌细胞、内皮细胞、成纤维细胞和瓣膜间质细胞4种主要的心脏细胞类型,并且发现心肌细胞和成纤维细胞在发育过程中经历了基因表达的逐步变化。通过人和小鼠心脏单细胞数据的比较分析,发现了人类心脏发育的几个独特特征,这些差异在整体组织转录组测序中不明显,但在单细胞转录组水平上十分明显。4种细胞类型中,人和小鼠的心肌细胞在转录组上最相似。而在发育阶段上,小鼠胚胎10.5 d的心肌和第7周的人的心肌发育最好的同步,而小鼠胚胎10.5 d的心脏内皮和人第6周的心脏内皮发育最同步,小鼠胚胎9.5 d的成纤维细胞和人第5周的最同步,表明小鼠和人在发育过程中心脏细胞类型的分化和成熟具有各自的同步时间线。此外,RNASE1在人内皮细胞中特异表达,THY1在人成纤维细胞中特异表达,CFB和ITLN1在人心外膜细胞中特异表达,并且人的心肌更多地表达细胞外基质基因COL1A1、COL6A3、DCN和LUM,而这些基因很少或不在在小鼠对应细胞类型上表达,相比之下,Icam2在小鼠内皮细胞中特异表达,Rnf213在小鼠心外膜细胞中特异表达。这些突显了心脏不同细胞类型的转录组在物种间的相似性和差异性,便于研究者在了解人鼠不同细胞类型基因表达差异的基础上,选择细胞类型相近的,可以直接用小鼠研究,相差较远的要注意小鼠模型得出结论的可靠性。另外在发育阶段上,要根据研究重点选择人鼠细胞类型发育阶段匹配的时期研究。
2019年12 月Asp等[26]运 用10×Genomics技术结合空间转录组测序,首次将心脏单细胞分群信息与空间信息相结合绘制了怀孕前3个月发育中的人类心脏发育的单细胞水平三维时空图谱。10×Genomics技术测得的单细胞转录组对应空间转录组技术,对整个心肌切片测序,恢复了单细胞测序完全丢失的空间信息,高精度和高准确度绘制了心脏细胞转录谱总体相似属于同一细胞类型但空间分布不同的图谱,发现神经嵴细胞和施旺前体细胞都定位在纵隔间质和流出道,并且施旺前体细胞还发现于房室外膜下间质,神经嵴细胞只在早期阶段出现,施旺细胞在晚期出现,证实了神经嵴细胞对流出道分隔成主动脉和肺动脉是必须的。
3 scRNA-seq测序技术探究人心脏细胞的异质性
由scRNA-seq产生的细胞图谱表明,心脏及其周围血管系统由多种细胞类型组成,包括心肌细胞、成纤维细胞、内皮细胞、血管平滑肌细胞、瓣膜间质细胞和常驻免疫细胞,每种细胞类型都可以进一步划分为亚型(表2)。
心肌目前可以分为5种亚型,其中新发现了特异表达MYOZ2和FABP3的myoz2心肌[5,26]。心房肌 高 表 达NR2F1、FOS、HEY1、EGR2、CREB3L2和HAND2;而HAND1、HEY2、IRX3和NFIA则特异性表达在心室肌,此外跟心房肌相比,心室肌更高的表达细胞外基质基因DCN和FBN2。从转录因子来看,转录因子IRX3和HAND1在左心室高表达对左心室发育至关重要,房性心律失常相关基因PITX2则在左心房高表达。此外心肌又可以分为致密化心肌和小梁肌,其中小梁肌表达NPPA和GJA5等标志基因[23]。致密化心肌和小梁肌又都可以进一步通过标志基因区分是位于心房还是心室。致密化心室肌特异表达MYH7,S100A4和LBH,而致密化心房肌则特异表达MYH6,MYL7和ULK4;ITGA6和RELN特异富集在心房的小梁肌,CRABP2和SLIT2则特异富集在心室的小梁肌。通过单细胞测序获得各种心肌细胞亚型的标记基因,在此基础上对特定细胞亚型做进一步研究。
内皮细胞可以分为4种亚型,其中对于心内膜细胞,Cui等[5]和Asp等[26]可能因为缺乏相关心脏方面的背景知识,把它当成了毛细血管内皮。心内膜细胞是一种内皮细胞,表达CDH5、PECAM1等内皮标记的同时,特异表达NPR3,可以作为心内膜区别冠状动脉内皮等其他内皮的特异标记基因。瓣膜内皮则更高的表达NTRK2和NFATC1。冠状动脉内皮特异表达FABP4和CD36,与血管发育和促进心肌脂肪酸的使用相关,且它们对脂质的作用与成体后发生冠状动脉粥样硬化有很大关系。
单细胞测序数据结合空间转录组显示[5,26],胚胎第5周心外膜还未出现时,心外膜前体细胞既表达UPK3B、ALDH1A2、WT1和TBX18等心外膜标记,但其基因表达模式又和心外膜不同,其增殖细胞率是非免疫细胞中最高的,特异表达NOTCH信号通路的两个靶基因HEY1和HEY2,可能其命运被NOTCH信号通路所控制。而心外膜细胞更加成熟,表达补体成分基因CFB、C3、C1R和C1S以及细胞外基质基因ELN和DPT。空间转录组显示,心外膜前体细胞表达TCF21主要位于房室心外膜下间质。
结合空间转录组区分位置,单细胞转录组提示亚型功能,心脏中分出5种成纤维细胞[26]。第1种成纤维样细胞主要集中在流出道根部和瓣膜,第2种成纤维样细胞主要在流出道和形态发生相关,第3种成纤维样细胞和心外膜前体细胞一样都定位在房室心外膜下间充质,可能和冠脉形成有关。心外膜下第4种成纤维样细胞和结缔组织发育以及血管发生有关。第5种成纤维样细胞定位更朝向流出道,与动脉和主动脉形态发生相关,调节内皮细胞增殖。
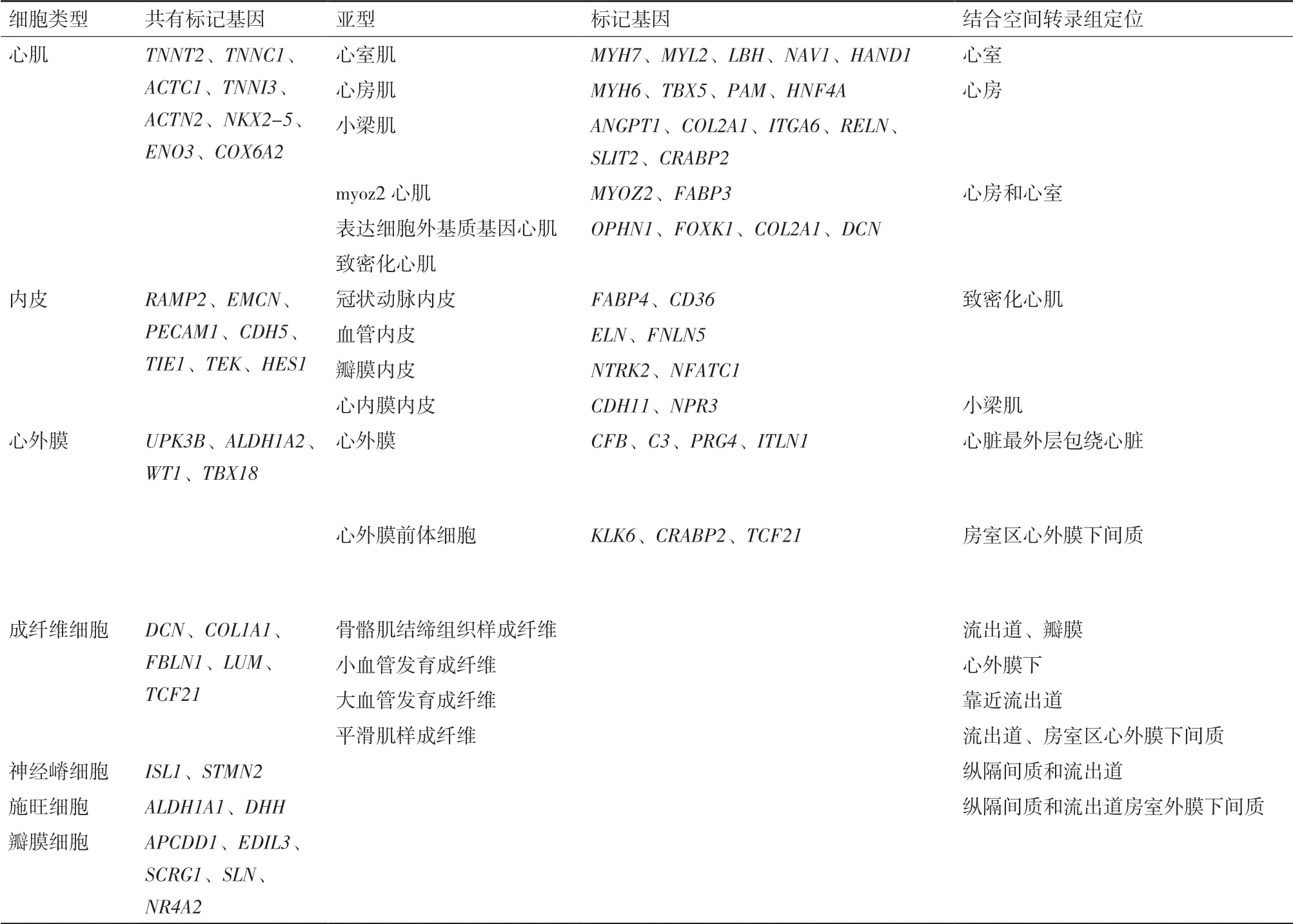
表2 心脏细胞主要类型及其基因表达特点和空间定位
4 scRNA-seq测序技术在心脏健康大动脉和动脉粥样硬化动脉方面的研究
将scRNA-seq与谱系示踪转基因小鼠相结合,揭示了冠状动脉是由发育过程中静脉内皮细胞转变的特定动脉内皮前体细胞群所分化而来[27]。这类单细胞群的转录谱由静脉表型逐渐转变为动脉表型,其中静脉的特异性转录因子Couptf2为这种命运转换的核心转录因子,为进一步研究静脉衍生动脉的机制奠定了分子基础。人的单细胞转录组显示人的冠状动脉内皮特异表达FABP4和CD36,与血管发育和促进心肌脂肪酸的使用相关,且它们对脂质的作用与成体后发生冠状动脉粥样硬化有很大关系[26],对冠状动脉这两个特异基因的研究有可能找到预测发生冠状动脉粥样硬化的风险指标,以及研发药物预防冠状动脉粥样硬化及继发的心肌梗塞。通过健康成年小鼠的主动脉单细胞图谱确定了主动脉的所有细胞类型[28],进一步比较了8周和18个月小鼠的主动脉,发现年轻和老年小鼠主动脉内皮细胞种群在转录水平上存在显著差异[29]。
scRNA-seq还被用来研究主要血管疾病的细胞状态和命运决定。动脉粥样硬化后由多种细胞类型组成,包括内皮细胞、血管平滑肌细胞和免疫细胞,其中血管平滑肌细胞是具有高度可塑性的终末分化的细胞类型,单细胞分析的将其定义为一群特异的成纤维细胞样细胞,并进一步鉴定出引导血管平滑肌细胞的分化状态的特定的组蛋白变体[30-31]。动脉粥样硬化的典型特征还包括大量的免疫细胞,但由于细胞标记物的缺乏,巨噬细胞亚群的功能和表型都没有很好的定义,为此,将健康和动脉粥样硬化主动脉中巨噬细胞的scRNA-seq数据进行对比,鉴定出病变主动脉中富集的髓系亚群[32]。这些亚群包括单核细胞、单核细胞来源的树突状细胞和两个巨噬细胞亚群。这些巨噬细胞群仅见于动脉粥样硬化后的主动脉,Trem2和Il1β等炎症分子高表达。类似地,将单细胞测序与质谱分析相结合,在小鼠主动脉粥样硬化斑块中鉴定出11种不同的白细胞类型,这些主动脉白细胞的组成可以用来预测动脉粥样硬化患者的临床事件,体现出单细胞测序临床转换潜力[33]。
5 scRNA-seq测序技术与多能干细胞分化心血管的研究
人多能干细胞诱导分化的细胞模型已经被证明在特定患者的疾病建模和再生治疗中是有用的,但多能干细胞来源的心血管细胞还是存在成熟度不够和异质性较大的问题。因此,许多研究已经使用scRNA-seq来确定参与分化转录调控的信号通路,识别由分化引起的所有细胞类型,并优化和修改方案以产生成熟和均质性较高的心脏血管细胞亚型。Friedman等[34]在诱导多能干细胞干细胞分化心肌(Induced pluripotent stem cells derived cardiomyocytes,iPSC-CMs)分化的不同阶段对超过40000个细胞进行了scRNA-seq测序,发现HOPX的调节失调导致了iPSC-CMs持续的未成熟状态。在另一项单独的研究中,取了iPSC-CMs分化过程中大约10000个细胞鉴定心脏转录因子发现表达NR2F2和TBX5的iPSC-CMs具有更不成熟和心房样的特征,而HEY2、IRX4和MYL2富集表达在更成熟的心室肌。通过基因编辑NR2F2和HEY2,证实了这两个转录因子分别产生心房样和心室样iPSC-CMS的调控作用[35]。总之,这些研究结果突出了iPSC-CMS的异质性,并揭示了控制细胞成熟和腔室特化的特定心脏转录因子。人诱导多能干细胞分化来源的内皮细 胞(iPSC-derived endothelial cells,iPSC-ECs)与iPSC-CMS一样受到细胞不成熟和异质性的限制。在iPSC-ECs的分化过程中鉴定出4个主要的iPSC-ECs亚群,CLDN5+簇代表代谢活性的iPSC-ECs,GJA5+簇代表动脉样的iPSC-ECs,APLNR+簇代表炎症反应性iPSC-ECs,ESM1+亚群代表活化的细胞[36]。McCracken等[37]对两个分化方案来源的人胚胎干细胞的内皮细胞(esc-ec)进行了scRNA-seq分析。拟时间分析显示分化第6天开始分化为内皮细胞和间充质细胞类型,这两种细胞类型在分化第8天开始成熟,以间充质细胞群中SNAI2表达减少,内皮细胞中ANGPT2、ESM1和GNG11表达增加为显著特征。尽管ESC-ECs在最初的内皮命运决定后进一步成熟,但没有观察到器官特异性内皮标记基因表达。未来的研究应该集中在进一步优化分化方案以产生组织特异的成熟ECs。
6 scRNA-seq测序技术与心肌梗死与再生
Gladka等[38]对小鼠心梗缺血-再灌注模型进行心脏单细胞测序,发现在各种细胞类型中出现了以前未知的细胞亚群,尤其是鉴定出一群Ckap4表达增加的成纤维细胞群。冷冻损伤斑马鱼心脏交界区心肌细胞的scRNA-seq显示,损伤后交界区心肌细胞的单细胞转录组与胚胎心肌细胞相似,这解释了在斑马鱼心脏再生过程中观察到的小梁心肌细胞向皮质心肌细胞的转换,从而产生了小梁细胞和皮质细胞[39]。为了研究心肌梗死后新生血管内皮细胞的异质性,从内皮特异性谱系追踪的梗死7 d后小鼠心脏中分离的内皮细胞进行scRNA-seq,鉴定出的10个内皮细胞簇中,其中有5个簇在心肌梗死后组显著富集,这些簇中与心脏重塑、内皮细胞-细胞外基质相互作用、增殖和细胞周期调节相关的基因表达上调。其中Plvap在心肌梗死小鼠模型和人类心脏模型的这5个簇中的3个中高表达,且仅局限于梗死边缘区的内皮细胞[39],与梗死后促进内源性心脏组织修复的生长因子的定位相同[40]。类似的,心肌梗死后7 d的每个非心肌细胞群体都有自己的中间过渡状态和独特的转录信号,越来越多的研究已经使用scRNA-seq来阐明心肌梗死后各种非心肌细胞群体的作用,促进了人们对缺血组织重建过程中微环境变化的理解。未来的研究将受益于对这些细胞类型和过渡状态的特定功能的更深入的机制研究,特别是在损伤后的不同阶段,如早期急性炎症(梗死后1 d)和晚期重塑(梗死后30 d)。这样的研究将允许更好地描述病理性心脏纤维化期间内皮细胞到间充质细胞转变或间质细胞到内皮细胞转变过程中的动力学特征。目前,非心肌细胞和心肌细胞之间在组织修复和重塑过程中的细胞间通讯的转录研究和随后的验证还没有得到充分的研究,填补这些知识的空白对于提高人们对心脏损伤和修复不同阶段所涉及的细胞反应的理解至关重要。
7 scRNA-seq测序技术与先天性心脏畸形以及心衰
Nkx2.5是心脏早期发生重要的转录因子[41],其显性突变会导致房间隔缺损[42],DeLaughter等[24]利用Nkx2.5+/-单倍型不足的小鼠心肌单细胞测序发现心肌和内皮的成熟都推迟了,推测心肌对心内膜的分化至关重要。而Li等[23]发现Nkx2.5-/-胚鼠心肌直接丢失了心室的转录谱,转录异常,没有心室的表型,只能表现出左房心肌的表型。致密化心室肌特异表达MYH7,而MYH7突变在心肌致密化不全中最常见[43],可能为心肌致密化不全好发于左心室游离壁提供了一定的解释[5]。此外,发现人第7周的心内膜高表达配体NRG1,他们的受体ERBB2和ERBB4高表达在小梁肌,但很少有细胞表达BMP10,暗示这一时期心内膜通过NOTCH信号通路调节心肌致密化主要是是通过ERBBs信号来促进分化,而不是通过BMP10诱导的增殖[44],这与先前从小鼠研究中发现基因Bmp10的突变与胚胎发生过程中心肌致密化不全的发展密不可分提出了不同见解[45],当然这也不排除是物种间的差异。GATA6突变导致永存动脉干、法洛四联症等动脉畸形[46-47],而GATA6调控晚期心肌发育[5],这之间也尚待研究。此外房性心律失常相关基因PITX2则在左心房高表达[5],是否暗示房性心律失常异位起搏点多发生左心房,还需进一步研究。有研究报道MYH6是病窦综合征[48]的易感基因,而MYH6在致密化心房肌中特异表达,研究致密化心房肌对临近的窦房结的信号通路可能是找出其中原因的一个方向。Gollob等[49]发现GJA5是房颤的重要致病基因,而GJA5特异表达在小梁肌。此外,细胞外基质重构异常与心衰相关,目前单细胞测序发现细胞外基质不仅主要来源成纤维细胞,心肌和其他类型心脏细胞也会分泌细胞外基质,且心肌随着细胞外基质基因表达增加而不断成熟,对细胞外基质的研究可能是阐明心衰相关疾病机制的一个方向。Nomura等[50]在单细胞水平鉴定出肥厚型心肌病心肌特异转录谱。其中值得注意的是,基于拟时分析,在DNA氧化损伤积累后,P53依赖的Mef2Nrf2信号轴在促进肥厚心肌细胞致病基因激活方面发挥了关键作用,这些发现进一步被来自心力衰竭患者的心肌细胞scRNAseq获得的数据所证实[50]。
8 结语与展望
本文概述了scRNA-seq技术在胚胎心脏发育、心脏细胞的异质性以及在心血管方面、多能干细胞分化心血管和心脏疾病方面的进展。
在胚胎心脏细胞的异质性方面,至今也还没有分出淋巴内皮和起搏整个心脏的窦房结细胞群。在中枢神经系统有报道说淋巴内皮具有引导血管内皮再生功能,这对心梗之后心脏再生血管重建可能也有重要的意义[51]。而分化出人的窦房结起搏细胞代替心脏起搏器有很大的临床转化价值,但窦房结区域小,缺乏明确形态标记,异质性高,有大比例的心房细胞和非起搏细胞,从而需要设计出更巧妙的实验捕获到足量纯化的窦房结细胞进行单细胞测序。
在心脏再生方面,人类成体心肌再生能力有限,而在心肌有再生能力的动物模型上,梗死区强烈的炎症反应是原位的单细胞测序到的免疫细胞[5],还是通过淋巴管,血管趋化而来还需进一步研究。此后心肌细胞增殖显著上升,成纤维细胞参与了心肌梗死后的纤维疤痕过程[52],可以借助scRNA-seq技术鉴别哪种亚型的成纤维细胞参与了这一过程。此外,前期研究认为TBX18阳性的心外膜可以作为心脏前体细胞产生心肌细胞[53],单细胞测序结果也显示其作为心脏前体细胞有心脏发育的潜能[5,26]。目前,成体干细胞,诱导多能干细胞,细胞重编程,心脏组织工程[54]等心肌再生的方法都已经在实验中,但仍没有突破性成果,希望单细胞测序分析进一步了解心肌再生机制,找到最适于再生的心肌细胞亚型及其核心转录因子,分化或者原位将成纤维细胞重编程成成熟有功能的心肌细胞。
除了心脏再生,先天性心脏病也亟待单细胞测序进一步研究,如已知神经嵴细胞与很多先天性心脏病相关,需要进一步通过Smart-seq2等scRNA-seq技术进一步测序研究。此外,还可以对先天性心脏病流产胎儿心脏组织单细胞测序,然后与现有正常流产胎儿数据作比较,发现可能致病机制。
最后考虑到不同患者在心血管疾病药物治疗反应上的显著差异,通过普通转录组也只能发现iPSCCMs对常见心血管药物转录组谱整体上存在人际差异,却无法鉴别出靶细胞群之间药物敏感性差异。在治疗前基于scRNA-seq技术得到的细胞异质性的评估,可以为医生确定最有效的、个性化的治疗方案提供依据。
