畜禽微生物耐药组研究进展
2021-01-22马涛陆唯李松励樊霞
马涛 陆唯 李松励 樊霞
(1. 中国农业科学院饲料研究所 农业农村部饲料生物技术重点实验室,北京 100081;2. 中国农业科学院北京畜牧兽医研究所,北京100193;3. 中国农业科学院农业质量标准与检测技术研究所 国家饲料质量监督检验中心,北京 100081)
虽然抗生素自问世以来已经挽救了数百万人的生命,但伴随产生的抗生素耐药性也对全球公众健康造成了巨大威胁。如果不加以改善,预计到2050年,每年因抗生素耐药性导致死亡的人数将从70万上升至1000万[1]。抗生素耐药性问题产生的主要原因并非仅仅在于人类自身不合理地使用抗生素,还在于绝大部分(73%)抗生素用于给人类提供肉奶蛋等食品的养殖动物[2]。事实上,自20世纪50年代起,抗生素就应用于畜禽生产,起到了提高饲料转化效率、促进生长或治疗疾病/降低疾病发生率的作用[3]。尤其是2000年以来,非洲、亚洲和南美等中低收入国家的肉类产量分别增长了68%、64%和40%[2],这很大程度上得益于集约化生产体系全球化的扩展和普及,而抗生素的使用对于维持动物健康和提高生产力起到了至关重要的作用[4]。全球用于鸡、猪和牛的抗生素总使用量将从2010年的约6.3×103t万吨增加到2030年的约10.5×103t吨,增幅高达67%[5]。越来越多的证据证明抗生素在畜禽生产上的大量使用与人类抗生素耐药性问题的加重存在紧密联系[6-8],这是因为畜禽消化道或畜产品(如牛奶)微生物携带的抗生素耐药基因(Antibiotic resistance gene,ARG)可以转移到人类消化道微生物中[9]。基于此,2017年世界卫生组织呼吁其成员国减少兽用抗菌药物的使用[10-11]。我国已经禁止在日粮中添加任何促生长的抗生素,然而动物疫病发生时还需要使用抗生素治疗。因此,抗生素耐药性是21世纪全球面临的最紧迫的挑战之一,对现代医学和食品安全构成威胁。
为了降低畜禽生产环节ARG向人类的传播,首先需要明确畜禽消化道或产品微生物携带哪些ARG。传统上通过分离含有潜在ARG的细菌并提取其DNA,再通过PCR或者比较全基因组测序的方法明确该细菌含有哪些ARG[12]。但该方法的局限性在于仅能研究单一的、可体外培养的细菌。近年来,基于高通量测序技术来分析ARG的研究越来越受到青睐,因为该方法与传统技术相比扩大了ARG的监测范围[13-14]。例如,使用宏基因组学来确定某个环境微生物群落全部抗生素耐药性基因—耐药组(Resistome)[15-16]组成和相对丰度的方法已广泛应用于人类肠道[17-18]、水源[19-21]、土壤[22-23]等微生物群落的研究中,畜禽消化道微生物耐药组研究也开始受到关注。本文首先介绍了微生物耐药组的研究方法,随后对近年来畜禽消化道和乳中微生物耐药组及其影响因素研究进展进行了总结和归纳,最后提出了未来研究方向,包括研究方法的标准化、耐药组基因表达的研究等,旨在为控制畜禽养殖过程中ARG向人类的传播提供思路。
1 微生物耐药组的研究方法
1.1 基于序列的研究方法
该方法是利用生物信息学分析工具,将宏基因组或宏转录组测定的细菌基因组或转录组序列与ARG数据库进行比对来实现。具体而言,首先向分析工具提供测定的DNA或RNA序列,分析工具随后使用不同的搜索算法与ARG参考数据库进行比对,最终确定该序列是否存在已知的ARG(图1)。上述流程可利用商业公司提供的专有平台来实现,或者从github及bitbucket等开源平台上下载工具来完成分析。生物信息学分析工具虽然多种多样,但按照接受输入数据类型的不同,主要分为可分析组装后序列和可分析原始序列两大类[24]。需要指出的是,不论何种分析工具都不能对输入序列数据质量进行控制,因此需要首先对原始序列或组装后序列进行质量控制,再进行耐药组分析。
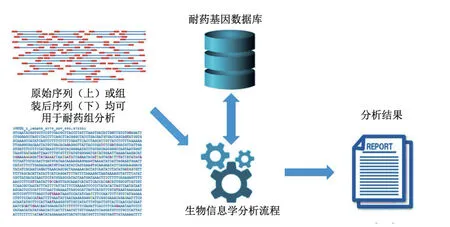
图1 基于宏基因组测序的微生物耐药组分析流程[25]
基于原始序列和基于组装后序列的分析工具各有优缺点:使用可分析组装后的序列的工具时,组装软件的差异可能会影响结果的可比性[26-27],这时由于序列组装后,将输入数据与ARG参考数据库进行比较的最常见方法依赖于BLAST和隐马尔可夫模型搜索[28]。基于BLAST的工具可以根据基因长度和相似性百分比的默认设置给出不同的输出结果,如果设置太低或太高,都会对特异性产生负面影响。此外,基于组装的方法对于计算机配置要求很高。尽管有这些缺点,但是基于组装的方法可以分析ARG的遗传背景[25]。另一方面,使用可分析原始序列的工具时,其将序列数据与ARG数据库进行比对的方式较多,包括Bowtie2、BWA和KMA等[24]。该类分析工具的缺点是其比对时间相对于使用可分析组装后序列的工具较长,但其优点在于能够检测出由于组装不完整可能会被忽略掉的耐药基因[24]。
除分析方法外,耐药组预测准确性还取决于耐药基因参考数据库的完整性。耐药基因参考数据库可细分为专门用于检测特定类别的耐药基因(例如ARGO参考数据库用于检测耐β-内酰胺(beta-lactam)和万古霉素(vancomycin)基因[29]),和用于检测出DNA/氨基酸序列中理论上可能存在的耐药基因(如ARDB[30]、ResFinder[31]、CARD[32]数据库)。除了上述侧重点不同,不同耐药基因参考数据库还具有其他重要特征。首先,耐药基因参考数据库中收录条目的标准不同:如CARD中的条目必须已在科学文献中发表[32],而在ResFinder对条目是否发布无严格的要求[31]。其次,条目的类型在参考数据库之间也不同,大多数参考数据库包括全部耐药基因,只有少数参考数据库也包括了染色体突变的耐药基因(如MUBII-TB-DB[33]和PointFinder[34])。最后,耐药基因参考数据库在条目格式(fasta或json等)、下载权限,以及定期维护频率方面也有所不同[25]。因此在选择最佳的耐药基因数据库时需要对这些区别特征有充分的了解。
1.2 基于功能宏基因组学的研究方法
功能宏基因组学是一种多步骤的研究手段,其利用编码混合微生物群落的分离DNA的表达文库来转化相关的宿主微生物。随后可以从广泛的目标表型中选择对应的转化克隆,如酶促、脂解或水解活性[35]。利用功能宏基因组学方法,结合分子生物学技术,筛选并构建抗生素耐药基因库,最后再利用生物信息学分析,确定新型的ARG[36-37]。应用功能宏基因组学的微生物耐药组研究流程如图2所示。
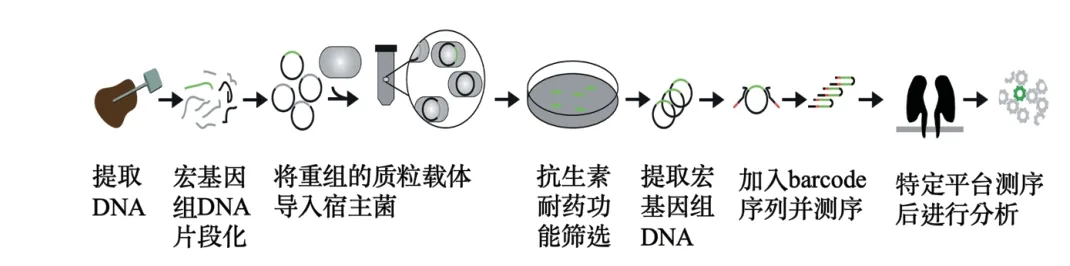
图2 基于功能宏基因组学的微生物耐药组分析流程[36]
宏基因组文库构建的第一步是DNA提取,需要尽力保证完全提取样品中的总DNA。此外,还需要得到足够的片段以获取表达所需的完整的目的基因或基因簇[38];随后选择适宜的载体(如质粒)和宿主菌(如大肠肝菌),利用提取的DNA构建宏基因组文库,根据所用载体的不同,需要将DNA片段化,以确保载体连接和转化效率,然后通过化学转化法或电转化法将重组的质粒载体导入宿主菌,实现宏基因组文库的构建[39]。
文库构建完成后,即可进行抗生素耐药功能筛选,由于构建宏基因组文库的宿主菌大多为革兰氏阴性大肠杆菌,因此尽可能避免革兰氏阴性菌不敏感抗生素(如糖肽类、大环内酯类、万古霉素等),通常选择在环境中检出率较高的抗生素(如四环素类、磺胺类、大环内酯类和喹诺酮类)[39]。在进行抗生素耐药性筛选时,一般使用抗生素的最小抑菌浓度,收集在此浓度下存活的宿主菌(阳性克隆),提取其DNA,通过PCR扩增并加入barcode序列[40];对DNA进行质检后,构建测序文库,用于高通量测序(如Nanopore或Pacbio等平台),最后通过生物信息学分析手段,检测所筛选的ARG,具体可通过poreFUME等集成式的分析流程分析[36],也可自行选择并组合分析软件进行分析[41]。
2 畜禽消化道微生物耐药组分析
畜禽消化道微生物及其耐药组的分析研究在近年开始受到关注[42]。畜禽消化道微生物耐药基因既可能来源自母体,也可能通过与周围环境中的耐药性微生物(主要是细菌)直接接触而获得[43]。另一方面,消化道微生物具有广泛而多样的遗传库,可促进耐药性在常驻共生菌种之间和内部的传播[44]。从目前研究报道来看,四环素(Tetracycline)耐药基因是畜禽(包括猪、鸡、反刍动物)消化道微生物普遍存在的耐药基因。
2.1 猪的消化道微生物耐药组分析
已有研究证明未接触抗生素的猪粪便中存在耐药性基因[45-46],其中最主要的是四环素耐药基因[47]。在没有使用抗生素的情况下,猪场中经常发现的四环素耐药基因包括tetO、tetW、tetM、tetX和tetQ,另外也有多个大环内酯类(Macrolide)抗性基因(ermG、ermF和ermB)[48];同样,新生仔猪在未接触抗生素的情况下粪便中也有ARG[49]。基于宏基因组测序结果,我国学者对国内4个大型猪场的猪粪耐药组进行了分析发现,四环素、氨基糖苷(Aminoglycoside)和多药(Multidrug)耐药基因占全部耐药基因相对丰度的近70%[50]。Munk等[51]对欧洲9个国家猪的粪便耐药组进行了分析,结果表明不同国家猪粪便耐药基因组成和比例相对一致,四环素耐药基因相对丰度最高,超过了60%,其次是大环内酯、β-内酰胺和氨基糖苷类等基因。此外,共发现了33个核心ARG,包括VanG、tetC、blaACI和cfxA等。最近有研究表明,四环素、β-内酰胺和多药耐药类耐药基因表达量与大肠埃希氏菌(Escherichia)和普雷沃氏菌(Prevotella)相对丰度存在正相关[52],说明这些菌可能是上述耐药基因的主要宿主,为通过调控微生物组成降低猪生产中耐药基因向环境中的传播提供了依据。
2.2 家禽的消化道微生物耐药组分析
Munk等[51]对欧洲9个国家家禽的粪便耐药组进行了分析,其中四环素、大环内酯和氨基糖苷类等基因为主,但三者相对丰度较接近,与猪粪便ARG中四环素耐药基因占绝对优势有很大的区别;此外共发现了49个核心ARG,包括strAB、sul2、blaTEM和tetA基因等。金霉素是家禽和猪生产中最常用的抗菌药物之一[53]。我国学者研究了使用金霉素对肉鸡粪便耐药组的影响,结果发现使用治疗剂量的金霉素促进了粪便四环素耐药基因tetA和tetW的丰度,并抑制了多药耐药基因mdtA、mdtC、mdtK、ompR和TolC的丰度[54]。此外,治疗剂量的金霉素导致变形菌门(Proteobacteria)相对丰度降低,主要是由于其降低了该菌门中大肠埃希菌/志贺氏菌属(Shigella)的相对丰度(从72%降至58%)。金霉素对大肠埃希菌的抑制作用是治疗剂量组中多药耐药基因减少的主要原因,因为大肠埃希菌是多药耐药基因的主要宿主[54]。
2.3 反刍动物的消化道微生物耐药组分析
作为反刍动物独有的消化器官,瘤胃微生物耐药组在近年来受到广泛关注。Auffret等[55]比较研究了不同精粗比、品种、使用抗生素对肉牛瘤胃微生物耐药组的影响,结果表明,肉牛瘤胃耐药基因以大环内酯、氯霉素(chloramphenicol)、β-内酰胺和氨基糖苷为主;品种对于瘤胃耐药组的影响不显著;饲喂高粗料的肉牛瘤胃样品中氯霉素和微霉素(microcin)耐药基因占主导地位,而饲喂高精料的肉牛对氨基糖苷和链霉素的耐药性更丰富。此外,高精料日粮还增加了变形菌门的相对丰度,其中包括许多动物和人畜共患病原体。Thomas等[56]研究发现饲粮中添加莫能菌素和泰乐菌素的肉牛瘤胃中检测到了大环内酯类耐药基因(ermF和ermG),在未添加抗生素的肉牛瘤胃中检测到了氨基糖苷类耐药基因(aadE和aph(3)-III)。上述研究结果表明牛瘤胃微生物普遍存在耐药基因,与抗生素饲料添加剂的使用没有必然联系。目前关于羊瘤胃微生物耐药组研究非常有限,Hitch等[57]在绵羊瘤胃中发现了30种不同的耐药基因,以达托霉素(daptomycin)耐药基因最为常见。
除瘤胃外,还有学者研究了使用抗生素对肉牛粪便微生物耐药组的影响。饲粮中添加莫能菌素后,肉牛粪便中共检测到了43种耐药基因,主要为氨基糖苷、β-内酰胺、四环素和大环内酯-林可酰胺-链霉菌素 B(macrolide-lincosamide-streptogramin B)类,与没有添加莫能菌素的肉牛相比,四环素和MLS等耐药基因相对丰度并未降低[58]。北美经常在肉牛抵达饲养场后注射抗生素以控制呼吸道疾病,土拉霉素是一种用于预防与呼吸道疾病相关的抗生素[59-61],给新进牛只皮下注射土拉霉素后,分别在注射后的第1天和第11天比较对照组和注射组微生物和耐药组差异,结果发现两组之间的微生物组和耐药组成并没有显著差异。这些结果表明,与普通的代谢型抗微生物药物治疗相比,向饲养场的过渡以及饮食、地理环境的变化可能对饲养场牛的粪便微生物耐药组的影响更大[62]。此外,最近一项研究发现,饲养过程中使用抗生素的牛场粪便中的耐药基因要高于不使用抗生素牛场粪便中的耐药基因丰度,其中育肥牛的四环素和大环内酯类-林可酰胺-链霉菌素B类耐药性比奶牛粪便中丰富,而β-内酰胺类在奶牛粪便中更丰富,但过程分析(Procrustes analysis)发现微生物群落与耐药组缺乏一致性[63]。最近有学者研究了使用抗生素对犊牛粪便微生物耐药组的长效作用影响。将42只小牛犊随机分为3组,第一组在5 d内每天口服两次1 g土霉素(高土霉素),第二组在7周内每天接受100-200 μg的土霉素(低土霉素),第三组未接受土霉素(对照组),通过宏基因组测序分析了对肠道菌群和耐药基因丰度的时间影响。结果表明3种耐药基因(tetM、floR和mel)的相对丰度在对照组和抗生素之间存在显著差异。通过qPCR验证宏基因组测序结果发现高土霉素组在第28-35天的tetM丰度达到峰值,而在低土霉素组中未发现任何耐药基因丰度的增加[64]。除使用抗生素外,最近也有研究表明饲粮中添加酿酒酵母对肉牛粪便中的耐药组无显著影响[65],该研究结果表明四环素耐药基因的相对丰度最高,包括tetQ、tetO、tetW和tet32;大环内酯-林可酰胺-链霉菌素 B的mefA基因相对丰度最高,其次是ermq、mphb和lunc;氨基糖苷类耐药基因中,相对丰度最高的是ant9,其次是cfx。上述研究表明除使用抗生素或益生菌外,其他因素(例如农场的位置、牛源、管理模式等)都可能影响了粪便耐药组,因此无法简单地将粪便耐药组归咎于单一因素的影响。
3 乳中微生物耐药组分析
据估计,美国至少有3%的人口消费未经巴氏消毒的生牛乳,且对于生牛乳需求持续增长。但是,食用原奶会导致食源性疾病,并且是含有可转移的抗微生物耐药基因(ARG)的细菌的来源。Liu等[66]比较分析了加利福尼亚州生牛乳和不同方式巴氏消毒后牛乳中微生物组及其耐药组。结果表明刚采集的生牛乳和高温瞬时巴氏消毒的牛乳中未检测到任何耐药基因,在室温下放置24 h后,生牛乳中检测到了49种耐药基因,分别为多药、氨基糖苷、β-内酰胺和四环素这4大类耐药基因。对耐药组的微生物宿主进行预测发现,9个已知菌科可能携带这些ARG,其中假单胞菌科(Pseudomonadaceae,36个)具有最多的独特ARGs、其次是肠杆菌科(Enterobacteriaceae,28个)、耶尔森菌科(Yersiniaceae,14个)和莫拉菌科(Moraxellaceae,8个)。最近研究发现坦桑尼亚北部地区居民携带的耐药性大肠杆菌可能来源自生牛奶[67];巴西的一项研究表明,从水牛奶中分离出的凝固酶阴性葡萄球菌可能是潜在的耐药基因如耐甲氧西林基因(mecA)的宿主[68]。上述研究表明,耐药基因经牛奶向人体中的传播对人类健康造成的潜在危害可能比特定的病原体更为普遍,因此需要特别关注消费未经巴氏消毒奶制品的低收入国家[69-70]的微生物食品安全风险。
4 未来研究方向
全球范围内对于畜禽消化道及其产品微生物耐药组分析研究已经取得了一定的进展,主要体现在初步明确了上述耐药组的基因组成和相对丰度。然而目前微生物耐药组分析还存在着一定的局限性,从分析技术方法和研究思路方面还需要进一步拓展挖掘。
首先,目前科学文献中至少公开了近50种可用于分析耐药组的资源[71-72],既包括了可以嵌入用户自己的生物信息学流程的基础ARG参考数据库,也包括了自带参考数据库且集成搜索工具的全套分析工具。由于这些分析工具的功能差异很大,因此需要考虑使用不同工具获得的结果的可比性[73]。
其次,耐药组依赖于细菌组成,而后者的分析受限于已知的微生物数据库,鉴于细菌数据库的局限性,目前尚有大量无法鉴定的微生物,因此已知的ARG可能仅代表实际抗菌素耐药菌种群的一小部分。可以合理假设,随着细菌基因组测序和功能宏基因组学的爆炸式增长以及数据库的不断完善,将鉴定出许多以前功能未知且无法单独通过序列识别的新型ARG[24]。
第三,细菌产生耐药性的一个重要原因是能够通过质粒(Plasmid)之类的可移动遗传元件(Mobile genetic element,MGE)获得耐药基因的能力[74]。这是由于细菌之间存在广泛的水平基因转移(Horizontal gene transfer,HGT)[75-76]。质 粒 介导的耐药基因包括qnrA、blaCTX-M和mcr-1等[77]已追溯到了其环境和动物起源,然而目前针对畜禽微生物质粒等MGE携带的耐药组研究仍然非常有限。已有研究表明,质粒是牛瘤胃细菌群体中大量存在的MGE之一[78],未来可基于ACLAME[79]和PlasmidFinder[80]等参考数据库进一步明确畜禽消化道或产品中MGE携带的耐药组,为限制耐药基因通过HGT在细菌之间传播提供依据。
第四,目前畜禽微生物耐药组研究主要基于宏基因组短链[55-56]或长链测序[81]等技术,基因表达能够更好地评估生物生态系统内功能活性[82],但耐药组的表达及其影响因素尚不清楚。最近已有研究利用宏基因组学和宏转录组评估了废水处理厂的耐药组,并揭示了工厂位置不仅影响耐药组组成,而且影响具体耐药基因的表达[83]。最近也有基于宏转录组学研究分析了鸡和猪肠道的耐药组,但其样本数理有限(每种动物只有6个样品)[84],因此未来需要更多基于宏转录组学的研究,充分了解耐药基因的表达情况,从而有针对性地对其进行调控。
最后,目前耐药组研究的最大局限在于没有对耐药基因的功能进行验证,通过基因注释获得的耐药基因未必具有真正的耐药活性,因此一定程度上限制了将ARG微生物标记物用于新兴耐药机制的临床应用。对于畜禽等养殖动物肠道等环境中新型ARG的存在以及上述ARG的耐药和传播机制有待于系统地研究和进一步验证[85]。
5 总结
耐药组分析表明畜禽消化道及其产品微生物存在丰富的耐药性基因,这些耐药性基因的存在可能与抗生素的使用没有直接联系,但其组成和相对丰度可能受到抗生素、益生菌或其他饲料添加剂的影响。未来需要进一步完善耐药组分析手段和技术,探明耐药组的表达以及质粒携带的耐药组,从而获得完整全面的畜禽消化道微生物耐药组分析结果。这将有助于充分评价动物养殖过程中耐药基因向人类传播的可能性,并通过有效调控途径降低耐药性基因对人类健康和环境的威胁。
