自噬在沙门菌抗感染免疫中的作用
2021-01-22杜万年张志强
王 苗,杜万年,张志强
(河北科技师范学院,河北 秦皇岛 066000)
自噬是一种细胞“自食现象”,通过自噬,细胞能够实现对变性、衰老和失去功能的蛋白质、核酸等生物大分子降解,实现物质的再循环。其最大的特点是形成一个双层膜泡结构,将待降解的细胞质物质包裹起来的,这个结构称之为自噬体。除了生理性的自噬现象,病理性自噬也被证实存在于多种疾病模型中,尤其是病原感染性疾病。已有研究表明,多种病原微生物均可造成细胞自噬,通过调控宿主细胞自噬过程,病原能够完成逃避宿主免疫杀伤建立感染。
沙门菌可诱导宿主细胞发生自噬以应对宿主免疫系统,因此经常被用作研究细菌触发细胞自噬以及自噬介导的宿主防御的生物模型。沙门菌在侵入动物机体后主要在单核巨噬细胞内生长增殖,为避免过度增殖引发宿主适应性免疫的清除,沙门菌会通过触发细胞的自噬限制其在细胞内的增殖,减少对宿主免疫系统的刺激。沙门菌通常位于含沙门菌的液泡(Salmonella-containing vacuole,SCV)中,并利用两种类型的免疫系统对SCV 产生影响,因此沙门菌感染与细胞的自噬免疫途径存在着密不可分的关系。
1 沙门菌感染引发细胞自噬机制
沙门菌属成员宿主范围广泛,相当多的沙门菌属于人兽共患病原菌。在动物上,沙门主要感染幼龄动物,3 周龄以内的雏鸡、5 月龄以下的仔猪、1月龄以后的犊牛、断乳羔羊、6 月龄以内的幼驹最易感,临床症状多表现为败血症和肠炎;在人上,沙门菌主要通过食源途径感染,引发食物中毒和败血症,是一类重要的人畜共患病原体[1]。沙门菌属成员众多,有鼠伤寒沙门菌、伤寒沙门菌、肠炎沙门菌等多种血清型,其致病相关的毒力基因主要位于染色体和质粒中,这些毒力相关基因和调控因子聚集在染色体的特定区域,称为沙门菌毒力岛[2](Salmonella pathogenicity islands,SPIs)。沙门菌毒力岛1(SPI-1)和毒力岛2(SPI-2)能够编码两种三型分泌系统(Type III secretion system,T3SS)完成,在沙门菌感染宿主细胞以及触发细胞自噬逃避免疫杀伤过程中发挥关键作用[3-4]。
1.1 沙门菌感染过程沙门菌通过SPI-1 T3SS 介导的方式触发细胞自身内化侵入宿主细胞[5]。内化之后,沙门菌会在宿主细胞内形成含菌小泡,SCV 不同于吞噬溶酶体,对沙门菌友好,适合沙门菌的存活和增殖。SCV 的生成和成熟依赖于SPI-1 T3SS 和SPI-2 T3SS 效应蛋白的参与,二者相互作用调控内吞途径,以避免溶酶体的融合和SCV 的降解[6]。沙门菌成功侵入宿主细胞后初期引起炎症反应,但随着其在细胞内感染程度的加深,会通过一系列机制抑制宿主炎症反应[7]。
沙门菌通过T3SS 效应蛋白调控宿主免疫系统的机制如图1 所示。沙门菌鞭毛蛋白表达量的下降可显著抑制炎症小体NLRC4 的促炎作用,调控三羧酸(TCA)循环代谢物柠檬酸的产生,削弱NLRP3 活化炎症巨噬细胞反应[8]。此外,许多T3SS 效应蛋白具有抗炎作用。SPI-1 T3SS 效应蛋白AvrA 和SPI-2 T3SS 效应蛋白SseL 可以抑制NF-Kb 信号通路重要分子IκBα 降解,通过NF-Kb 信号通路调控下游炎症因子表达,AvrA 还可通过抑制p38 和JNK 信号通路调控细胞炎症反应[9]。SPI-2 T3SS 效应蛋白GogA、GtgA 和PipA 是同一蛋白酶家族的成员,它们共同作用使NF-κB 家族的特定成员RelA 和RelB 表达量下降,进而调控炎症反应。沙门菌T3SS 效应蛋白SspH1 可直接抵达宿主细胞核内,通过与蛋白激酶1(Protein kinase,PKN1)的相互作用抑制NF-κB 介导的基因表达[10]。效应蛋白SptP 由两个结构域组成,N-末端结构域处于Cdc42 和Rac1 的间隙,其作用是介导SopE 对肌动蛋白细胞骨架的重构;C-末端结构域具有酪氨酸磷酸酶活性,能够调控沙门菌感染细胞MAPK-ERK 信号通路的激活。SptP 主要通过调控Raf1 的表达来抑制MAPK 途径[11]。SptP 和SspH1通过抑制ERK 激活表达降低了肠上皮细胞的IL-8 生成量,SpvC 可通过去磷酸化灭活ERK 从而减少促炎性细胞因子的产生[12]。GogB 通过靶向宿主SCF E3 泛素连接酶抑制IκBα 的降解,限制激活NF-κB 途径达到抗炎目的[13]。SseK1 是SPI-1 T3SS 和SPI-2 T3SS均能够分泌的一种效应蛋白,具有n-乙酰葡萄糖胺转移酶活性,可修饰TNF-α 受体TNFR1 和接头分子TRADD,抑制TNF-α 介导的NF-κB 活化[14]。血红素加氧酶1(HO-1)是沙门菌对抗炎症反应的重要介质,该成分主要存在于宿主细胞内,很多病原菌在感染过程中会诱导宿主细胞产生HO-1,沙门菌通过巨噬细胞具有上调HO-1 表达量的作用,为沙门菌提供了生存空间[15]。

图1 沙门菌感染调控宿主免疫系统的机制(引自Bernal-Bayard J[29])
感染早期发生后,SPI-1T3SS 系统表达量普遍下调,在低pH 值、低Mg2+/Fe3+含量和低营养有效性的吞噬环境中诱导SPI-2 T3SS 的表达[16]。此系统分泌的效应蛋白对于SCV 膜泡的修复和维持具有至关重要的作用,其中SseJ 作用于膜泡上的磷脂和胆固醇,可以使SCV 的蛋白表位发生改变,同时还可以使胞质内胆固醇含量升高。sifA 结构也可以保持SCV 膜的完整性,进而为沙门菌在宿主细胞内复制生存提供有利保障[17]。
1.2 细胞的自噬机制自噬是一种高度保守的细胞内过程,其将不需要的或受损的细胞质成分传递给溶酶体进行降解。这一过程涉及36 种以上的自噬相关蛋白复合体相互作用,这些蛋白复合体相互协调,将细胞质物质包裹在双膜结合的液泡中,然后与溶酶体融合形成降解性自溶体[18]。通过这种方式,自噬作为一种质控机制发挥作用,消除蛋白质聚集体和受损的细胞器以维持细胞内稳态。
SPI-1 T3SS 是主动侵袭所必需的,此外SPI-2 T3SS 的表达促进了沙门菌在自噬体膜泡内存活[19]。在沙门菌感染宿主细胞期间,SPI-1 T3SS 介导的SCV 损伤使泛素和galectin-8 靶向SCV 内的沙门菌或细胞质中的游离沙门菌,完成对其的清除。这些活动信号能够招募重要的抗菌自噬分子,包括转运受体激酶TBK1 和WIPI2,通过抗菌自噬限制沙门菌增殖[20]。自噬在修复受损的SCV 膜方面也发挥作用,能够诱导SCV 内沙门菌SPI-2 T333 活化。在上皮细胞中,沙门菌通过SPI-2 T3SS 介导的方式诱导SCV附近形成泛素聚集体。这些聚集体被自噬机制识别,SPI-2 T3SS 效应器SseL 是一种二肽酶,能够降低细胞自噬流,有助于细胞内沙门菌的复制[21]。此外,SPI-2 T3SS 通过向SCV 招募局灶性粘附激酶(FAK)和激活Akt-mTORC1 信号通路抑制巨噬细胞自噬发生,从而抑制干扰素β(IFN-β)介导的保护性细胞因子反应[22]。SpvB 是一种具有ADP 核糖基转移酶活性的SPI-2 T3SS 效应蛋白,通过防止G-肌动蛋白聚合成F-肌动蛋白丝抑制自噬体的形成[23]。
2 自噬在沙门菌感染中的双重作用
细胞自噬作用于沙门菌感染包括3 条途径,其中两条途径作为抗菌防御机制,攻击入侵的沙门菌,清除病原体,进而保护宿主细胞;还有一条途径被感染细胞的沙门菌所利用,既修复了破损的SCV,又为自身的复制生存提供了环境。
2.1 细胞自噬对沙门菌具有免疫作用宿主细胞可以通过两种自噬方式防御沙门菌的感染。如图2 所示(途径1),在第一种途径中,虽然大多数细菌都包含在SCV 中,但是有部分沙门菌能逃出空泡,在胞浆中过度复制。这些游离性沙门菌难以长期在胞浆内生存,从SCV 释放不久后就被泛素(Ubiquitin)标记,其中P62 为泛素化结合蛋白,可以与泛素标记的细菌结合,同时P62 也作为自噬底物与LC3 结合介导自噬体,通过泛素结合域与泛素化细菌结合,并与自噬体分子标记物Atg8/LC3 和自噬底物SQSTM1/p62 相互作用将其与新生的自噬体连接。一旦隔离在完整的自噬体中,沙门菌将会被降解[24]。细胞防御沙门菌自噬作用的第二种途径是识别SPI-1T3SS 的针孔装置遗留的SCV 膜损伤。如图2 所示(途径2),在这种情况下,沙门菌存在于受损的SCV 中。SPI-1 T3SS 造成的SCV 膜穿孔,会招募包括半乳凝素(galectin-8)在内的多种细胞溶质成分,galectin-8 是膜结构完整的标记蛋白,是自噬的诱导分子。galectin-8 标记的SCV 招募LC3、NDP52 到细胞膜上,促发自噬信号的产生,进一步发生自噬捕获和沙门菌的降解[25]。
自噬作为一种基本的分解代谢机制,它通过溶酶体的作用参与非必需或功能失调的细胞成分的降解。在这个过程中,待降解的物质被逐渐成熟的自噬体包裹,然后,自噬体与溶酶体融合,形成自噬溶酶体。最后,借助于溶酶体内存在的多种酶类和酸性环境,待降解物质被降解为氨基酸和糖类等,进而被细胞循环利用[26]。沙门菌依赖SPI-2 T3SS 诱导SCV 附近形成泛素聚集体,这些聚集体被自噬机制识别后,发挥免疫作用防御沙门菌的感染,在此过程中,T3SS 效应蛋白在沙门菌逃避免疫系统中的具体作用如表1 所示[27]。

表1 T3SS 效应蛋白在沙门菌逃避免疫系统中的作用(引自Bernal-Bayard J[29])
2.2 沙门菌利用自噬机制增殖感染沙门菌作为兼性胞内菌,可以通过诱导细胞自噬促进自身存活。与自噬作为细胞天然免疫防御机制相比,沙门菌可以分泌部分效应蛋白,避免自噬过程中SCV 被溶酶体融合,从而在SCV 中持久增殖。如文中提到的鼠伤寒沙门菌,携带的毒力质粒中含有一段约8 kb 的高度保守区域[28],负责细菌的血清抵抗、粘附和定植,沙门菌质粒毒力基因spv 区域包含了3 个与毒力相关的基因:转录调节因子spvR 与两个结构基因spvB 和spvC[29]。其中spvB 决定着沙门菌在巨噬细胞中的增殖程度,并诱导沙门菌感染期间宿主细胞的晚期凋亡[30]。SPV 蛋白是ADP-核糖基转移酶活性所必需的,它作为细胞内毒素,共价修饰单体肌动蛋白,为沙门菌感染营造良好的生长环境[31-32]。
如图2 所示(途径3),自噬体分子标记物Atg8/LC3 的增多会促进SCV 膜的修复,并使SCV 成熟,随后招募膜装运关键分子Rab5 和Rab7,以确保细胞成熟和SPI-2 T3SS 的表达[33],进而产生用于维持SCV 膜完整性的效应蛋白丝状体SifA,促进SCV 的成熟,使沙门菌在宿主细胞内复制生存[34]。在此期间,SPI-1 T3SS 介导的SCV 损伤使泛素和galectin-8信号分子释放,随即吸收重要的抗菌自噬成分,与此同时,SPI-2 T3SS 效应蛋白SseL 激活后通过降低自噬通量完成细胞内沙门菌的复制,进而诱导巨噬细胞的凋亡。
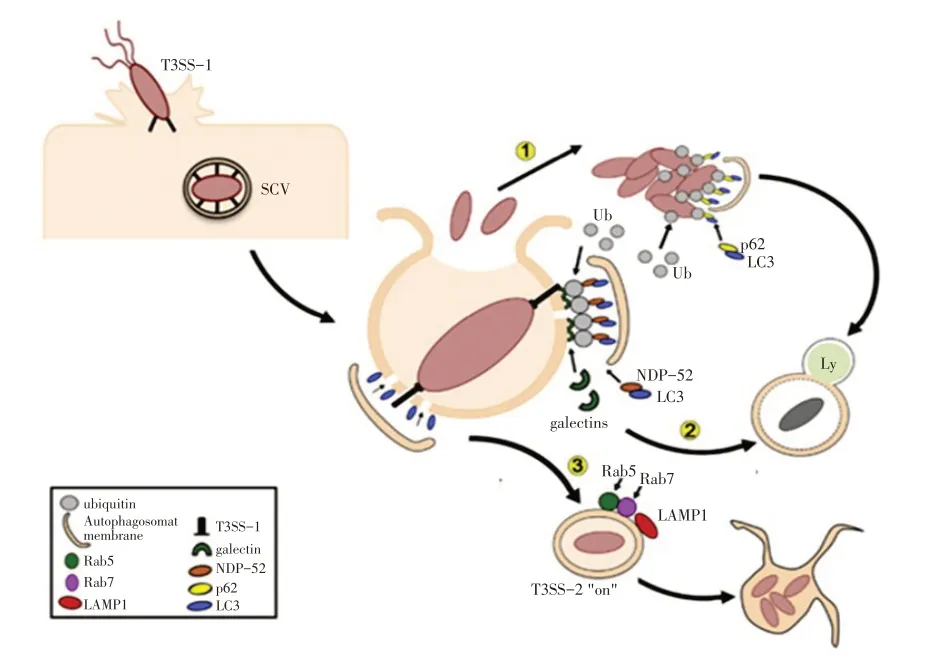
图2 自噬作用于沙门菌感染的三大途径(引自Owen K A[24])
3 小结与展望
沙门菌感染宿主细胞时,由沙门菌毒力岛SPI-1和SPI-2 编码的两种三型分泌系统发挥功能,其中SPI-1 T3SS 是入侵上皮细胞和SCV 生物形成早期所必需的,其针状装置介导了宿主细胞的入侵,对宿主细胞膜的损伤可以刺激宿主触发抗菌自噬反应;其次SCV 膜的破裂会引起膜内酸化环境消失,从而诱导SPI-2 T3SS 的表达,促进沙门菌在自噬体膜泡内存活,增殖和扩散。
沙门菌感染过程中自噬一方面作为抗菌防御机制,发挥免疫作用保护宿主细胞,另一方面沙门菌可以利用自噬体作为其增殖场所,达到加重机体感染的目的。因此,自噬在沙门菌感染中发挥着双重作用,既能清除病原体,防御沙门菌的入侵,又能加剧感染,损伤宿主细胞。本实验室在沙门菌毒力基因探究方面取得了部分进展,如htrA、sufB、YbjX等基因,利用λ-Red 同源重组系统构建了基因缺失突变株,通过与野生型菌株对比分析其巨噬细胞内存活能力、对环境应激抵抗力和生物被膜形成能力等生物学特性,进而研究毒力基因对沙门菌致病力的影响。但是,在细胞自噬与沙门菌感染的信号途径和作用机制方面仍需进一步研究。无论自噬机制是通过何种途径作用于感染的沙门菌,二者都有密不可分的关系。
相关文献发现[9,11,27,29],自噬在沙门菌感染早期时便启动发挥作用,以抑制沙门菌对机体造成进一步损害,然而自噬在保护细胞的同时,也会被沙门菌分泌的效应蛋白利用进而加重宿主细胞的感染,使沙门菌得以增殖生存。关于自噬在沙门菌感染过程中发挥作用的研究,多数集中于动物模型,而有关家禽家畜相关的报道尚未出现,因此在生产实践中有关利用细胞自噬防治沙门菌的领域仍待进一步深入研究,为沙门菌病的防治提供指导意义,进而提高养殖业的经济效益,所以利用细胞自噬防治沙门菌,将会成为新的研究热点。
