金堂黑山羊不同组织内参基因筛选与稳定性分析
2021-01-22张楠驰
张楠驰,李 娟,王 利*,魏 勇
(1.西南民族大学青藏高原动物遗传资源保护与利用教育部和四川省重点实验室,四川 成都 610041;2.四川省畜牧科学研究院动物遗传育种四川省重点实验室,四川 成都 610066;3.阿坝职业学院,四川 阿坝 623200)
金堂黑山羊是我国重要的山羊品种之一,具有体质结实、性成熟早、繁殖力强、多胎性好、生长速度快和抗病能力强等特点。诸多研究者从基因角度对金堂黑山羊生长、免疫和营养等方面进行研究以提高金堂黑山羊肉质和产量。荧光定量PCR(qP⁃CR)技术是基因相关研究中的重要方法之一。为获得较为真实、准确的基因转录情况,在检测目的基因转录水平时需要加入内参基因,因此选择可靠、稳定的内参基因尤为重要。目前在qPCR 的研究中通常使用GAPDH 和ACTB 等基因作为内参基因,但是同一内参基因可能在不同物种、不同组织等情况下转录水平的稳定性存在差异[1]。肽基脯氨酰异构酶B(Peptidylprolyl isomerase B,PPIB)和羟甲基胆汁合酶(Hydroxymethylbilane synthase,HMBS)是分析简阳山羊骨骼肌发育过程中肌内脂肪(Intramuscular fat,IMF)相关基因的最佳内参基因,而18S rRNA 和GAPDH 稳定性相对较差[2]。ACTB 在山羊胃、小肠和卵巢中转录水平的稳定性最佳,18S rRNA 在心和脾中转录水平的稳定性最佳,HMBS 在子宫和肺中转录水平的稳定性最佳[3]。虽然国内外已有关于绵羊和山羊等家畜内参基因筛选的研究,但品种间的差异可能会影响羊亚科内不同品种山羊内参基因的稳定性[4]。目前尚未见金堂黑山羊不同组织内参基因筛选的研究。因此,对金堂黑山羊不同组织内参基因的筛选在提高目的基因在金堂黑山羊不同组织内转录水平研究结果的准确性方面有着重要意义。本实验以金堂黑山羊6 种不同组织作为研究对象,采用不同程序分析其16 个候选基因的稳定性,从而筛选出可应用于金堂黑山羊不同组织qPCR 分析的最佳内参基因,以期为检测金堂黑山羊目的基因转录水平的研究提供参考。
1 材料与方法
1.1 主要实验材料及实验动物RNAiso Plus、Prime ScriptTMRT Reagent Kit、DL2000 Marker、TB GreenTMPremix ExTaqTMⅡ酶,均购自宝生物工程(大连)有限公司。实验动物为12 只110 日龄四川金堂黑山羊,雌雄各半,体重为(18.98±0.75)kg,购自四川省某山羊核心育种公司。解剖后取心、肝、脾、瘤胃、背最长肌和臀肌组织装入冻存管中后立即放入液氮中冻存,用于各组织样品总RNA 的提取。
1.2 引物设计与合成以山羊GAPDH、PPIB、UXT和ACTB 等16 个基因作为候选基因,参考GenBank登录的基因序列,采用Primer Premier 5.0 设计引物(表1),引物均由上海生工生物工程技术服务有限公司合成。
1.3 候选基因在山羊不同组织中的转录水平分别取12 只黑山羊的心、肝、脾、瘤胃、背最长肌和臀肌组织,按常规方法处理后,提取各组织总RNA,利用NanoDrop Lite 和Aligent 2100 检测总RNA 质量,根据反转录试剂盒说明反转录为cDNA。
各基因RT-qPCR 总体系为10 μL,各组分含量分别为:上下游引物各0.8 μL;DEPC H2O 2.2μL;TB GreenTMPremix ExTaqTMⅡ5.2 μL;cDNA 模板1.0 μL。反应条件为:95 ℃3 min;95 ℃10 s,退火(47 ℃~60 ℃)20 s(各基因退火温度见表1),72 ℃30 s,共39 个循环;溶解曲线阶段95 ℃15 s,60 ℃1 min,95 ℃5 s。取最适退火温度的扩增产物,分别稀释103、104、105、106、107、108、109倍,进行RT-qP⁃CR 扩 增,利 用QuantStudioTMDesign & Analysis Soft⁃ware v1.4.2 绘制标准曲线,并检测表1 中各候选基因在各组织样品中的转录水平,每个样品平行重复3次,并设置无cDNA 模板的阴性对照。
1.4 内参基因的稳定性验证采用郑姚等设计的山羊DQB1 基因引物(F:ATGTCTGGGATGCTGGC/R:CGCACGAGCCCCTTCTG)[5],分别以筛选出的最佳候选基因组合、最佳候选基因和2 个转录水平最不稳定的候选基因为内参,利用RT-qPCR 检测DQB1 基因在黑山羊心、脾和臀肌中的转录水平,以验证内参基因的稳定性。RT-qPCR 反应体系和条件同1.3。

表1 候选基因引物序列Table 1 Primers for candidate genes
1.5 数据统计和分析利用QuantStudioTMDesign &Analysis Software v1.4.2 统计候选基因转录水平数据和绘制各基因标准曲线,采用GraphPad Prism5.0 绘制基因转录水平图谱,以SPSS 26.0 分析数据之间的差异性。分别采用geNorm 程序、NormFinder 程序和BestKeeper 程序并参照吴建阳等描述的方法对各候选基因的稳定性进行分析[6]。采用上述3 种程序分析得到的各候选基因稳定性排序结果的平均值,作为各候选基因的综合稳定性分析的判定依据。
2 结 果
2.1 RNA 质量检测提取的各组织RNA 质量检测结果显示,其OD260nm/OD280nm值均在1.9~2.1,OD260nm/OD230nm值均大于1.90,RNA 完整性(RIN 值)均大于9.0,28 S/18 S 值均大于1.5。这说明各样品RNA 提取质量较好,纯度和完整性均较高,满足后续分析要求。
2.2 候选基因引物的特异性及扩增效率金堂黑山羊GAPDH、PPIB、UXT 和ACTB 等16 个候选基因的PCR 结果显示,均未见二聚体和杂带,产物长度与预期基本一致,表明引物特异性好(图1)。各候选基因标准曲线R2均大于0.99,扩增效率均在90%~120%,表明各引物可用于RT-qPCR 扩增并得到可靠的结果。
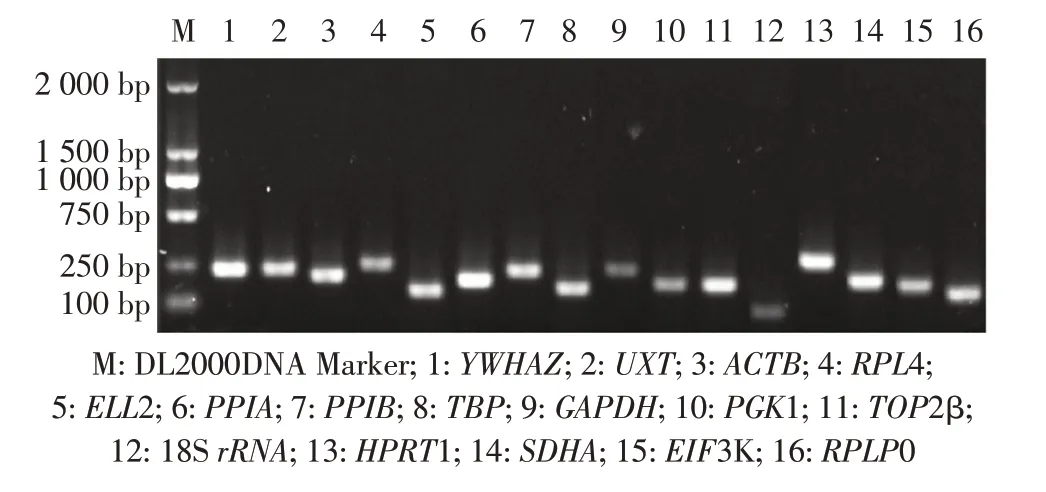
图1 候选基因引物特异性Fig. 1 Primer specificity for candidate genes
2.3 候选基因在山羊不同组织中的转录水平经荧光定量PCR 检测,结果显示:不同候选基因在不同组织中的转录水平存在一定的差异性,其中PPIB、ACTB、YWHAZ、RPL4、RPLP0 在不同组织中转录水平基本一致,GAPDH、UXT、SDHA、PGK1、PPIA、TBP 和ELL2 在不同组织中转录水平相对一致,而HPRT1、18S rRNA、TOP2β、EIF3K 在不同组织中转录水平一致性相对最差(图2)。
2.4 geNorm 程序分析候选基因在山羊不同组织中转录水平的稳定性利用geNorm 程序分析候选基因的稳定性,根据吴建阳等的判断标准,M 值越小候选基因稳定性越好[6]。结果显示,在不同组织中,PPIB 和YWHAZ 稳定性相对最好,18S rRNA、EIF3K稳定性相对最差(图3)。另外,配对变异系数结果显示,V2/3=0.085<0.15,表明目的基因在山羊不同组织转录水平的检测只需使用2 个内参基因即可(PPIB 和YWHAZ)(图4)。上述结果表明,PPIB 和YWHAZ 是最佳内参基因组合。
2.5 NormFinder 程序分析候选基因在山羊不同组织中转录水平的稳定性利用NormFinder 程序分析候选基因稳定性,根据吴建阳等介绍的,稳定值越小的候选基因稳定性越好[6]。因此,PPIB 和ACTB 稳定性相对最好,稳定值分别为0.171 和0.220,而18S rRNA、EIF3K 稳定性相对最差,稳定值分别为0.416 和0.456(图5)。另外,NormFinder 程序筛选出最佳组合为PPIB 和YWHAZ,其稳定值为0.134,进一步表明最佳内参基因组合是PPIB+YWHAZ。
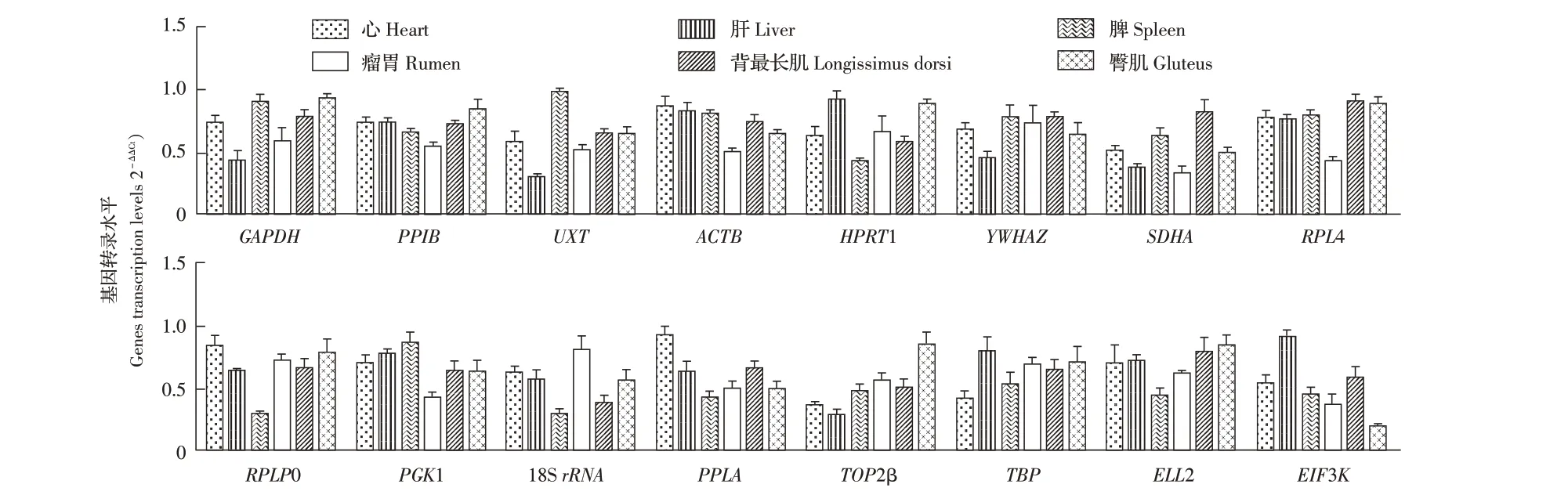
图2 候选基因在不同组织中的转录水平Fig. 2 The transcription levels of candidate genes in different tissues
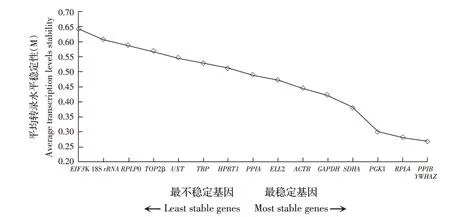
图3 利用geNorm 程序分析候选基因的平均转录水平稳定性Fig. 3 The stability of average transcription levels of candidate genes by geNorm program

图4 利用geNorm 程序分析候选基因的配对变异系数Fig. 4 The pairwise variations of candidate genes by geNorm program

图5 利用NormFinder 程序分析候选基因的稳定值Fig. 5 The stability values of candidate genes by NormFinder program
2.6 BestKeeper 程序分析候选基因在山羊不同组织中转录水平的稳定性利用BestKeeper 程序分析候选基因的稳定性,根据吴建阳等介绍的判断标准,相关系数(r)越大且标准差(SD)和变异系数(CV)越小的候选基因稳定性越好[6]。因此,稳定性相对最好的候选基因为PGK1,其次是YWHAZ、ACTB、PPIB 和HPRT1;稳定性相对最差候选基因为EIF3K,其次是TOP2β、RPL4、TBP 和18S rRNA(表2)。各基因p 值均小于0.05,说明结果均具有统计学意义。以上结果表明,PGK1 和YWHAZ 为最佳组合,该组合的相关系数为0.986。
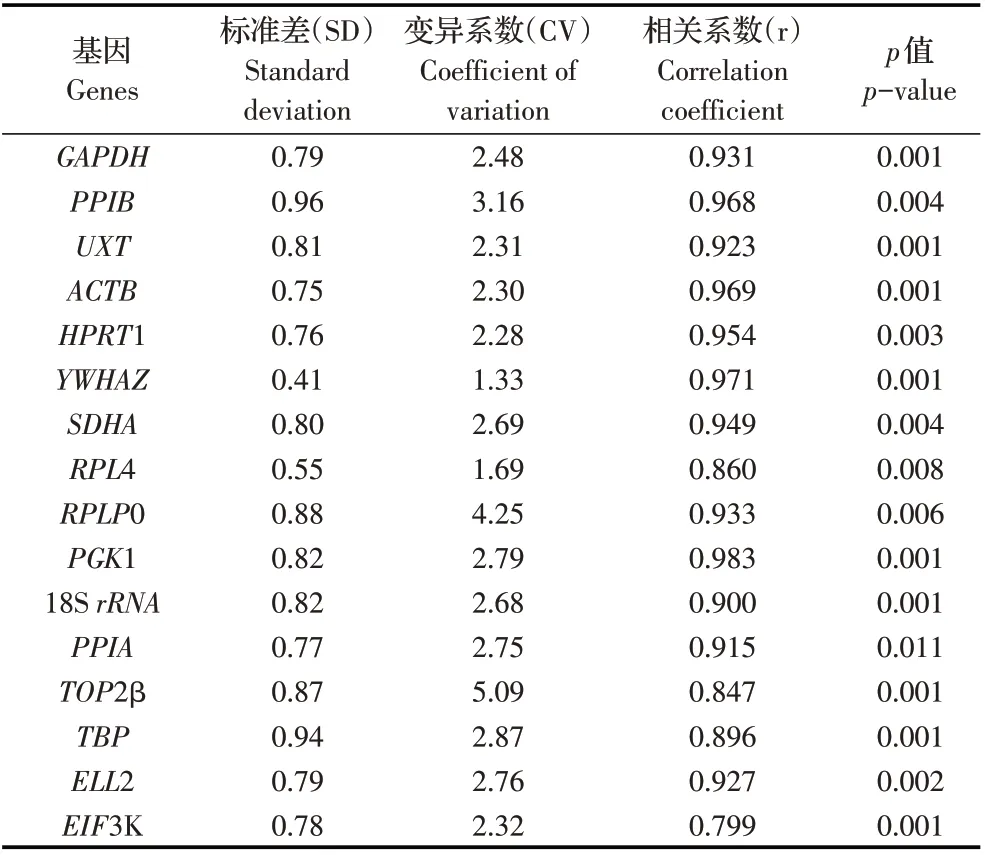
表2 利用BestKeeper 程序分析候选基因的稳定性Table 2 The expression stability of candidate genes by BestKeeper program
2.7 综合分析候选基因在山羊不同组织中转录水平的稳定性分别将geNorm、NormFinder 和BestKeeper程序分析得到的GAPDH、PPIB、UXT 等16 个候选基因的稳定性进行排序(基因稳定性越好,稳定性等级数值越小),计算各候选基因平均稳定性等级(表3)。结果显示,PPIB 在黑山羊不同组织中转录水平的稳定性相对最好,其次是YWHAZ 和ACTB,而18S rRNA、TOP2β 和EIF3K 在黑山羊不同组织中转录水平的稳定性相对最差。综合分析候选基因稳定性结果表明,PPIB 和YWHAZ 可作为黑山羊不同组织的最佳内参基因组合,PPIB 是最佳内参基因。

表3 综合分析候选基因的稳定性Table 3 Overall stability ranks of candidate genes
2.8 内参基因稳定性验证为验证筛选出的最佳内参基因组合的稳定性,分别以稳定性最佳的基因组合PPIB 和YWHAZ(Ct 值平均数)、稳定性最佳基因PPIB 以及稳定性最差基因TOP2β、EIF3K 为内参基因,检测DQB1 在黑山羊心、脾和臀肌中的转录水平。结果显示,以最佳基因组合(PPIB+YWHAZ)和最佳基因(PPIB)为内参基因时,检测DQB1 基因在心、脾和臀肌中的转录水平结果相近,两组间无显著差异(p>0.05);而以TOP2β、EIF3K 为内参基因时,DQB1 基因在心、脾和臀肌中的转录水平存在显著的差异性(p<0.05),且与最佳基因组合和最佳基因所得结果均差异显著(p<0.05)(图6)。上述结果表明最佳内参基因组合(PPIB+YWHAZ)稳定性较好。

图6 内参基因稳定性验证Fig. 6 The verification of reference gene stability
3 讨 论
RT-qPCR 技术具有高敏感性和高重复性,被广泛应用于基因转录水平分析。已应用的内参基因在不同组织、不同物种、不同时间等条件下的转录水平均存在一定的差异,且目前尚未发现在任何实验条件下均能稳定表达的内参基因[7]。选择不稳定的内参基因会导致结果的变化和不准确,因此筛选出在不同条件下转录水平较稳定的内参基因具有重要的意义[8]。Wang 等在RNA 制备方法影响猪卵母细胞内参基因转录水平的研究中发现,GAPDH 和18S rRNA 是卵丘细胞的最佳内参基因,YWHAZ 和ACTB是卵母细胞的最佳内参基因[9]。在反刍动物脂肪、乳腺和肝脏等组织内参基因筛选的研究中发现,UXT,EIF3K 和RPLP0 是牛脂肪中最稳定的内参基因[4]。本实验中,采用RT-qPCR 检测GAPDH、PPIB、UXT 等16 个候选基因在黑山羊不同组织中的转录水平结果表明,任何一种内参基因在不同组织中的转录水平均存在一定差异,这与别人的研究结果一致,也说明了内参基因筛选的重要性[10]。目前常用的内参稳定性分析有geNorm、NormFinder、BestKeeper 和RefFinder 等程序,且已被众多研究者用于内参基因的筛选分析。Augustyniak 等组合Best⁃Keeper、geNorm、NormFinder 程序和ΔCt 法筛选出人类神经细胞的内参基因[11]。Zhu 等采用geNorm、NormFinder 和BestKeeper 程序筛选山羊肌内脂肪最佳内参基因是PPIB[2]。Toscano 等采用NormFinder、BestKeeper 和RefFinder 程序筛选绵羊胃幽门组织最佳内参基因是YWHAZ[12]。许晴等采用geNorm、Norm Finder、BestKeeper 程序和ΔCt 法发现山羊肌内前体脂肪细胞相对最不稳的内参基因是EIF3K[13]。在单一内参基因不能满足实验要求时可选择2 个或2 个以上的内参基因进行校正。本实验通过geNorm、Norm⁃Finder 和BestKeeper 程序综合分析得出,在黑山羊不同组织中PPIB 可作为最佳的内参基因,在PPIB 单一内参基因无法满足实验要求的情况下,可选择PPIB+YWHAZ 作为内参基因组合。
针对不同品种的山羊所筛选出的最佳内参基因也不相同。Zhang 等对波尔山羊心、肝、脾等10 种组织筛选内参基因结果表明,18S rRNA、TBP 和HMBS 是最佳内参组合[3]。池永东等筛选简洲大耳羊组织最佳内参基因结果表明TBP、UXT 和RPLP0 稳定性均较好[14]。Bai 等研究发现SDHA、YWHAZ 和UBC 是辽宁绒山羊皮肤组织最佳内参基因组合[15]。本实验中,18S rRNA、TBP、UXT 和RPLP0 稳定性均不佳,而YWHAZ 稳定性较好。这说明了同一内参基因在同一物种不同品种间稳定性存在较大差异。同一品种在不同生长时期的内参基因稳定性也存在一定差异。陈利等研究表明,在同一生长时期(3 日龄)的11 个南江黄羊组织中HPRT1、RP2 转录水平稳定性最佳,在不同生长时期的骨骼肌中YWHAZ 和ACTB 转录水平稳定性最佳[16]。本实验对110 日龄金堂黑山羊6 种组织的最佳内参基因进行筛选,而筛选出的最佳内参基因组合PPIB+YWHAZ 在其他生长时期的稳定性是否最佳需进一步验证。目前已有的关于金堂黑山羊目的基因转录水平的研究中,多以GAPDH 和ACTB 为内参基因[17]。而有关山羊内参基因筛选的研究结果均表明ACTB 和GAPDH 转录水平稳定性一般[13-14,16]。本实验得到了相似的结果,GAPDH 和ACTB 分别在16 种候选基因中排名第5 和第3。本实验利用DQB1 基因验证筛选基因的稳定性结果表明筛选出的最佳内参基因在各组织中均具有较好的稳定性,可作为检测金堂黑山羊不同组织中目的基因转录水平中的内参基因,也表明本实验采用的geNorm、NormFinder 和BestKeeper 程序得到的结果准确。
综上所述,PPIB 基因在金堂黑山羊不同组织中转录水平的稳定性相对最佳,PPIB+YWHAZ 是最佳内参基因组合,可在金堂黑山羊不同组织荧光定量PCR 分析中作为内参基因,而EIF3K 基因转录水平的稳定性相对最差。
