寡聚原花色素通过激活Nrf2拮抗慢性阻塞性肺疾病大鼠的氧化应激
2021-01-21褚婉婷张淑香褚星霞
褚婉婷, 张淑香, 褚星霞
(1.固原市人民医院呼吸科,宁夏固原 756000;2.宁夏医科大学总医院呼吸与危重症医学科,宁夏银川 750004)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种缓慢进展的呼吸系统疾病,伴有慢性肺部炎症和不可逆的气流受限[1]。探讨COPD 的发生机制和治疗方法具有重要的意义。有研究[2-3]报道,Nrf2的下调与COPD 患者肺部氧化应激的增强和发病机理有关。核因子E2 相关因子2(Nrf2)是碱性亮氨酸拉链转录因子Cap’n’Coall 家族的成员,在上皮和肺泡巨噬细胞中表达[4-5]。Nrf2是调节抗氧化剂基因表达与细胞存活之间的重要链接,其上调和激活可增强抗氧化剂基因的表达,并保护细胞免受氧化损伤[6]。从葡萄籽和松树皮中提取的寡聚原花色素(oligomeric proanthocyanidins,OPC)可减轻哮喘气道炎症反应,增强COPD 患者的抗氧化能力并改善脂谱[7-9]。因此,本研究拟观察OPC 通过激活Nrf2对香烟烟雾和脂多糖(LPS)联合诱导的COPD 模型大鼠氧化应激的调节作用,以期为OPC临床治疗COPD提供依据,现将研究结果报道如下。
1 材料与方法
1.1动物30 只雄性Wistar 大鼠,体质量(200 ±20)g,购自上海SIPPR/BK 实验动物有限公司,动物质量合格证号:SCXK 2008-0016。将动物饲养在温度为(25±20)℃,湿度为(50±2)%,光照12 h/黑暗12 h 的环境中。暴露前后,所有动物均可自由饮水和进食。所有动物实验均按照美国国立卫生研究院关于实验动物的护理和使用的准则进行。
1.2药物、试剂与仪器OPC(纯度>99.80%)购自天津一方科技有限公司,批号:XR170314;地塞米松(DXM)购自上海信谊药厂有限公司,批号:18032。非过滤嘴香烟(每支香烟含有1.3 mg尼古丁、13 mg 焦油碳和14 mg 一氧化碳)(湖南中研实业有限公司);LPS 冻干粉(美国Sigma 公司);其他所有化学品和试剂均为分析级;丙二醛(MDA)、谷胱甘肽(GSH)试剂盒(南京建成生物工程研究所);兔抗8-羟基脱氧鸟苷(8-OHdG)抗体(英国Abcam Technology 公司);细胞质和核提取试剂盒(碧云天生物技术研究所);兔抗醌氧化还原酶(NQO1)抗体、兔抗血红素氧合酶1(HO1)抗体、兔抗Nrf2 抗体、兔抗GAPDH 抗体(美国Santa Cruz Biotechnology 公司)。WT40 检测器(上海威泰科技有限公司);AniRes2005 动物肺功能系统(北京贝兰博科技有限公司);CX31 显微镜(日本Olympus公司)。
1.3分组、动物建模与给药将大鼠随机分为5组,即正常组、模型组、OPC 低剂量组、OPC 高剂量组、DXM 组,每组6 只。除正常组外,其他各组大鼠均建立COPD 模型[10]。方法:将大鼠置于与真空泵相连的240-L 有机玻璃室中,把6 支香烟的烟气抽入室中,每天保持60 min,持续4 周。用WT40 检测器测量室内一氧化碳浓度,使保持在1 000 ~1 200 ppm 之间。第1、14天,氯胺酮/二甲苯胺麻醉大鼠,经鼻滴注LPS(2 mg/kg),然后使大鼠保持直立位置15 s,以促进LPS 在肺部的分布。依据症状、肺功能和肺组织病理等确定模型成功与否[11]。参照研究[12]报道,OPC 低、高剂量组大鼠从第1 ~28 天分别给予OPC 20.0、80.0 mg·kg-1·d-1连续灌胃。DXM 组大鼠从第8 天开始灌胃DXM 0.2 mg·kg-1·d-1,持续3 周。正常组采用新鲜空气和生理盐水代替。
1.4观察指标与方法
1.4.1 肺功能评价 第29天,大鼠麻醉后气管插管,使用AniRes2005 动物肺功能系统检测肺功能。该软件自动记录的参数包括:第0.3 秒用力呼气容积/用力肺活量(FEV0.3/ FVC)、最大呼气中段流量(MMF)、呼气峰值流量(PEF)速率和动态肺顺应性(Cydn)。
1.4.2 肺标本采集 对大鼠进行肺功能评价后,从心脏针刺放血。在大鼠停止呼吸后,收集肺组织,用冰(4 ℃)生理盐水灌洗,立即转移到液氮中。
1.4.3 氧化应激状态评价 应用相关试剂盒测定肺组织匀浆液中脂质过氧化物标记物MDA、GSH水平。
1.4.4 组织病理学评价 取大鼠右下肺组织用40 g/L 多聚甲醛固定24 h,在酒精中脱水12 h,包埋在石蜡中,切片,用苏木素-伊红染色,并固定在载玻片上。应用显微镜进行观察与拍摄,测定反映肺泡大小的指标——平均线性截距(MLI)和反映肺泡密度的指标——平均肺泡数(MAN)来评估肺气肿的程度。针对每个指标,均随机选择6个视野计算平均值。
1.4.5 免疫组织化学评价 将石蜡包埋肺组织切片,脱蜡和再水化后,在蒸汽压力锅中用柠檬酸缓冲液进行抗原修复2 min,切片迅速冷却至室温。用体积分数3%过氧化氢(H2O2)封闭内源性过氧化物酶。加入抗8-OHdG 抗体(1∶300 稀释)后于4 ℃培养过夜。于室温用二抗孵育20 min。使用二氨基联苯胺(DAB)溶液对切片进行显影,并用苏木素复染。应用显微镜随机选择5 个视野进行观察。
1.4.6 蛋白免疫印迹(Western Blot)分析 用冰裂解 缓 冲 液[含 有50 mmol/L Tris-HCl(pH 7.4),150 mmol/L NaCl,1%NP-40、0.1%十二烷基硫酸钠(SDS),1 mmol/L 蛋白酶抑制剂混合物和蛋白质磷酸酶抑制剂]裂解细胞,于4 ℃匀浆15 s 4 ~5次,将细胞裂解物于4 ℃、以12 000× g 离心30 min 除去细胞碎片。用细胞质和核提取试剂盒制备细胞质和核裂解物,用二喹啉甲酸(BCA)蛋白质测定试剂盒测定蛋白质浓度。在8%~10%SDS-聚丙烯酰氨凝胶电泳(PAGE)分离等量的蛋白质(20 ~60 mg),并转移到聚偏氟乙烯(PVDF)膜上。于室温将膜在50 g/L 脱脂牛奶中封闭2 h。分别加入NQO1 抗体(1∶500 稀释)、HO1 抗体(1∶1 000 稀释)、Nrf2 抗体(1∶500 稀释)和GAPDH 抗体(1∶2 000 稀释)于4 ℃孵育过夜。加入辣根过氧化物酶偶联的二抗室温孵育2 h。用电化学发光(ECL)试剂对蛋白条带进行可视化。最后使用Quantity One 软件(美国Bio-Rad实验室)对条带密度进行定量。
1.5统计方法采用SPSS 22.0统计软件进行数据分析。实验数据以均值±标准差(±s)表示,采用单因素方差分析进行组间比较,然后进行Tukey 事后检验或Games-Howell检验,以P <0.05为差异有统计学意义。
2 结果
2.1 OPC改善COPD大鼠肺功能图1 结果显示:与正常组比较,模型组大鼠的FEV0.3/FVC、MMF、PEF、Cydn均显著降低(P <0.05)。与模型组比较,OPC 高剂量组与DXM 组大鼠肺功能指标FEV0.3/FVC、MMF、PEF、Cydn 均升高(P <0.05),且各治疗组间比较,差异无统计学意义(P >0.05)。
2.2 OPC减轻COPD引起的肺气肿图2-A 结果显示:正常组肺部无明显病变,支气管上皮组织和肺泡壁完好无损,偶见炎性细胞浸润。模型组肺部出现明显的病变,可见大量炎性细胞(特别是中性粒细胞)浸润组织,许多浆细胞浸润肺泡间隙,肺泡壁增厚,肺泡扩张,支气管上皮组织脱落并缺失。与模型组比较,OPC 低、高剂量组肺组织病变程度明显减轻,高剂量组轻于低剂量组。此外,采用MAN 和MLI 评估肺气肿的严重程度。图2-B、-C 结果显示:与正常组比较,模型组大鼠MLI 显著增加,MAN 显著降低(均P <0.01);与模型组比较,OPC 低、高剂量组与DXM组MLI 显著降低,MAN 显著增加(P <0.05 或P <0.01),且各治疗组间比较,差异无统计学意义(P >0.05)。
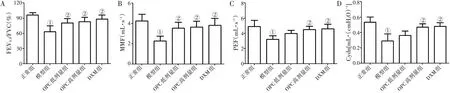
图1 各组大鼠肺功能指标FEV0.3/FVC(A)、MMF(B)、PEF(C)、Cydn(D)值比较Figure 1 Comparison of FEV0.3/FVC(A),MMF(B),PEF(C)and Cydn(D)values in various groups
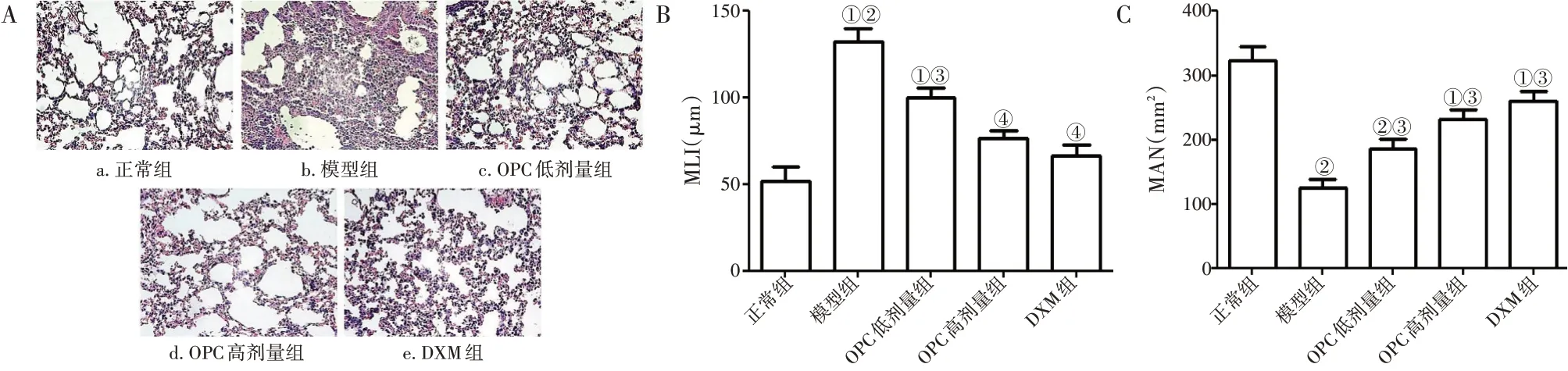
图2 各组大鼠肺气肿指标比较Figure 2 Comparison of rat emphysema lung indexes in various groups
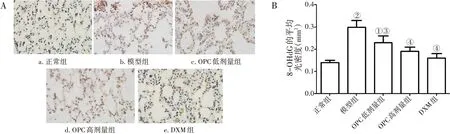
图3 各组大鼠肺组织中8-OHdG表达比较Figure 3 Comparison of the expression level of 8-OHdG in lung tissue of various groups
2.3 OPC减轻COPD大鼠的氧化应激图3 结果显示:与正常组比较,模型组大鼠肺组织8-OHdG平均光密度显著升高(P <0.01)。与模型组比较,OPC 低、高剂量组与DXM 组大鼠肺组织8-OHdG平均光密度显著降低(P <0.05 或P <0.01),且各治疗组之间比较,差异无统计学意义(P >0.05)。图4结果显示:与正常组比较,模型组大鼠肺组织MDA 水平升高,GSH 水平降低(均P <0.01);与模型组比较,OPC 低、高剂量组与DXM 组大鼠肺组织MDA 水平降低,GSH 水平升高(均P <0.01),且治疗组间比较,差异无统计学意义(P >0.05)。
2.4 OPC激活Nrf2及其下游蛋白HO1和NQO1表达并拮抗氧化应激图5 结果显示: 与正常组比较,模型组大鼠肺组织Nrf2 的细胞质、核和全细胞裂解物蛋白表达(分别为n-Nrf2、c-Nrf2 和t-Nrf2)、HO1 和NQO1 的表达水平显著降低(P <0.01 或P <0.001)。与模型组比较,OPC 低、高剂量 组 与DXM 组n-Nrf2、c-Nrf2、t-Nrf2、HO1、NQO1 的表达水平显著升高(P <0.05 或P <0.01 或P <0.001)。

图4 各组肺组织匀浆中MDA(A)、GSH(B)水平比较Figure 4 Comparison of the levels of MDA and GSH in lung homogenate of various groups

图5 各组大鼠肺组织Nrf2活化及其下游蛋白HO1、NQO1表达的比较Figure 5 Comparison of Nrf2 activation and its downstream protein HO1,NQO1 expression in lung tissue of various groups
3 讨论
慢性阻塞性肺疾病(COPD)的发病机制非常复杂,目前仍不完全清楚,但它与氧化应激、蛋白酶-抗蛋白酶失衡和炎症反应有关。LPS 和香烟烟雾已成为研究COPD 的首选刺激物[13]。吸烟是造成COPD 的最重要因素,主要表现为小气道疾病和肺气肿。香烟烟雾中含有大量的氧化剂和有毒物质,可引起慢性炎症,其被认为是导致COPD 发生和发展的关键机制。LPS是空气污染物中革兰氏阴性菌细胞壁的一个组成部分。细菌侵入生物体后,其细胞壁的LPS触发单核细胞、巨噬细胞释放炎性因子,在气道和肺组织中诱发炎症反应。本研究采用吸入烟雾和气管内滴注LPS的方法建立大鼠COPD 模型,结果显示模型组大鼠的FEV0.3/FVC、MMF、PEF、Cydn 水平较正常组均显著降低,并可见肺组织受到严重损害,存在支气管黏膜上皮细胞坏死和变性,肺泡间隙浆液性渗出,支气管壁炎性细胞浸润和肺气肿,MLI较正常组增加,MAN 较正常组降低,与临床观察到的COPD症状相似,表明采用吸入烟雾和气管内滴注LPS的方法可成功建立COPD大鼠模型。
Nrf2 是调控细胞氧化应激反应的重要转录因子。Nrf2及其下游目标抗氧化剂基因的功能已被证明对于细胞抗氧化剂损伤具有非常重要的作用[14]。Nrf2信号通路被认为在香烟烟雾引起的肺气肿中起关键作用。暴露于香烟烟雾中的Nrf2 缺陷小鼠表现出较早发作和更严重的肺气肿[15]。体内和体外接触香烟烟雾后,Nrf2 表达均增强,这意味着Nrf2有助于维持健康适应性[16]。然而,COPD 患者肺实质细胞和肺泡巨噬细胞中的Nrf2 均下调,这可能是COPD 患者体内稳态失衡的原因[17]。本研究结果显示,香烟烟雾和LPS 联合诱导下调COPD 大鼠肺组织Nrf2 蛋白的表达、减少Nrf2 分子的核进入,同时下调Nrf2 转录调控的抗氧化酶HO1 和解毒酶NQO1 的表达,并增加氧化应激诱导的DNA 损伤标志物8-OHdG 和脂质过氧化标志物MDA 水平,以及降低大鼠肺组织的抗氧化应激标志物GSH 活性。这些数据与既往研究[13]一致,表明Nrf2下调在介导香烟烟雾和LPS诱导的肺细胞氧化应激甚至肺气肿的发生中具有驱动作用。
在本研究中,我们首先观察了寡聚原花色素(OPC)对香烟烟雾和LPS 引起肺气肿的潜在作用,结果表明,OPC 干预可有效改善COPD 大鼠的肺功能,明显缓解肺气肿症状,且高剂量OPC 疗效与地塞米松相当。本研究结果还表明,以低、高剂量OPC干预后均可上调COPD大鼠肺组织Nrf2蛋白的表达,增加Nrf2 的核进入,并增强抗氧化酶HO1和解毒酶NQO1的转录调控。同时,不同剂量的OPC 能够下调氧化应激诱导的DNA 损伤标志物8-OHdG 与脂质过氧化标志物MDA 水平,这与肺气肿的缓解程度有关。因此,推测OPC 可能通过激活肺组织Nrf2,上调HO1、NQO1的表达,减轻香烟烟雾和LPS 诱导的COPD 氧化应激。值得注意的是,本研究发现,模型组大鼠肺组织中不仅Nrf2的核移位下调,而且胞质Nrf2 的表达也下调,这种现象可以解释为香烟烟雾和LPS 所致COPD 大鼠肺细胞Nrf2 的不稳定性,OPC 的作用可能是通过稳定肺细胞Nrf2分子来维持机体在克服吸烟和LPS慢性暴露中的健康适应。
综上所述,OPC 治疗可有效缓解大鼠COPD,其机制可能是通过激活Nrf2 缓解氧化应激反应,从而减轻香烟烟雾和LPS 诱发的COPD 大鼠的肺气肿症状。
