羟基磷灰石的制备及对Pb2+的选择性吸附
2021-01-21秦冬玲
李 丹,秦冬玲,杨 刚
(南京工业大学 材料化学工程国家重点实验室,江苏 南京 211800)
近年来,随着冶炼、电解电镀、医药、染料、蓄电池生产及机械制造、有色金属加工等产业的快速发展,产生了大量含重金属离子的废水[1-2]。在重点监测的重金属污染企业中,约40%的企业存在铅污染[2-3]。由于重金属污染物难降解,一旦排放进入环境中就会造成永久性污染,不但对土壤和水体中的微生物有很大危害,而且会通过食物链的逐级累积,危害人类身体健康。传统重金属废水处理方法主要有吸附法、化学沉淀法、离子交换树脂法、反渗透法、膜分离法以及萃取法等,其中吸附法因操作简单、成本较低、处理效果好而得到广泛应用[3-4]。
羟基磷灰石(Ca10(PO4)6(OH)2,HAP)为人体骨骼和牙齿的主要无机成分,属于六方晶系离子晶体[5-6]。Kawasaki等[7]提出HAP表面有两种钙离子(Ca(Ⅰ)和Ca(Ⅱ)),两者的摩尔比为2∶3,两种钙环境对应两种吸附位置,当HAP在水溶液中时,位于HAP晶体表面的Ca在某一瞬间会形成空缺,由于Ca(Ⅰ)与6个带负电荷的O原子相连,而Ca(Ⅱ)与3个带负电荷的O原子相连,使得Ca的位置易被与Ca2+具有相似性质的阳离子取代,从而使HAP具有较好的吸附效果。
以传统的共沉淀法制备的HAP虽然结晶度较高,晶型较为规整,但粒径较大,吸附量较低。以葡萄糖的碱性溶液为反应介质,葡萄糖分子在水中以分子间氢键聚集形成笼型,可以减小反应产物的粒径,控制反应产物的形状,在室温条件下可得到粒径较小的HAP[8-9],该反应介质在制备纳米粒子的过程中被广泛应用。粒径较小的HAP比表面积较大,可增大与污染物的接触面积,同时使用葡萄糖的碱性溶液为反应介质也改变了HAP颗粒的形状,使得暴露在晶体表面的Ca更多,从而增强其吸附能力。
笔者以CaCl2和(NH4)2HPO4为原料(Ca与P摩尔比为1.67)、以葡萄糖碱性溶液为反应介质,制备粒径较小的HAP,并考察HAP对Pb2+的选择性吸附性能。
1 实验
1.1 主要原料及仪器
1) 原料 CaCl2·H2O、(NH4)2HPO4、无水葡萄糖,分析纯(AR),国药集团化学试剂有限公司;(CH3COO)2Pb·3H2O,AR,上海凌恩科技有限公司;Cd(NO3)2·4H2O,AR,麦克林化学试剂有限公司;氨水、无水乙醇,AR,上海凌峰化学试剂有限公司。
2) 仪器 DF-101S型集热式恒温磁力搅拌器,巩义市予华仪器有限公司;MP 521型pH/电导率仪,上海三信仪表厂;DZF-6020型真空干燥箱,上海一恒科学仪器有限公司;S-4800型扫描电子显微镜(SEM),日本Hitachi公司;Miniflex600型X线衍射仪(XRD),日本Rigaku公司;2020型N2物理吸附仪,美国Micromeritics公司;PE optima 7000DV型电感耦合等离子体光谱仪(ICP-AES),美国PerkinElmer公司;ZS90型纳米粒度测定仪,美国Micromeritics公司;SA3-3-310型陶瓷纤维马弗炉,杭州卓驰仪器有限公司;DHG-9053A型台式鼓风干燥箱,上海精宏实验设备有限公司。
1.2 样品的制备
分别配制100 mL 0.1 mol/L的CaCl2溶液、100 mL 0.06 mol/L的(NH4)2HPO4溶液(Ca与P摩尔比为1.67);配制200 mL 0.2 g/mL的葡萄糖溶液,并用1 mol/L的NaOH调节pH为11;将配制的100 mL(NH4)2HPO4溶液和100 mL CaCl2溶液混合,用盐酸(0.1 mol/L)调节pH为3.5,用分液漏斗将上述混合溶液缓慢滴入30 ℃碱性葡萄糖溶液中,滴加完毕后,持续搅拌40 min,陈化24 h,过滤后分别用去离子水和乙醇各洗涤3次,在60 ℃真空干燥箱中干燥12 h后研磨,得到HAP,标记为样品A。将样品A在600 ℃ 马弗炉中煅烧2 h,得到样品B。
1.3 样品的表征
采用X线衍射仪(XRD)、扫描电子显微镜(SEM)和纳米粒度测定仪对样品的结构、形貌和粒径分别进行表征。
1.4 吸附性能测试
分别向烧杯中加入200 mL模拟Pb2+废水、Pb2+和Cd2+混合废水,称取0.02 g HAP样品置于烧杯中,在搅拌的同时开始计时,每隔10 min取一次样,每次取样2 mL,用电感耦合等离子体光谱仪测定吸附前后模拟废水溶液中金属离子的浓度,并根据式(1)计算样品的吸附量。
(1)
式中:q为吸附量,mg/g;ρ0为金属离子溶液的初始质量浓度,mg/L;ρ为吸附后金属离子溶液的质量浓度,mg/L;V为金属离子溶液的体积,L;m为吸附剂的质量,g。
2 结果与讨论
2.1 XRD分析
图1为HAP样品吸附前后的XRD图谱。由图1可知:未煅烧的HAP样品(样品A)只在33°处出现一个馒头峰,样品结晶度较差,晶型不规整,构象复杂;而煅烧后的HAP样品(样品B)与标准的PDF卡片进行比对,吻合度较高,结晶度较高,表明样品A在煅烧的过程中经历了重结晶的过程[8-9]。由样品A吸附后产物的XRD图谱可知其产物为结晶度较好的铅羟基磷灰石。由吸附前后样品的结构发生变化可知,样品在吸附过程中发生了溶解-沉淀的过程[10-11]。

图1 样品吸附前后的XRD图谱Fig.1 XRD patterns of samples before and after adsorption
2.2 SEM分析
样品A吸附前后的SEM照片如图2所示。由图2可以看出:吸附前样品A呈细小、均匀的球形颗粒状,无其他形状的杂质,表明该方法成功制备了新型的球形HAP颗粒;吸附后样品的形状主要为棒状,表面分布着细小的颗粒状物质。结合图1可知,吸附后形成的物质为结晶度较好铅羟基磷灰石[12-13]。

图2 样品A吸附前后的SEM照片Fig.2 SEM images of sample A before and after adsorption
2.3 粒径分析
图3为样品A粒径分布曲线。由图3可见:样品A颗粒分布范围较窄,分布较为均匀,粒径主要为220 nm左右。由此可知,在较为温和的环境下,以葡萄糖溶液作为反应介质,通过共沉淀法[14-15]成功制得了球形颗粒状的HAP样品,且其粒径分布较为均匀,这与SEM表征的样品形貌相吻合,与文献[9]报道的较为一致。

图3 样品A粒径的体积分布曲线Fig.3 Particle volume distribution of sample A
2.4 N2吸附-脱附曲线分析
图4为样品A的N2吸附-脱附等温线。由图4可知:样品A的吸附-脱附等温线为IV型,并且在脱附和吸附等温线之间存在1个明显的滞后环,说明样品A具有介孔结构以及相对较窄的孔径分布[16-18]。

图4 样品A的N2吸附-脱附曲线Fig.4 Adsorption-desorption curves of nitrogen of sample A
由BET方程计算得到样品A的比表面积为113.536 m2/g,比以纯水为反应介质制得样品的比表面积(45 m2/g)[9]大得多。表明该方法制备的样品增大了吸附剂的比表面积。由BJH方程计算得到样品A的孔体积为0.55 cm3/g,平均孔径为17.84 nm,这些数据均证明本文方法制备的吸附剂有利于吸附反应的进行。
2.5 煅烧对吸附效果的影响
由样品在煅烧前后的XRD图谱可知样品在煅烧前结晶度较差,煅烧后结晶度较好。在相同吸附条件下,由煅烧前后的样品对相同浓度的模拟Pb2+废水(Pb2+质量浓度为140.3 mg/L)的吸附量(图5)可知:煅烧后的样品吸附量较低。这可能是因为结晶度较高的样品晶体结构较为稳固[19-21],晶体表面暴露的Ca2+较少,形成的Ca2+的空缺较少,吸附位置较少,所以吸附量较低。因此,本实验选择未煅烧的样品A作为吸附剂来探究HAP对含Pb2+废水的吸附效果以及在含Pb2+和Cd2+混合废水中对Pb2+的吸附选择性。

图5 煅烧对吸附量的影响Fig.5 Effects of calcination on adsorption capacity
2.6 pH对吸附Pb2+的影响
在模拟Pb2+废水为200 mL、吸附剂HAP用量为0.1 g/L、温度为30 ℃、Pb2+初始质量浓度为140.3 mg/L的条件下,pH对吸附Pb2+的影响结果见图6。由于在溶液pH<3时,HAP会溶解,影响吸附过程的进行;而当溶液pH>6时,在配制溶液时,会出现金属离子的氢氧化物沉淀,不利于吸附过程测试。因此,选择pH为3~6的范围对吸附性能进行测试。由图6可以看出:随着pH增大,样品对Pb2+的吸附率呈先增加后平稳的态势,且吸附率均大于90%。在pH较低的条件下,溶液中H+会与Pb2+发生竞争,占据吸附位点;随着pH增大,H+竞争吸附减弱,有利于Pb2+吸附的进行。因此,吸附实验适宜的pH为6。
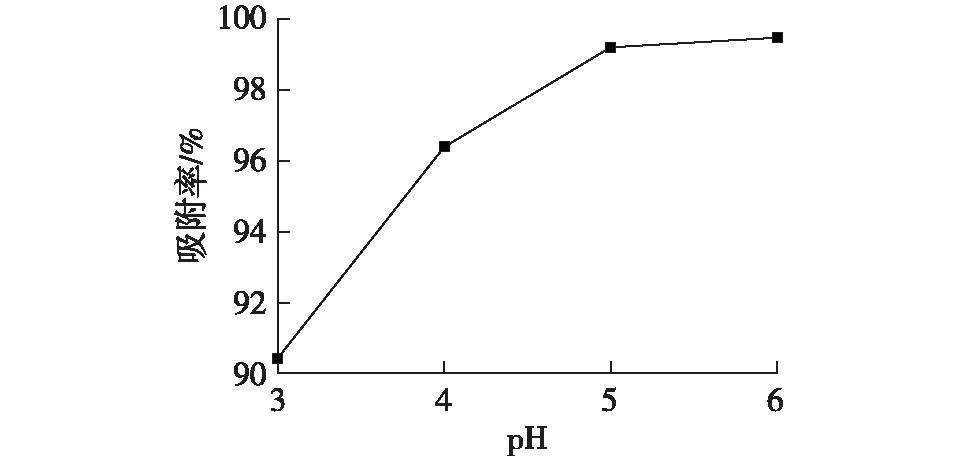
图6 pH对吸附Pb2+的影响Fig.6 Effects of pH on adsorption of Pb2+
2.7 吸附时间对吸附效果的影响
在模拟Pb2+废水为200 mL、吸附剂HAP用量为0.1 g/L、pH=6、温度为30 ℃、Pb2+初始质量浓度为140.3 mg/L的条件下,吸附时间对吸附效果的影响结果见图7。由图7可知:随着吸附时间的延长,吸附量逐渐增加,在吸附10 min左右时,吸附基本达到平衡(饱和吸附量达到1 412 mg/g左右);在吸附60 min后吸附量基本保持不变。由于在吸附刚开始时,吸附位点较多,Pb2+迅速占据吸附位点,随着吸附时间的延长,吸附位点逐渐减少,吸附逐渐达到平衡。
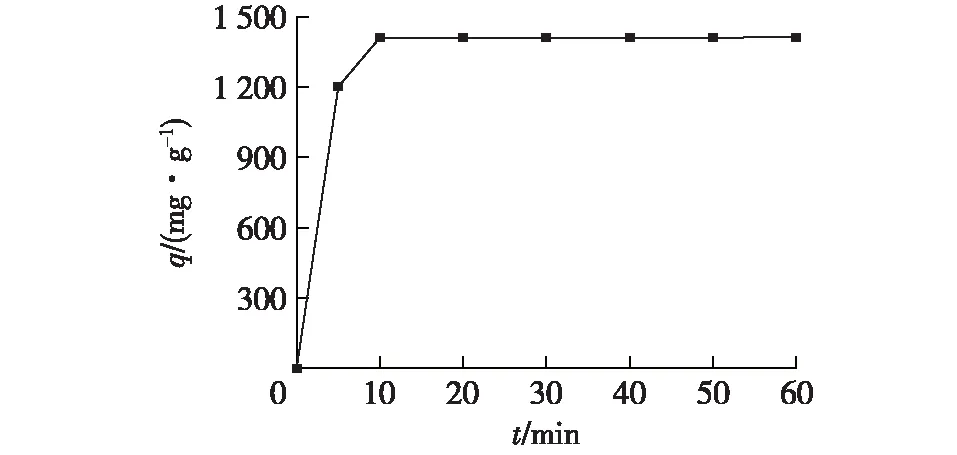
图7 不同时间的吸附量Fig.7 Adsorption capacity at different time
2.8 吸附选择性分析
在模拟Pb2+和Cd2+混合废水为200 mL、吸附剂HAP用量为0.1 g/L、pH=6、温度为30 ℃、Pb2+初始质量浓度为70.8 mg/L、Cd2+初始质量浓度为83 mg/L的条件下,HAP对Pb2+和Cd2+的吸附量见图8。由图8可以看出:HAP在Pb2+和Cd2+混合废水中,对Pb2+具有较高的吸附量,吸附速率较大,能较快达到吸附平衡;而对Cd2+的吸附量相对较低。其原因可能是水合离子半径越小,离子的水合能越低,越易脱除水分子被吸附剂所吸附。Pb2+水合离子半径(0.401 nm)比Cd2+的(0.426 nm)小,因此HAP对Pb2+的吸附量远大于Cd2+。HAP对Pb2和Cd2+混合溶液的吸附选择性参数见表1。由表1可知:HAP对Pb2+和Cd2+混合废水中的Pb2+和Cd2+这两种离子的识别能力显著不同,HAP对Pb2+的吸附量是对Cd2+吸附量的2.26倍;HAP对Pb2+的选择性系数高达1 961.73,远远高于文献[8]中报道的值。

图8 HAP在Pb2+和Cd2+混合溶液中Pb2+、Cd2+的吸附量Fig.8 Adsorption capacity of HAP to Pb2+ and Cd2+ in Pb2+/Cd2+ mixed solution

表1 HAP对Pb2+和Cd2+混合溶液中Pb2+、Cd2+的吸附选择性参数
3 结论
1) 本文制备的未煅烧的HAP(样品A)在吸附前为分布均匀的球形颗粒,其吸附后形成了棒状的结晶度较高的铅羟基磷灰石;样品A粒径分布均匀,主要在220 nm左右,具有较窄的孔径分布,BET比表面积为113.536 m2/g。
2) 煅烧后的HAP(样品B)结晶度较好,未煅烧的样品A结晶度较差,构象复杂。两者在相同条件下对Pb2+进行吸附,未煅烧的样品A吸附效果较好。因此,本文选择未煅烧的样品作为实验的吸附剂。
3) 在Pb2+初始质量浓度为140.3 mg/L、HAP用量为0.1 g/L的条件下,通过实验优化样品A的最佳吸附条件为pH=6、温度30 ℃、吸附时间60 min。在该条件下,HAP对Pb2+的饱和吸附量达到1 412 mg/g左右。
4) 在pH=6、温度30 ℃、HAP用量为0.1 g/L、吸附时间为60 min的条件下,在Pb2+和Cd2+混合溶液(Pb2+初始质量浓度为70.8 mg/L,Cd2+初始质量浓度为83 mg/L)中,HAP对Pb2+的吸附量是Cd2+吸附量的2.26倍,对Pb2+的选择性系数达到1 961.73。
