控制营养状态评分和血小板/淋巴细胞比值与腹膜透析患者左心室肥厚的关系
2021-01-21权钰迪周巧冯锦红张颖
权钰迪 周巧 冯锦红 张颖
221000 徐州,徐州医科大学(权钰迪,周巧);徐州医科大学附属医院肾脏内科(冯锦红,张颖)
目前慢性肾脏病(chronic kidney disease,CKD)在我国普通人群中的患病率达10.8%[1]。目前,腹膜透析(peritoneal dialysis,PD)成为更多终末期肾脏病(end-stage renal disease,ESRD)患者的选择。因长期的透析治疗,PD患者普遍存在微炎症状态及营养不良,与心血管疾病(cardiovascular diseases,CVD)发生紧密相关[2]。CVD是导致透析患者死亡的首要原因,占全因死亡的40%~50%[3],其中左心室肥厚(left ventricular hypertrophy,LVH)是CKD患者最常见的心血管改变,也是ESRD患者心血管事件死亡和全因死亡的独立危险因素。血小板/淋巴细胞比值(platelet to lymphocyte ratio,PLR)可以反映腹膜透析患者的炎症状态[4]。控制营养状态评分(controlling nutritional status,CONUT)对心脑血管疾病、恶性肿瘤术后患者的预后价值已有研究[5-6],国内尚无研究COUNT评分与PD患者LVH的关系。本文旨在使用CONUT评分和PLR评估PD析患者营养状态及炎症水平,并研究其与LVH的关系。
资料与方法
一、病例资料
收集2019年1月至2020年5月在徐州医科大学附属医院肾内科接受PD治疗的患者临床资料。纳入标准:年龄≥18岁,规律PD至少3个月以上。排除标准:患有严重感染、恶性肿瘤(例如乳腺癌、肺癌、胃肠道肿瘤、血小板等)、妊娠、先天性心脏病、心肌病或数据丢失的患者。
二、方法
1.资料收集 (1)一般特征:患者年龄、性别、身高、体质量、体质量指数(body mass index,BMI)(kg/m2)=体重(kg)/身高2(m2)、透析龄、并发症、血压。实验室指标:使用血常规分析仪测定血红蛋白、淋巴细胞计数、血小板计数、红细胞分布宽度(red blood cell distribution width,RDW);使用全血生化分析仪空腹静脉采血测定血清白蛋白、尿素氮、尿酸、三酯甘油、胆固醇、血磷、血钙;采用酶联免疫(ELISA)方法检测超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)含量。PLR由绝对血小板计数除以绝对淋巴细胞计数以获得。血压测量:根据2019年美国心脏协会血压测量标准:静息5 min后,采用标准水银柱血压计测定患者上肢血压,间隔2 min重复测量,取2次均值。
CONUT包括血清白蛋白(分为≥35 g/L,30~34.9 g/L,25~29 g/L和<25 g/L四个等级,分别记0,2,4和6分)、外周血淋巴细胞计数(分为>1 600个/mm3,1 200~1 599个/mm3,800~1199个/mm3和<800个/mm3,分别记0,1,2和3分)和总胆固醇(分为>180 mg/dL,140~180 mg/dL,100~139 mg/dL和<100 mg/dL,分别记0,1,2和3分)。CONUT评分的总分为三者相加,0~1分为正常,2~4分为轻度营养不良,5~8分为中度营养不良,9~12分为重度营养不良。
2.心脏超声 由本院心脏超声室医师使用彩色超声多普勒显像仪测量左心房前后径、左心室舒张末期内径(left ventricular end diastolic diameter,LVEDD)、左心室室壁厚度(left ventricular wall thickness,LVPWT)、室间隔厚度(interventricular ventricular septal thickness,IVST),左室射血分数(left ventricular ejection fraction,LVEF)。根据《亚洲高血压合并左心室肥厚诊治专家共识》[7]计算左心室质量(left ventricular mass,LVM)及左心室质量指数(LVMI)、左心室心肌质量(LVM,g)=0.8×1.04×[(LVEDD+IVST+LVPWT)—LVEDD3]+0.6;体表面积(body surface area,BSA,m2)=0.0057×身高(cm)+ 0.0121×体重(kg)+ 0.0882(男性);BSA(m2)=0.0073×身高(cm)+ 0.0127×体重(kg)-0.2106(女性);LVMI(g/m2)=LVM/BSA。LVH定义为LVM:男性≥115 g /m3、女性≥95 g/m3。
三、分组
根据患者是否存在LVH,分为LVH组和非LVH组。
四、统计学方法
采用SPSS 22.0对数据进行统计分析。计量资料经正态性检验,符合正态分布的资料均采用Mean±SD表示,两组间比较采用独立样本t检验。不符合正态分布的资料均采用中位数(四分位数)表示,两组间比较采用Mann-Whitney U检验。分类资料均采用例数(百分比)表示,组间比较采用χ2检验。采用Logistic回归分析筛选影响患者LVH的因素。采用ROC曲线分析各指标对LVH的诊断价值。检验水准均为P<0.05有统计学意义。
结 果
一、本研究人群的临床特征
本研究共有82例患者,其中合并高血压的患者有80例(97.6%),合并糖尿病患者5例(6.1%),男性38例(46.3%),女性44例(53.7%),年龄(45.3±12.7)岁,平均透析龄18.00(8.00,31.75)个月,PLR为(156.33±53.09),CONUT评分为(2.85±1.89),LVMI为(112.28±26.56)g /m3。(表1)
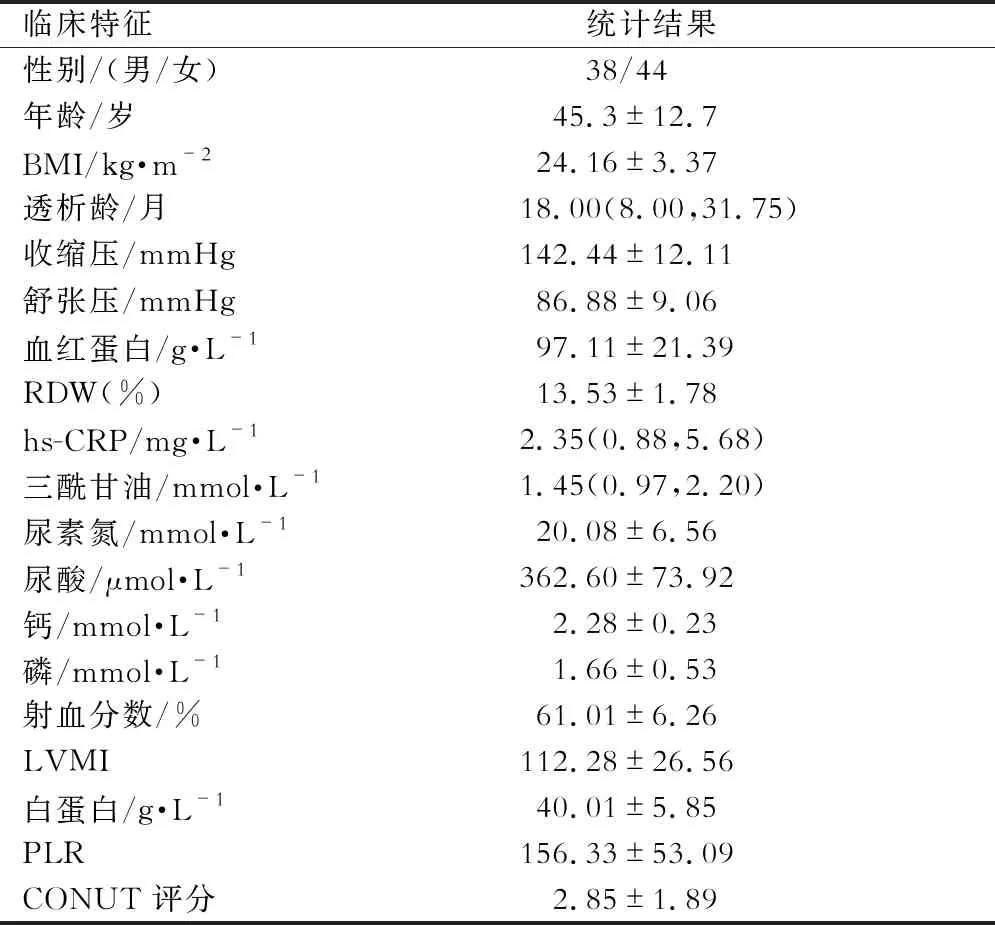
表1 研究人群临床特征
二、LVH组和非LVH组的临床数据比较
本研究中PD患者LVH的发生率为40.2%。其中非LVH组49例,男性24例(49%),女性25例(51%),平均年龄(46.4±12.5)岁,平均透析龄18(10.00,39.00)个月;LVH组33例,男性20例(60.6%),女性13例(39.4%),平均年龄(43.8±12.9)岁,平均透析龄18(7.00,30.50)个月。LVH组收缩压、尿酸、hs-CRP、PLR、CONUT评分均高于非LVH组,而血红蛋白、LVEF、白蛋白均低于非LVH组,差异均有统计学意义(P<0.05)。(表2)

表2 LVH组和非LVH组的临床特征比较
三、PD患者发生LVH的Logistic回归分析
以左心室是否肥厚为因变量,以单因素分析中有统计学意义的指标(包括收缩压、hs-CRP、尿酸、PLR、CONUT评分、血红蛋白、LVEF)为自变量,采用条件法建立二元Logistic回归模型。结果显示,收缩压、PLR、CONUT评分在模型中差异均有统计学意义(P<0.05),与LVH具有正相关(β分别为0.053,0.017,1.650)。收缩压、CONUT评分、PLR均为PD患者发生LVH的危险因素。(表3)

表3 影响LVH的Logistic回归分析
四、ROC曲线分析PLR、CONUT对LVH发生的预测能力
由ROC曲线可知,PLR、CONUT评分、PLR+CONUT诊断LVH的曲线下面积(Area under the curve,AUC)分别为0.743(95%CI:0.636~0.851,P<0.001)、0.822(95%CI:0.728~0.917,P<0.001)、0.855(95%CI:0.769~0.941,P<0.001),各指标预测PD患者发生LVH的AUC均有统计学意义(P<0.05)。PLR对应截止点为168.64,灵敏度和特异度分别为54.5%、81.6%;CONUT评分对应截止点为3.5,灵敏度和特异度分别为57.6%、91.8%;PLR+CONUT评分对应截止点为0.3326,灵敏度和特异度分别为87.9%、75.5%。(表4、图1)

表4 ROC曲线分析PLR、CONUT对LVH发生的预测能力
讨 论
CKD患者中最常见和最严重的并发症是CVD,合并CVD不仅影响患者的生活质量,而且病死率远远高于普通人群[8],而LVH是CKD患者心血管疾病中最常见的心脏病理改变,也是心律失常、心力衰竭等多种心脑血管事件发生的重要危险因素,更有研究指出LVH是透析患者心血管事件和全因死亡的重要预测指标[9]。既往研究发现70%~90%的PD患者存在左室肥厚,本研究中PD患者LVH的发病率达40.2%,与既往研究比较,比例较低,可能是由于本研究样本量较少的原因。既往研究显示,导致PD患者发生LVH的原因有高血压、容量超负荷、贫血、营养不良、微炎症状态及矿物质代谢紊乱等[10]。本研究发现PD患者LVH组中贫血、高血压、高尿酸、微炎症状态、营养不良均较非LVH有明显的差异,其中当尿酸水平升高时,尿酸可能作为炎性介质,参与心室重构[11],在PD患者中目前尚未有研究表明尿酸与其PD发生相关;贫血与高血压不仅是透析患者发生LVH的主要病因之一,也是CVD发病率和病死率的独立危险因素[12]。Logistic回归分析提示收缩压、CONUT评分、PLR均为PD患者发生LVH的危险因素。血红蛋白的这种显著相关性未能在本研究中的回归模型中得到证实,这可能是由于本研究为单中心和横断面设计造成的,需扩大样本量。
近些年,CONUT评分在预测恶性肿瘤和CVD的预后中显现出其价值[5-6]。据报道CKD患者的营养不良发生率高达 18%~56%,透析患者的营养不良发生率更高[13],本研究使用CONUT评分对PD患者进行营养评估,患有营养不良的PD患者比例高达73.2%。本文中营养正常的患者22例(26.8%),轻度营养不良患者43例(52.4%),中度营养不良患者17例(20.7%),无重度营养不良患者。在既往研究中,Zhou等[14]对PD患者心血管事件研究得出CONUT评分与LVEF和LVMI显著相关,营养不良的患者全因死亡率和CVD患病率明显升高。朱萍等在对20例PD患者低蛋白血症的研究中发现血清白蛋白水平越低,发生LVH的概率越高。本研究发现在LVH的PD患者中,伴有低血清白蛋白水平、高CONUT评分,其中CONUT评分是LVH的危险因素。
有研究显示炎症因子参与心肌重构[15],在维持性血液透析患者中,伴有LVH的患者CRP、IL-6水平显著升高。Yu等[16]对于发生LVH的高血压患者研究中发现,发生LVH的患者中性粒细胞/淋巴细胞比值及CRP明显高于非LVH的患者。hs-CRP、IL-6、TNF-α等常用来反映CKD患者的微炎症状态,因经济水平及检测技术在临床上的应用受到限制。PLR能够反映全身炎症状态[17],通过血常规即可获得,经济简便。近些年来研究显示,PLR参与瓣膜钙化、冠状动脉粥样硬化等CVD的发生发展[18-19]。在PD患者中,PLR与CRP等传统炎症标记物呈正相关,意味着PLR不仅能作为PD患者新的炎症指标,还可以反映出炎症的严重程度[20]。有研究表明PLR可作为PD患者CVD事件的独立预测指标[5],与PD患者病死率密切相关[21]。本研究发现,在发生LVH的PD患者中,CPR、PLR水平明显高于非LVH患者,而且PLR是LVH的危险因素。
本研究表明,CONUT评分和PLR可以用于评估PD患者的营养状态及炎症水平,是PD患者发生LVH的危险因素,联合作用可能诱导PD患者LVH发生。PLR和CONUT评分作为容易获得的指标,可以作为常规检测,以减少PD患者LVH的发生。该研究具有一定的局限性,因为该研究是单中心,小样本的研究,需要在多中心,大样本的研究中确认结论。
