miR-129-5p通过BDNF调控多发性骨髓瘤细胞增殖及分泌的机制
2021-01-21刘小敏张肄鹏王素云宋锦旗
刘小敏,张肄鹏,王素云,宋锦旗
(深圳市龙华区中心医院医学检验科,深圳 518110)
多发性骨髓瘤(multiple myeloma,MM)是最常见的血液肿瘤之一,由浆细胞的异常增殖引起[1]。发病机制涉及染色体易位,细胞因子失调,骨髓微环境变化等[2],恶化的MM往往伴随着炎性因子(如IL-6、TNF-α、IL-1β等)及血管内皮生长因子(VEGF)分泌的增加[3]。尽管近年来对MM的诊断和治疗水平已大大提高,但MM患者的预后仍然不理想[4]。因此,我们急需发现并确定一些新的、确切的、可用于靶向治疗的指标来预测MM的预后。
miRNA通过抑制靶标的转录或降解mRNA参与恶性肿瘤的发生和发展而发挥作用[5]。根据多项研究发现,miR-129-5p是一种与癌症相关的miRNA,在许多其他类型的癌症中低表达,例如直肠腺癌[6]、胃癌[7]、乳腺癌[8]、大肠癌[9]、肝癌[10]以及前列腺癌[11]。miR-129的低表达与肿瘤的分期和进展密切相关[12]。并且miR-129的抑制作用也可能促进肿瘤形成,例如,已有研究证明miR-129的减少可能会促进人肺癌细胞的增殖[13]。但是目前关于miR-129-5p在MM中的研究并不多见,因此,我们在本文中主要就miR-129可能在MM发生中的影响进行探讨。
前人研究发现大多数MM患者中分离出的恶性浆细胞能高度表达脑源性神经营养因子(BDNF),而BDNF被认为是一种MM源性因子,能促进骨髓瘤患者的骨溶解性破坏,并且能促进骨髓瘤细胞的生长和存活[14,15]。BDNF除了具有神经生成作用外,还是血管生成的介质,可促进内皮细胞的存活,诱导缺血组织中的新血管生成[16-18]。最近,有研究发现BDNF作为一种潜在的血管生成刺激因子,促进了MM肿瘤的进展,在此过程中可选择性激活特异性受体以及其下游信号的转导,并促进VEGF的释放[19]。然而,尚未有研究发现在多发性骨髓瘤细胞中BDNF可能受miR-129-5p调控。本项研究不仅报道了miR-129-5p在多发性骨髓瘤中的表达、临床意义和体外功能,还证明BDNF是MM细胞中miR-129-5p的下游靶标。
1 资料与方法
1.1 一般资料
收集2015年6月至2019年6月在我院血液肿瘤科确诊并进行治疗的多发性骨髓瘤(MM)患者骨髓组织56例,其中男性31例,女性25例。纳入和排除标准:①纳入对象骨髓组织均经我院确诊为MM骨髓组织,临床诊断均按照世界卫生组织MM标准进行诊断;②排除感染性疾病及其他血液系统疾病史;③排除合并其他原发恶性肿瘤;④排除有骨髓穿刺禁忌者以及孕妇。另收集同时期于我院进行骨髓穿刺并最后明确骨髓功能无异常的健康者骨髓组织56例作为正常对照。本研究获我院伦理委员会批准,且患者均签署知情同意书。
1.2 主要试剂及仪器
RPMI8226细胞系(ATCC),CO2恒温培养箱(Thermo Electron公司,美国),lipofectamine 2000试剂盒(Invitrogen,美国),转染序列(上海吉玛制药技术有限公司),MTT溶液(ApexBio,美国),酶标检测仪(BIO-TEK,美国),结晶紫染色剂(江苏碧云天公司),流式细胞仪(BD公司,美国),ELISA试剂盒(南京建成生物工程研究所),Trizol RNA提取试剂盒(Invitrogen,美国),PCR引物(北京康为世纪生物科技有限公司),反转录试剂盒(北京纽朴生物技术有限公司),ABI StepOnePlusTM实时荧光定量PCR仪(北京安麦格贸易有限公司),Uni-miR qPCR primer(TaKaRa,日本),BCA试剂盒(武汉博士德公司),聚丙烯酰胺凝胶(武汉博士德公司),一抗BDNF、VEGF、GAPDH(Abcam,英国),辣根过氧化物酶标记的二抗(Jackson Immuno Research,美国),荧光素酶检测试剂盒(BioVision,美国),Glomax20/20 luminometer荧光检测仪(Promega,美国)。
1.3 细胞培养与分组
RPMI8226细胞系培养于含10%胎牛血清的DMEM培养液中,并置于37 ℃、5%CO2及饱和湿度的培养箱中培养。当细胞融合率达80%左右时,用lipofectamine 2000试剂盒说明书进行转染:用250 μl不含血清的DMEM培养基稀释mimic-NC(miR-129-5p模拟物阴性对照)和miR-129-5p mimic(miR-129-5p模拟物),轻轻混匀后室温孵育5 min;另取250 μl不含血清DMEM培养基稀释5 μl lipofectamin 2000,轻轻混匀并室温孵育5 min;将以上两者混匀,室温孵育20 min加入至细胞培养孔中。培养6 h后弃去孔内含转染液的培养基,更换为含10%胎牛血清的DMEM培养液继续培养24 h,用于后续实验。将RPMI8226细胞分为空白组(无任何处理)、mimic-NC组和miR-129-5p mimic组。
1.4 MTT细胞增殖实验
将对数生长期的各组RPMI8226细胞以1×105/ml的密度按每孔1 ml接种于96孔细胞培养板,孵育24,48,72 h时,更换200 μl 10% FBS的DMEM,加入20 μl四甲基偶氮唑蓝(MTT)溶液(5 mg/ml),37 ℃继续孵育4 h,弃去上清液,每孔加入150 μl的DMSO,摇床低速振荡10 min,用酶标检测仪于490 nm波长处检测吸光度OD值,记录结果。
1.5 平板克隆实验
将对数生长期的各组RPMI8226细胞以每皿500个的密度分别接种6孔板中,细胞轻轻混匀后于培养箱中培养14 d,当培养皿中出现肉眼可见的克隆时终止培养,弃去上清液,用PBS浸洗2次后加入5 ml的4%多聚甲醛固定15 min,去固定液,加适量结晶紫染液染色10 min,自来水洗去染色液,自然干燥后拍照。显微镜下计数大于10个细胞的克隆数。
1.6 流式细胞术检测细胞周期及凋亡
收集各组RPMI8226细胞,PBS冲洗细胞后用预冷的75%乙醇重悬细胞,在-20 ℃下固定过夜,离心弃去上清液,PBS冲洗细胞,取450 μl PBS重悬的细胞,加入100 μl的Rnase A于37 ℃水浴30 min,再加入400 μl的碘化丙锭(PI)染色混匀,4 ℃避光染色30 min后用流式细胞仪测量细胞周期分布并分析。
收集各组RPMI8226细胞,PBS溶液洗涤后分别加入预冷的100 μl 1×binding buffer重悬细胞,并依次加入5 μl膜联蛋白与5 μl PI,混匀后室温避光15 min,流式细胞仪检测细胞凋亡。结果判定标准:以膜联蛋白Ⅴ为横轴,PI为纵轴;左上象限为机械性损伤细胞;右上象限为晚期凋亡细胞或者坏死细胞;左下象限为阴性正常细胞;右下象限为早期凋亡细胞。
1.7 ELISA实验检测相关因子
取各组对数期RPMI8226细胞以1×106/ml接种于6孔板,分别提取上清液以双抗夹心法试剂盒检测各组细胞上清液中IL-6、TNF-α、IL-1β及VEGF的水平。
1.8 RT-qPCR实验检测miR-129-5p及BDNF表达
采用Trizol试剂盒法对组织与RPMI8226细胞总RNA进行提取,并用反转录试剂盒反转录得到cDNA。用实时荧光定量PCR仪行PCR实验,miR-129-5p以U6作为内参,BDNF以GAPDH作为内参,引物序列见表1。反应体系为20 μl,包括10 μl 2×SYBR Mix,10×cDNA模板1 μl,上下游引物各1 μl,H2O 8 μl,每个样品为3个重复,PCR扩增条件为:95 ℃预变性3 min,95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸2 min,35个循环,72 ℃再延伸10 min。产物经琼脂糖凝胶电泳验证。手动将阈值选定在各对数扩增曲线平行上升的最低点,获得各反应管的Ct值(threshold cycle),数据采用2-ΔΔCt法[20]进行基因相对定量表达分析。

表1 Q-PCR引物序列
1.9 Western blot实验检测BDNF及VEGF表达
提取组织与RPMI8226细胞总蛋白,按BCA试剂盒说明书测定蛋白浓度,将提取的蛋白加入上样缓冲液后在95 ℃煮10 min,每孔上样30 μg,10%聚丙烯酰胺凝胶电泳分离蛋白,电泳电压 80 V转100 V,湿转,转膜电压100 mV时间约60 min,PVDF转膜后5%脱脂牛奶室温封闭1 h,后加入一抗BDNF(1 ∶1 000)、VEGF(1 ∶1 000)、GAPDH(1 ∶2 000)4 ℃孵育过夜,经过清洗后置于辣根过氧化物酶标记的二抗(1 ∶5 000)室温孵育1 h,使用Odyssey双色红外荧光扫描成像系统获得图片,运用Quantity One图像分析软件测得条带灰度值,将各目的条带与内参条带比值后,比较各组间差异。
1.10 双荧光素酶报告实验验证miR-129-5p和BDNF的靶向关系
采用生物信息学网站件http://www.microrna.org/microrna/home.do预测miR-129-5p和BDNF的靶向关系及miR-129-5p与BDNF 3′UTR的结合位点。合成含miR-129-5p结合位点BDNF 3′UTR启动子区序列,构建BDNF 3′UTR野生型(WT)质粒(BDNF-WT)与BDNF 3′UTR突变型质粒(BDNF-MUT)。取对数生长期正常培养的RPMI8226细胞,经消化、接种、培养后将BDNF-WT或BDNF-MUT与mimic-NC或miR-129-5p mimic共转染进细胞,使用荧光素酶检测试剂盒与Glomax20/20 luminometer荧光检测仪检测荧光素酶活性并计算每个样本的相对活性值,分析数据。
1.11 统计学方法
所有数据采用SPSS 21.0(SPSS,Inc,Chicago,IL,USA)统计软件进行数据统计分析,计量资料用均值±标准差表示,服从正态分布的计量资料两组之间的比较采用独立样本t检验。多组之间的比较采用One-Way ANOVA单因素方差分析,ANOVA分析后的两两比较采用图基多重比较检验(Tukey’s multiple comparisons test)。通过卡方检验确定miR-129-5p的表达与多发性骨髓瘤临床病理特征的关系。Pearson分析miR-129-5p与BDNF的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 多发性骨髓瘤中miR-129-5p与BDNF的表达水平呈负相关
采用RT-qPCR及Western blot法检测miR-129-5p及BDNF在MM患者及健康者骨髓组织中的表达情况,结果表明:MM患者骨髓组织中miR-129-5p表达水平低于健康者,而BDNF的mRNA与蛋白水平都高于健康者,差异有统计学意义(均P<0.01,见图1)。
通过Pearson检验分析MM患者骨髓组织miR-129-5p与BDNF的相关性,发现miR-129-5p与BDNF呈负相关(r=-0.601,P<0.001,见图1)。
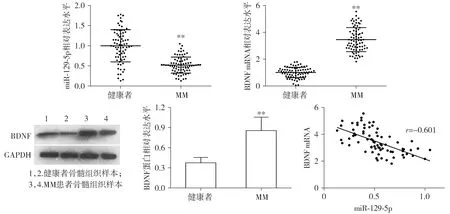
与健康者比较,**P<0.01图1 多发性骨髓瘤中miR-129-5p与BDNF的表达水平及相关性分析Figure 1 Correlation analysis of miR-129-5p and BDNF expression level in MM
2.2 过表达miR-129-5p能够显著抑制RPMI8226细胞增殖
采用RT-qPCR法检测过表达miR-129-5p后RPMI8226细胞转染效率,发现与mimic-NC组相比,miR-129-5p mimic组miR-129-5p表达水平显著上升(P<0.01,见图2),说明过表达miR-129-5p的RPMI8226细胞系建立成功。
MTT法和平板克隆实验结果显示,过表达miR-129-5p后RPMI8226细胞增殖水平与克隆形成能力都下降(均P<0.01,见图2),说明过表达miR-129-5p能抑制RPMI8226细胞增殖。
2.3 过表达miR-129-5p阻滞RPMI8226细胞周期进程并促进细胞凋亡
流式细胞术检测各组RPMI8226细胞的周期进程与凋亡率,结果表明:与mimic NC相比,过表达miR-129-5p导致RPMI8226细胞G0/G1期细胞比例上升,S期与G2/M期细胞比例下降(均P<0.05),凋亡率上升(P<0.01,见图3),说明过表达miR-129-5p能阻滞RPMI8226细胞周期进程,促进细胞凋亡。
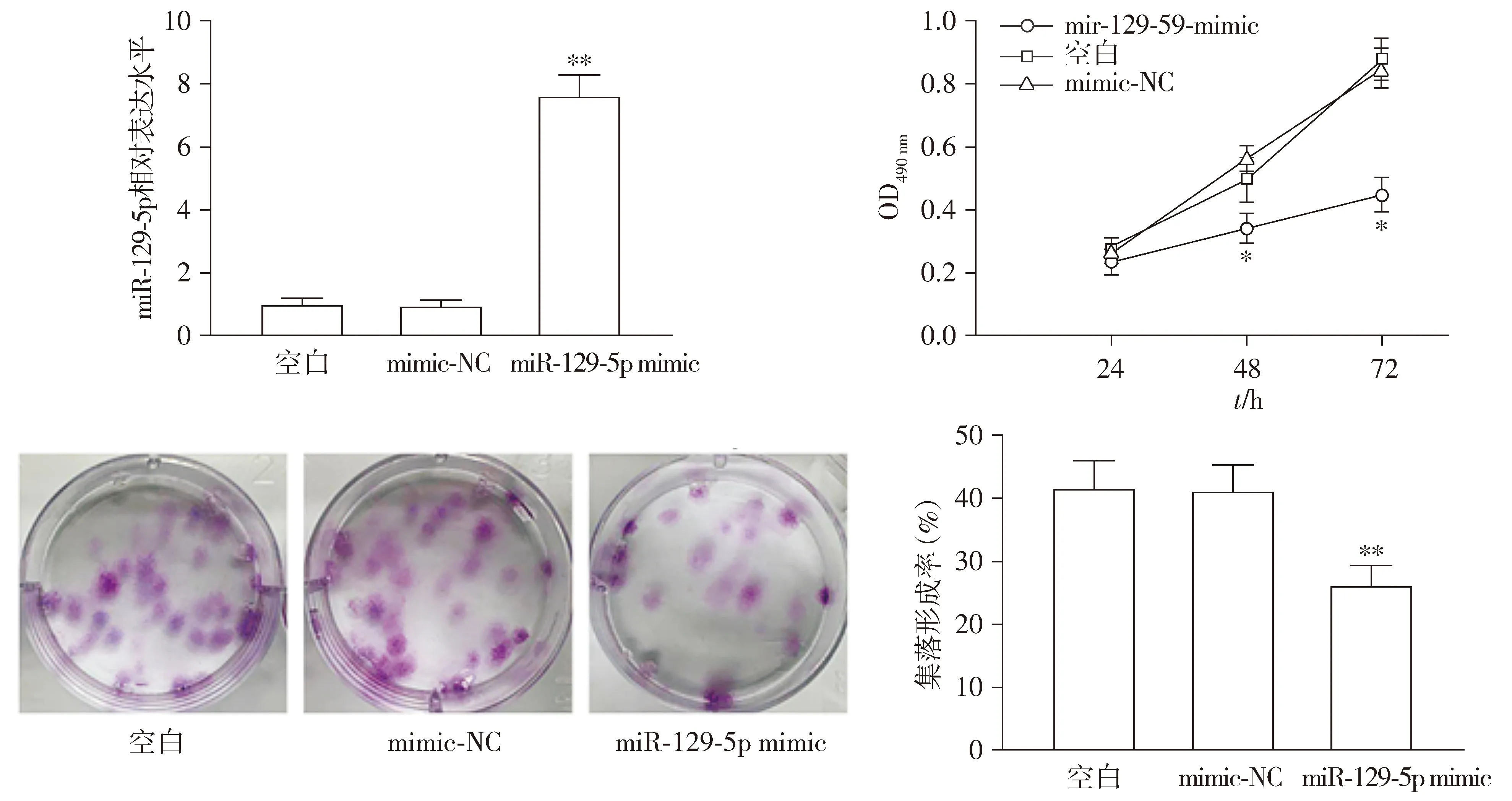
与mimic-NC组比较,*P<0.05,**P<0.01图2 过表达miR-129-5p抑制RPMI8226细胞增殖Figure 2 The miR-129-5p overexpression suppresses RPMI8226 cell proliferation
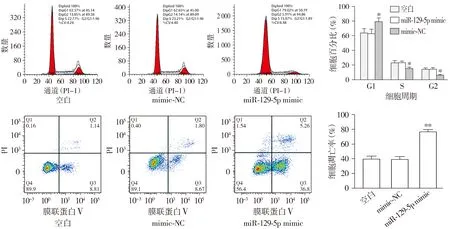
与mimic-NC组比较,*P<0.05,**P<0.01图3 过表达miR-129-5p阻滞RPMI8226细胞周期进程并促进细胞凋亡Figure 3 The miR-129-5p overexpression blocks cell cycle and promotes cell apoptosis
2.4 过表达miR-129-5p抑制RPMI8226细胞分泌IL-6、TNF-α、IL-1β
ELISA实验检测各组RPMI8226细胞上清液IL-6、TNF-α、IL-1β含量,研究结果发现:相对于mimic-NC,过表达miR-129-5p导致RPMI8226细胞中IL-6、TNF-α、IL-1β含量下降(均P<0.05,见表2),说明过表达miR-129-5p能抑制RPMI8226细胞分泌炎性因子。
表2 过表达miR-129-5p抑制RPMI8226细胞分泌
2.5 过表达miR-129-5p抑制RPMI8226细胞分泌VEGF
ELISA实验检测各组RPMI8226细胞上清液VEGF含量,Western blot法检测细胞中VEGF蛋白表达水平,发现与mimic-NC组相比,miR-129-5p mimic组上清液VEGF含量及细胞VEGF蛋白表达水平都下降(均P<0.05,见图4),说明过表达miR-129-5p能抑制RPMI8226细胞表达VEGF。

与mimic-NC组比较,*P<0.05,**P<0.01图4 过表达miR-129-5p抑制RPMI8226细胞分泌VEGFFigure 4 The miR-129-5p overexpression inhibits the level of VEGF in RPMI8226 cells
2.6 miR-129-5p靶向负调控BDNF
采用RT-qPCR及Western blot法检测过表达miR-129-5p后RPMI8226细胞中BDNF表达情况,结果表明:过表达miR-129-5p能下调BDNF的mRNA与蛋白水平(均P<0.01,见图5)。初步证明miR-129-5p能负调控BDNF。
生物学网站显示miR-129-5p与BDNF存在结合位点(见图5)。而通过双荧光素酶切报告实验发现miR-129-5p mimic+BDNF-WT组的荧光素酶信号与mimic-NC+BDNF-WT组相比显著下降(P<0.01),miR-129-5p mimic+BDNF-MUT组与mimic-NC+BDNF-MUT组的的荧光素酶信号无明显统计学差异(P>0.05,见图5),证明miR-129-5p能靶向性调控BDNF。
3 讨论
近年来,MM患者的发病率和死亡率越来越高,但是当前的治疗策略不佳[21],因此,我们迫切需要探索一些新的参与了MM中肿瘤细胞增殖和凋亡的实用分子候选物。据报道,越来越多的miRNA通过参与细胞增殖、凋亡、转移等而成为MM进展的调节因子[5]。例如,在MM中miR-20a[22],与miR-210[23]发生失调并充当肿瘤抑制因子或启动子,能调节MM细胞的进程和发育。但更引人注目的是,据报道,miR-129-5p可抑制多种癌症进展,其中包括直肠腺癌、胃癌、乳腺癌、大肠癌、肝癌以及前列腺癌[6-11]等。在本研究中,我们发现在MM骨髓组织中miR-129-5p表达下调。此外,体外研究表明miR-129-5p充当MM细胞中细胞增殖与IL-6、TNF-α、IL-1β及VEGF分泌的抑制剂,细胞凋亡的促进剂。这些发现表明,miR-129-5p是MM中的一种抗癌基因。
前人的研究已经证实,BDNF能促进骨髓瘤细胞的生长和存活,并保护细胞免受化学疗法的侵害[15,16]。并且已有研究发现MM患者中BDNF高表达,BDNF能刺激MM患者血管的形成[19]。在本项研究中,我们用生物信息学工具(microRNA.org)以及荧光素酶报告基因检测的数据证实miR-129-5p能够结合BDNF的3′UTR,而且我们发现,MM患者骨髓组织中miR-129-5p显著低表达,BDNF高表达,Pearson相关系数分析也表明miR-129-5p与BDNF之间存在负相关,miR-129-5p在MM细胞中对BDNF表达负调控。以上数据证明BDNF是MM中miR-129-5p的靶标,并且BDNF通过促进细胞增殖和抑制细胞凋亡而在MM中充当癌基因,这与以前的研究一致[14]。因此,我们证实在MM中miR-129-5p的下调导致BDNF的上调,从而促进MM的发展与IL-6、TNF-α、IL-1β及VEGF的分泌。
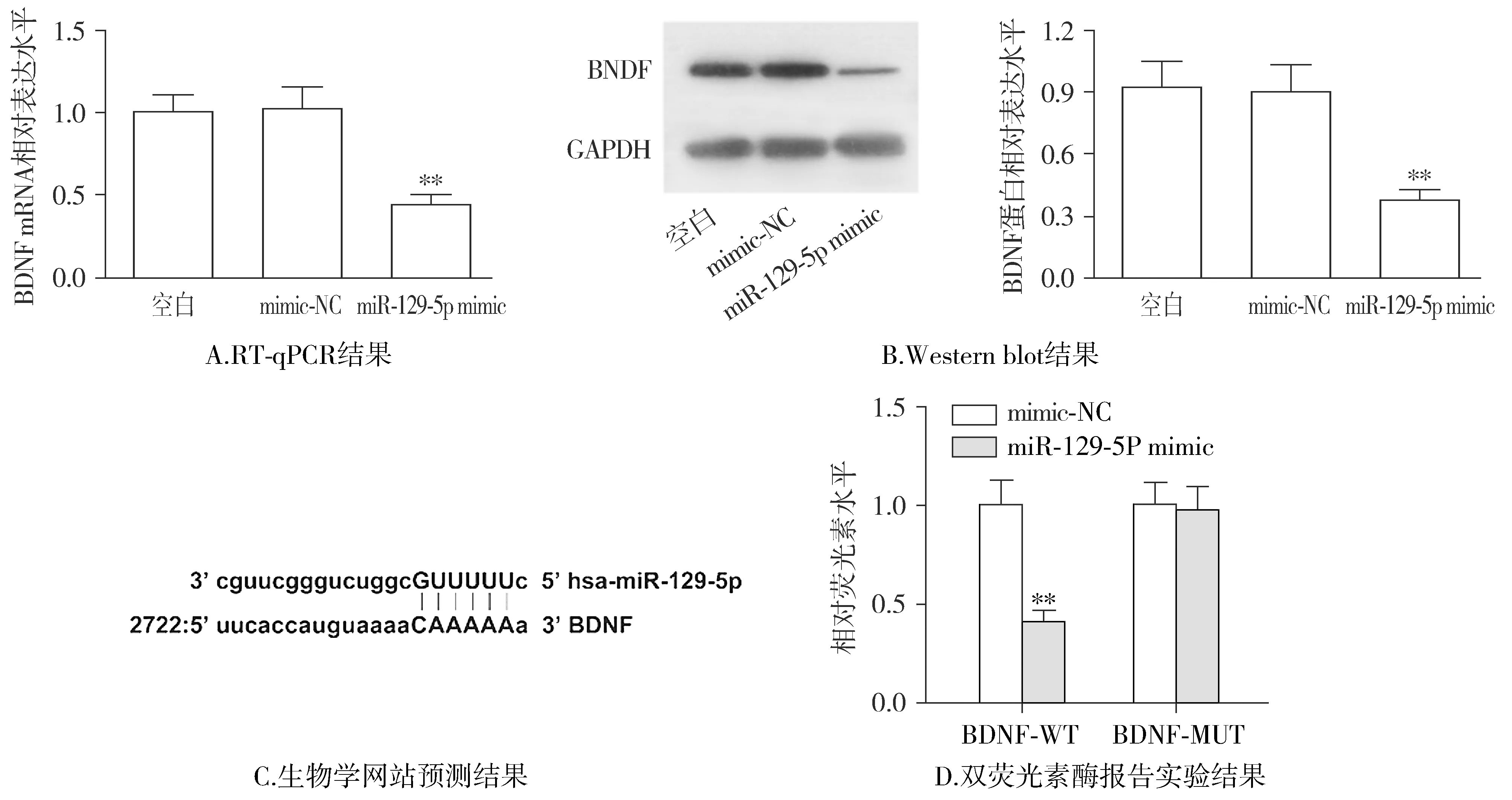
与mimic-NC组比较,*P<0.05;与mimic-NC组比较,**P<0.01图5 miR-129-5p靶向负调控BDNFFigure 5 BDNF is targeted and negatively regulated by miR-129-5p
总而言之,本研究报道了miR-129-5p在MM中下调及其临床意义。miR-129-5p通过靶向抑制BDNF来抑制肿瘤细胞的增殖,诱导其凋亡,并抑制IL-6、TNF-α、IL-1β及VEGF的分泌,从而起到抑癌作用。这些发现表明,miR-129-5p可能是MM有价值的潜在的分子靶标。
