石河子地区慢性乙型肝炎/肝硬化合并代谢综合征患者的临床特征
2021-01-20张鹏飞朱庆峰左维泽石河子大学医学院新疆石河子83008石河子大学医学院第一附属医院感染性疾病科新疆石河子83008
张鹏飞,朱庆峰,左维泽 (.石河子大学医学院,新疆 石河子 83008;.石河子大学医学院第一附属医院感染性疾病科,新疆 石河子 83008)
慢性乙型肝炎(chronic hepatitis B,CHB)是一个世界性的公共卫生问题,全球慢性HBV感染者超过2.48亿,其中15%~25%的患者最终将死于肝硬化或肝癌[1]。现阶段,中国人群血清HBsAg阳性率约为7.03%,虽较前明显降低,但仍处于中高流行水平[2]。随着经济发展与城市化进程,我国普通人群的生产生活方式发生了巨大改变,最明显的就是物质生活的改善与体力劳动强度的降低,这直接导致我国肥胖人口大幅增加,高血压、糖尿病、脂肪肝等代谢性疾病发病率逐年升高,临床上将这种多种代谢异常发生在同一个体的临床状态命名为代谢综合征(metabolic syndrome,MS)。有文献报告我国普通人口MS的患病率高达33.9%[3],且仍呈上升趋势。来自国内外的研究均提示,合并MS是CHB患者抗病毒失败或应答不佳的重要原因[4-5],那么,合并MS之后,CHB的病情出现了哪些改变,临床医师在护肝、抗病毒治疗之外还需要施加哪些干预,要明确这些,需要首先了解合并代谢综合征的慢性乙型肝炎/肝硬化患者的临床特征。因此,笔者进行了上述研究,现将结果报告如下。
1 资料与方法
1.1一般资料:为避免环境、遗传因素干扰,所有研究对象均为来自石河子地区的汉族慢性乙型肝炎患者,生活环境、饮食习惯基本一致,就诊医疗机构统一为石河子大学医学院第一附属医院,招募时间为2017年1月~2019年8月,只抓取患者就诊时的体格检查、血生化检查、血常规检查、肝脏影像检查的数据,不对患者进行额外的采血及再治疗干预,患者的护肝、抗病毒、代谢干预、随访均由感染科专科医师负责。纳入标准:石河子地区居民,男女不限,汉族,年龄18~70周岁,血清HBsAg阳性持续时间超过10年,代谢综合征的诊断在慢性乙型肝炎确诊之后。标准如下:①慢性乙型肝炎/肝硬化的诊断参照《慢性乙型肝炎防治指南(2015年版)》[6];②代谢综合征的诊断参照《中华医学会糖尿病学分会关于代谢综合征的建议》[7]:超重和(或)肥胖BMI≥25.0 kg/m2;血脂紊乱:三酰甘油≥1.7 mmol/L;或男性HDL-C<0.9 mmol/L,女性HDL-C<1.0 mmol/L;高血压:血压≥140/90 mm Hg(1 mm Hg=0.133 3 kPa),或已经确诊为高血压并治疗者;高血糖:空腹血糖≥6.1 mmol/L或糖负荷后2 h血糖≥7.8 mmol/L,或已经确诊为糖尿病并治疗者,以上4条符合3条及以上即可诊断;③临床资料完整。排除标准:①合并其他病毒性肝炎、酒精性肝病、自身免疫性肝病、药物性肝病、原发性胆汁性肝硬化、代谢性肝病、肝细胞癌等肝脏疾病者;②合并甲状腺相关疾病、风湿免疫疾病、血液系统疾病及恶性肿瘤者;③就诊前使用过护肝、降酶药,包括草药或中成药,使用过干扰素、核苷类抗病毒药物,使用过影响血细胞生成或释放的药物者;④临床资料缺失者。
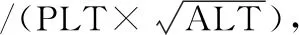
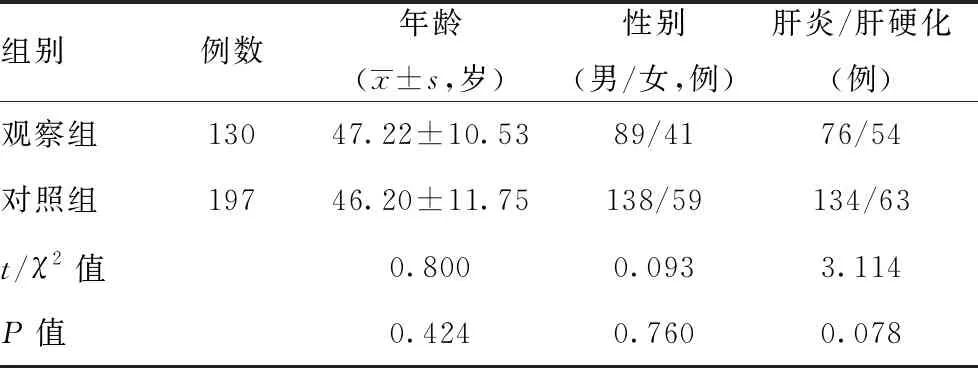
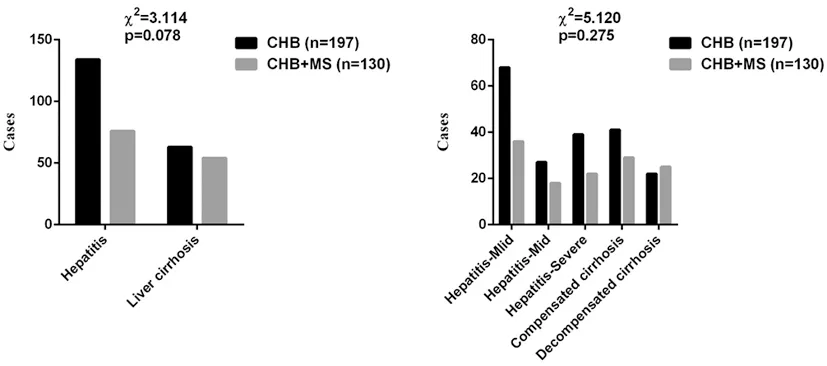
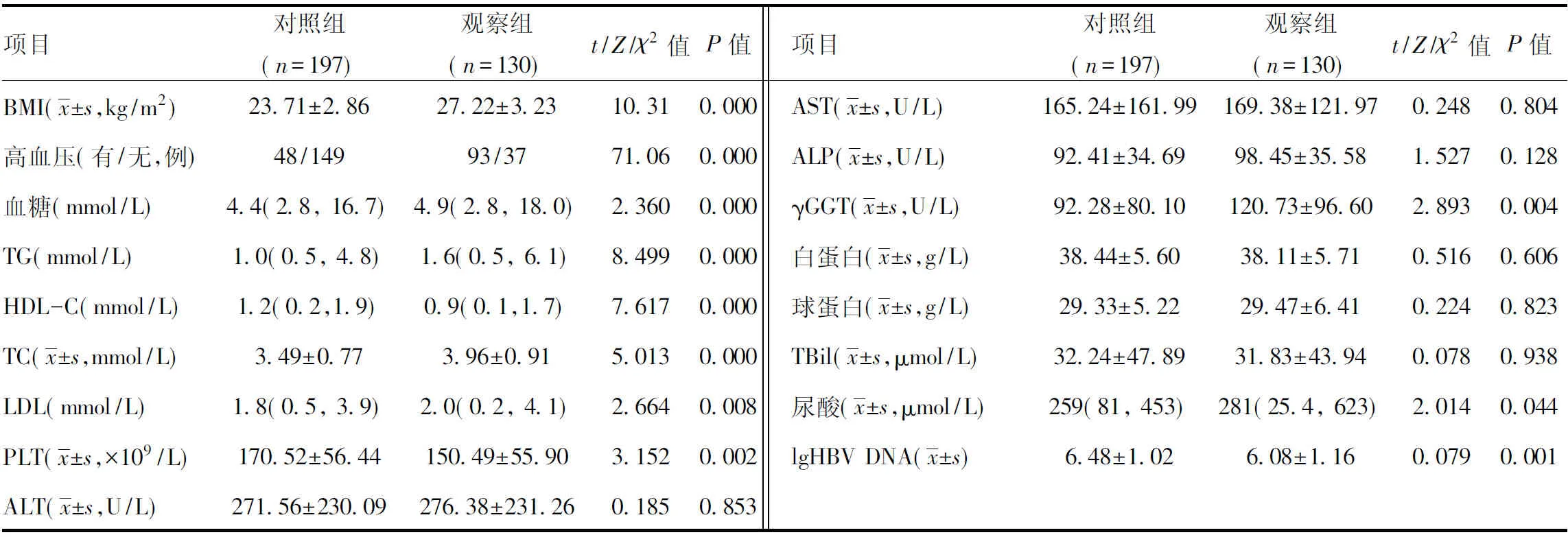
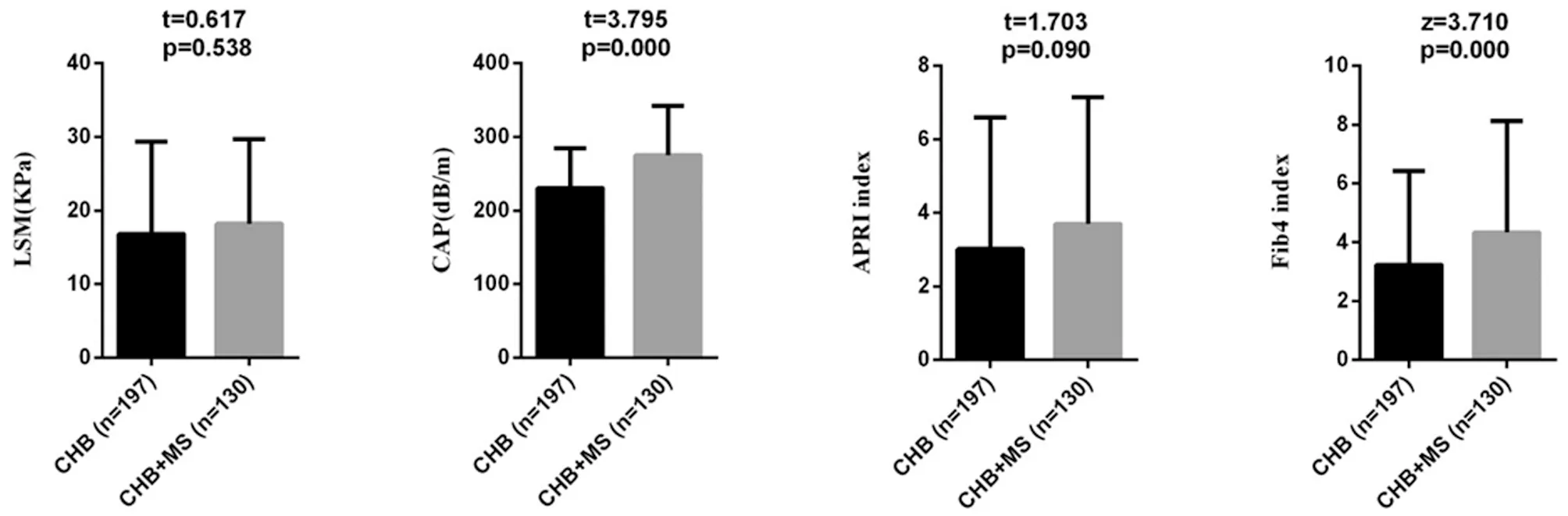
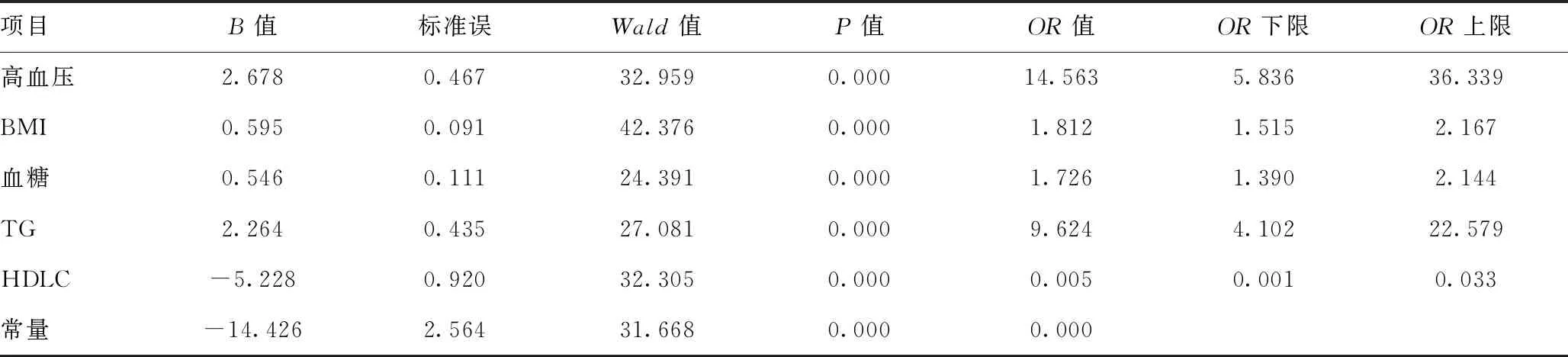
当转氨酶、胆红素均正常时,LSM<6.0 kPa,排除进展性肝纤维化,LSM<9.0 kPa,排除肝硬化,LSM≥9.0 kPa,诊断进展性肝纤维化,LSM≥12.0 kPa,诊断进展性肝硬化;胆红素正常未接受过抗病毒治疗者,LSM<7.4 kPa,排除进展性肝纤维化,LSM≥9.4 kPa,诊断显著肝纤维化,LSM<10.6 kPa,排除肝硬化,LSM≥12.4 kPa,诊断进展性肝纤维化,LSM≥17.5 kPa,诊断肝硬化。当CAP<238 dB/m时,排除脂肪肝,当238 dB/m≤CAP<259 dB/m时,诊断轻度脂肪肝,当259 dB/m≤CAP<292 dB/m时,诊断中度脂肪肝,当CAP≥292 dB/m时,诊断重度脂肪肝。因纳入的研究对象均为肝功能异常患者,且绝大多数患者拒绝肝穿刺活检,缺乏肝组织病理学依据,因此,肝损伤分级的判断采用临床标准:①轻度肝损伤:80 U/L 2.1一般资料比较:两组在年龄、性别构成、肝损伤分级构成方面差异无统计学意义(P>0.05),具有可比性。详见表1与图1。 表1 两组患者一般资料比较 图1 两组患者肝损伤分级统计分析 2.2两组各项临床指标对比:两组患者血清ALT、AST、白蛋白、球蛋白、TBil等指标差异无统计学意义(P>0.05);观察组BMI、高血压患病率、FBG、γGGT、TC、TG、LDL、UA均明显高于对照组,差异有统计学意义(P<0.05);观察组患者血清HDL-C、HBV DNA载量低于对照组,差异有统计学意义(P<0.05)。详见表2。 表2 两组患者临床指标对比 2.3两组LSM、APRI、CAP、FIB-4比较:观察组LSM、APRI的均值均高于对照组,但差异无统计学意义(P>0.05);观察组患者CAP、FIB-4均值明显高于对照组患者,差异有统计学意义(P<0.05)。详见图2。 2.4CHB合并MS患者多因素二元Logistics回归分析结果:分析结果可证实高血压、高BMI、高血糖、高三酰甘油是CHBMS的危险因素,高HDL-C是CHB合并MS的保护因素,回归方程为Y=-14.426+2.678×高血压+0.595×BMI+0.546×Glu+2.264×TG-5.228×HDL-C。(注:有高血压病史赋值1,无高血压病史赋值0;BMI、Glu、TG、HDL-C均为具体数值)。见表3。 图2 两组患者LSM、APRI、CAP、FIB-4统计分析 表3 CHB患者并发MS的多因素二元Logistics回归分析 台湾学者研究表明,对照组患者中MS的发病率为29.7%,与普通人群无明显差异[8]。但临床观察发现,对照组合并MS的患者逐年增多,为对抗乙型肝炎病毒治疗带来新的挑战,对对照组合并MS的患者群体要引起足够的重视。 本研究显示,观察组患者的BMI、血糖、TG、TC、LDL、尿酸均明显高于对照组患者,与此同时,血清HDL-C却较后者明显降低,这充分说明来院就诊的这部分患者在积极治疗慢性乙型肝炎的同时还应当尽快纠正超重、糖脂代谢紊乱,也提醒临床医师应加强代谢紊乱的医疗宣教,降低MS的发病率。观察组患者的血清ALT、AST、TBil水平较对照组差异无统计学意义(P>0.05),而血清γGGT水平较后者明显升高,提示MS与对照组患者炎性反应程度的肝脏酶学指标无关,而与反应代谢的酶学指标有关,这与多篇研究[9-10]结论一致。其主要原因可能与非酒精性脂肪肝(NAFLD)有关。目前普遍认为,NAFLD是MS在肝脏中的表现。而NAFLD主要发病原因是胰岛素抵抗和遗传易感相关的代谢应激性肝损伤,与MS的发病原因相似。目前认为NAFLD的形成机制主要为各种原因致三酰甘油升高,使得三酰甘油在肝细胞内的沉积,促使肝细胞发生脂肪变性,这在绝大多数情况下是一个良性过程,并不会加重肝脏炎性反应坏死程度。且目前广泛认为NAFLD的严重程度主要与年龄>50岁、BMI>30 kg/m2、高血压病、T2DM与MS等这些危险因素有关[11],而本研究未进行纳入比较。既往也有研究表明,对照组患者肝细胞脂肪变性与年龄、胰岛素抵抗、2型糖尿病、BMI等宿主代谢紊乱因素有关,而与病毒学因素无关[8-9]。综合来看,对照组患者发生MS和肝脏脂肪变的原因主要由代谢因素所致,且MS并不会导致肝脏炎性反应程度的加重。 研究结果显示,观察组患者的血清HBV DNA载量低于对照组,且差异具有统计学意义(P<0.05),提示合并MS的对照组患者体内HBV病毒复制可能受到抑制,这一发现与多项研究[12-13]结论一致。原因可能是脂肪变性影响了HBV DNA在体内的复制,但具体原因还待进一步证实。 分别计算分析两组的APRI、FIB-4,结合LSM、CAP检查结果,发现观察组患者中进展性肝纤维化患者更高,中重度的脂肪肝发病率更高,结合已有的文献资料,证实MS促进对照组患者的肝脏脂肪变及肝纤维化进展[14-15]。在对照组患者中,MS与肝纤维化严重程度独立相关。目前认为的发生机制是MS的高血糖和高胰岛素血症刺激肝星状细胞活化,导致结缔组织生长因子增加,细胞外基质沉积,从而促进肝纤维化或者肝硬化的发生发展[16]。因此,对于对照组患者,除了进行抗病毒治疗外,还应积极调整饮食结构,加强锻炼,定期监测血压、血脂、血糖;对已经合并MS及其组分的患者也要积极进行控制干预,这对延缓肝纤维化的进展,提高对照组患者的治疗效果及生活水平具有重要意义。
2 结果
3 讨论
