喉癌组织中自噬相关蛋白p62的表达及意义
2021-01-20方桂任林振孟福建省肿瘤医院福建医科大学附属肿瘤医院头颈肿瘤外科福建福州350014
方桂任,刘 辉,林振孟 (福建省肿瘤医院,福建医科大学附属肿瘤医院头颈肿瘤外科,福建 福州 350014)
喉癌是头颈部最常见的恶性肿瘤之一,2018年全球总发病率约为18万,死亡人数约为8万[1]。尽管当前整体治疗水平有所提高,但喉癌的总体生存率仍较差。恶性肿瘤的发生、发展是一个非常复杂的过程,揭示喉癌发生、发展的分子机制有利于开发喉癌新的治疗药物。p62/SQSTM1(以下称p62)是一种多功能的衔接蛋白,作为自噬的选择性底物[2],在胃癌[3]、肝细胞癌[4]、乳腺癌[5]中均发现p62的异常积聚,本文探讨自噬相关蛋白p62在喉癌组织中的表达及临床意义。
1 资料与方法
1.1一般资料:选取2010年1月~2015年4月于福建省肿瘤医院行喉癌手术患者作为研究对象,纳入标准包括:①根治性手术;②病理明确为鳞癌;③临床病理资料完整,随访可靠。排除标准:①术前新辅助化疗;②合并其他部位恶性肿瘤;③术后30 d内死亡。共有115例患者纳入研究,采用免疫组化检测喉癌组织及癌旁正常组织石蜡标本p62蛋白表达水平。另一方面,收集2018年1月~2019年8月我院25例新鲜喉癌组织标本放入-80℃冰箱保存,采用实时荧光定量PCR(RT-PCR)和蛋白质印迹法(Western Blot)检测冷冻保存标本中p62mRNA及蛋白的表达水平。本次研究经过本院医学伦理委员会同意。
1.2主要试剂:p62单克隆抗体购自美国Abcam公司,RNA分离试剂盒Trizol、逆转录试剂盒、实时荧光定量PCR 试剂盒购自日本Takara 公司。蛋白质印迹法(Western blot)所用试剂及蛋白裂解液盒购自上海碧云天生物技术有限公司。
1.3实验方法
1.3.1免疫组化SP法:将石蜡组织以4 μm厚连续切片,65℃烤箱烘片30 min,脱蜡、水化、阻断过氧化物酶活性、修复抗原,山羊血清封闭液封闭后加入鼠抗人p62一抗,4℃过夜,加入二抗、DAB染色、复染、脱水后显微镜下观察。染色强度分级:无色为0分,淡黄色为1分,棕黄色为2分。阳性细胞数分级:阳性细胞数≤50%为0分,阳性细胞数51%~75% 为1分,阳性细胞数≥76%为2分。两项得分相加,3~4分为高表达,0~2分为低表达。
1.3.2实时荧光定量PCR(RT-PCR):采用Trizol试剂盒提取并纯化新鲜标本mRNA,根据逆转录和扩增试剂盒说明书进行逆转录和扩增,反应条件:95 ℃预变性10min,95 ℃变性5 s,60 ℃延伸45 s,72℃60 s延伸,共40个循环。p62上游引物序列:5′- AGCTGCCCTCAGCCCTCTA-3′,下游引物序列:5′- GGCTTCTCTTCCCTCCATGTT-3′。看家基因GAPDH上游引物序列:5′-ACCACAGTCCATGCCATCAC-3′,下游引物序列:5′-TCCACCACCCTGTrGCTGTA-3′。
1.3.3蛋白质印迹法:充分研磨并裂解组织,采用BCA法测蛋白浓度。取30 μg蛋白进行上样、电泳、转膜、封闭,加p62单克隆抗体(稀释比例1∶1 000)4℃孵育过夜,相应二抗(稀释比例1∶000)室温孵育1 h,以GAPDH作为内参。

2 结果
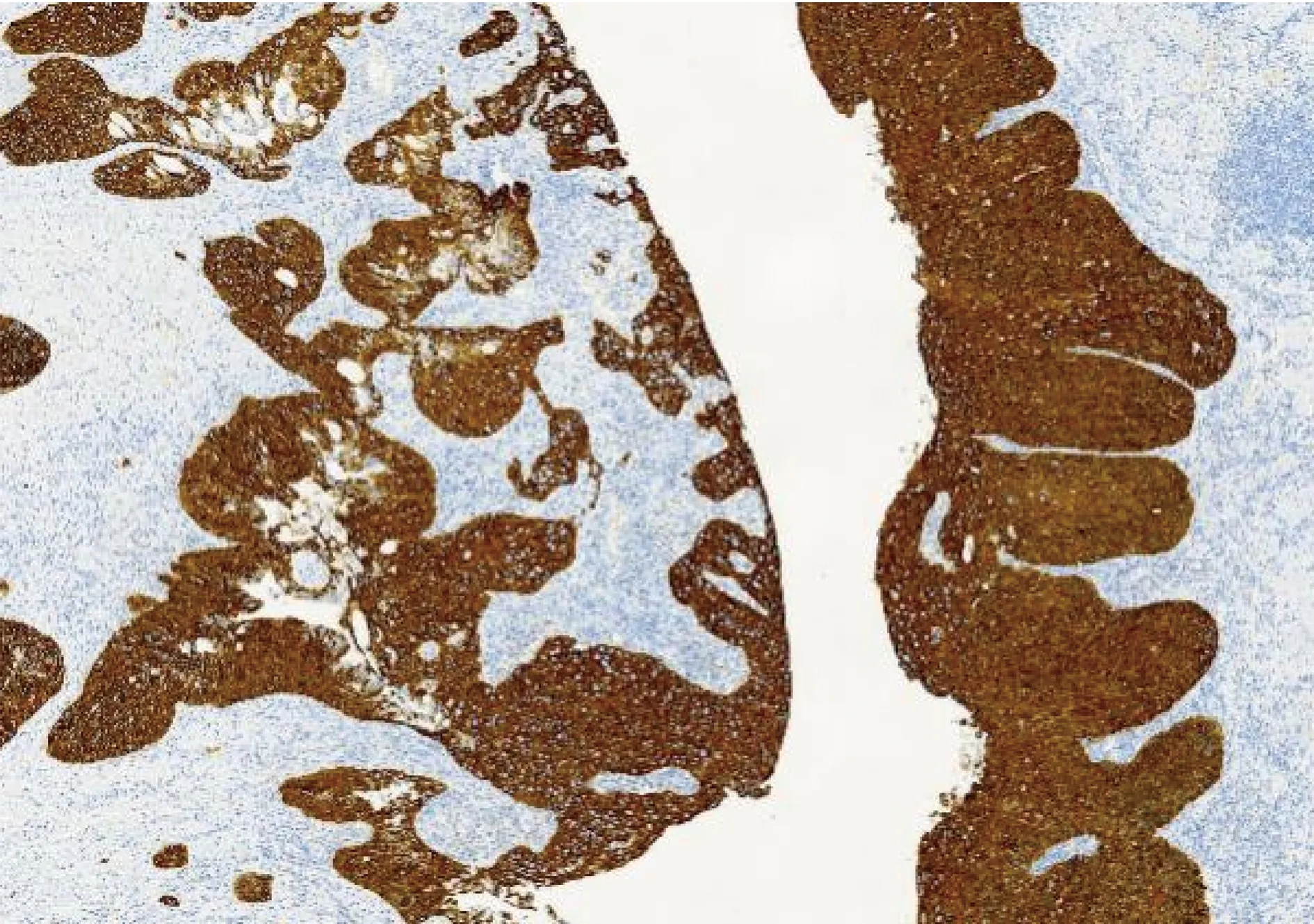
图1 p62在喉癌组织中表达阳性(×10)
2.1p62在喉癌组织中的表达情况:免疫组化中,p62蛋白定位于细胞质中,p62在喉癌石蜡组织中表达阳性率为56.5%(65/115),高于癌旁正常组织的23.5%(27/115),差异有统计学意义(P<0.05),见图1、图2。在新鲜冰冻组织中,RT-PCR结果扩增曲线呈S形,溶解曲线呈单峰,说明结果可靠,见图3、图4。p62mRNA在喉癌表达水平[ΔCT值为(2.814±1.156)]高于癌旁正常组织[ΔCT值为(1.632±1.061)],差异有统计学意义(P<0.05)。Western blot结果显示:喉癌组织中p62蛋白表达水平(0.812±0.421)高于癌旁正常组织(0.501±0.311),差异有统计学意义(P<0.05)。见图5。
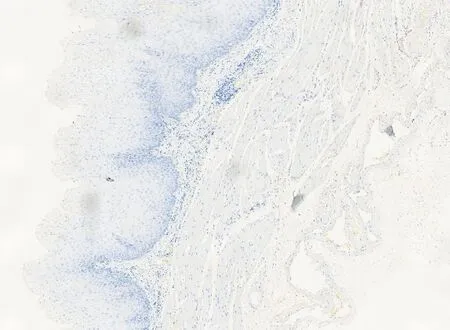
图2 p62在癌旁正常组织中表达阴性(×10)
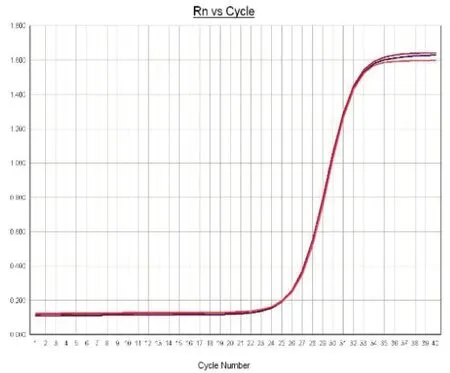
图3 p62扩增曲线
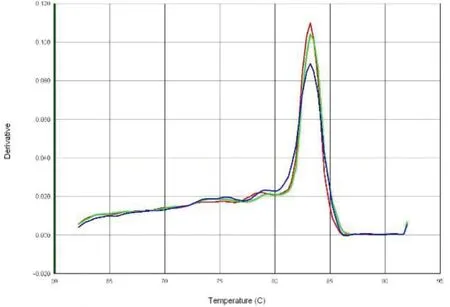
图4 p62的溶解曲线
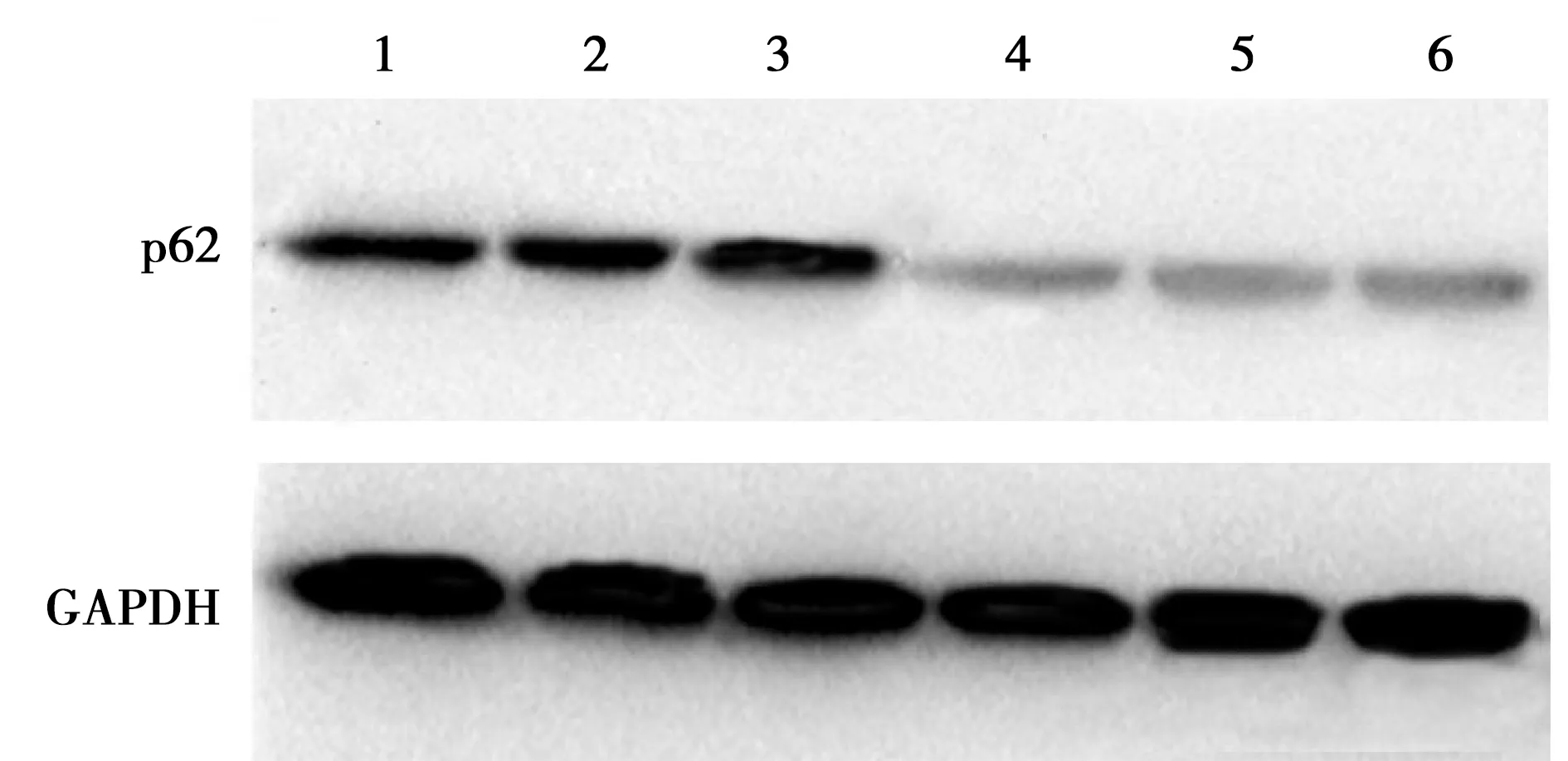
图5 1-3:喉癌组织,4-6:癌旁正常组织
2.2p62与临床病理资料及预后的关系:p62的表达与年龄、性别、吸烟、临床分型、肿瘤大小、分化程度、手术方式无关(P>0.05);与喉癌的浸润深度、淋巴结转移、病理分期有关(P<0.05),见表1。p62阳性患者的5年生存率为36.1%,低于p62阴性患者的62.6%,差异有统计学意义(P=0.019)。见图6。
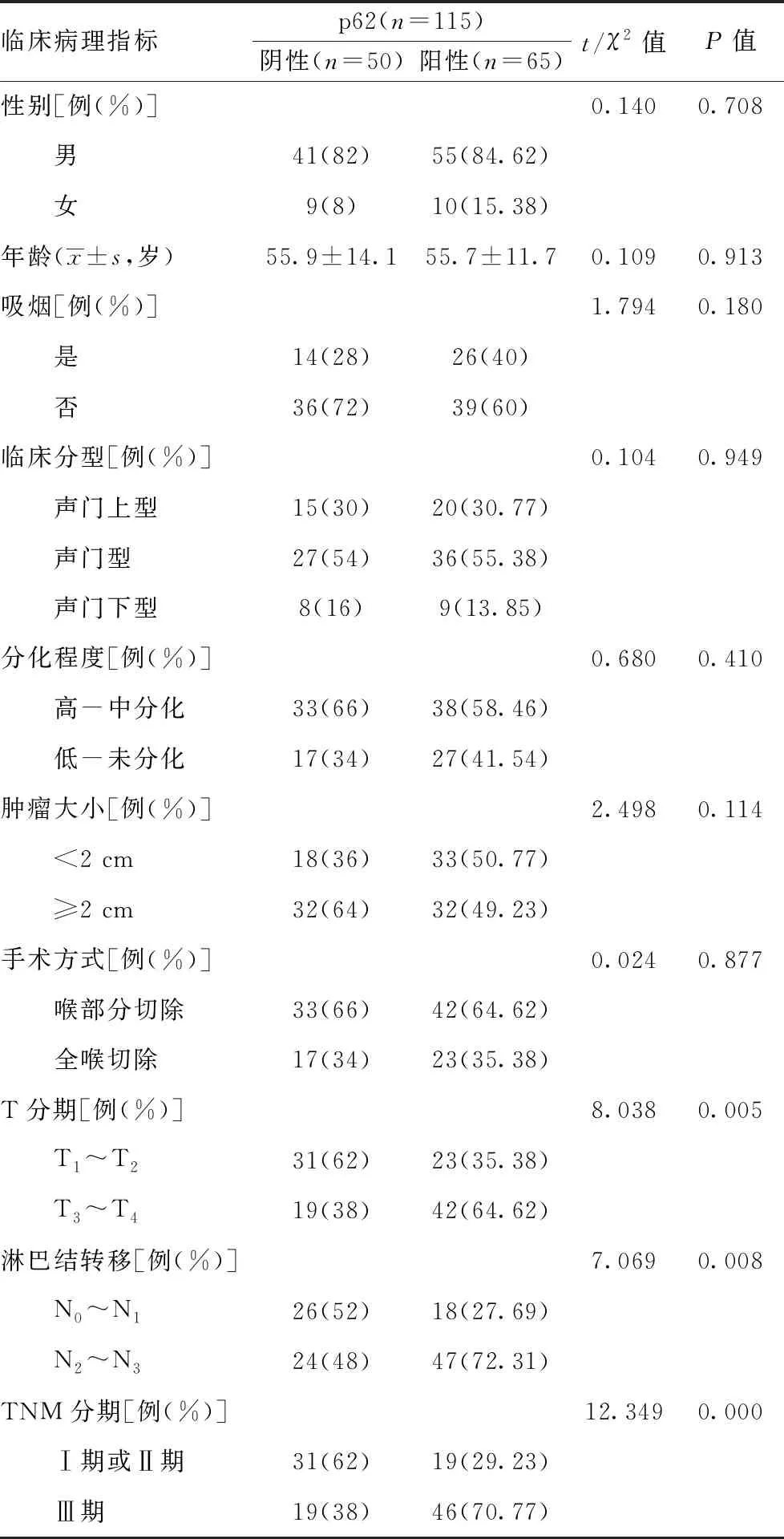
表1 p62与临床病理特征的关系
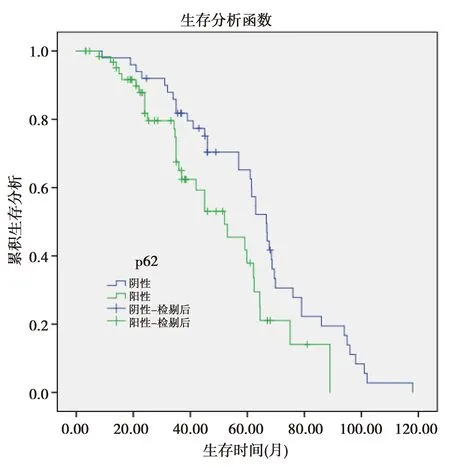
图6 p62阳性和阴性的生存曲线
3 讨论
自噬是生物在进化中保守的细胞内分解代谢过程,在这个过程中,自噬底物(细胞质大分子、聚集蛋白、受损细胞器或病原体)被运送到溶酶体,并被溶酶体水解消化产生核苷酸、氨基酸、脂肪酸、葡萄糖和ATP,最终循环到细胞质。这种由溶酶体介导的细胞自我消化一方面维持细胞在饥饿和应激期间的新陈代谢和生存,另一方面消除受损的蛋白质和细胞器,以保持蛋白质和细胞器的质量和数量平衡[6]。p62是应激诱导蛋白,作为非典型蛋白激酶C(PKC)、细胞外信号调节激酶1 (ERK1)、核因子-JB和半胱氨酸天冬氨酸蛋白酶-8(Caspase-8)的支架蛋白已被广泛研究,越来越多证据表明,在氧化应激反应以及泛素化的自噬受体中发挥着巨大的作用[7]。p62具有多个结构域,包括Phox1和Bem1p(PB1)结构域、锌指(ZZ)、两个核定位信号、一个肿瘤坏死因子受体相关因子6(TRAF6)结合域、一个核输出信号、一个LC3相互作用区(LIR)、一个Keap1相互作用区(KIR)和一个泛素相关(UBA)结构域,不同的结构域与各个受体相互结合从而发挥多种作用[8]。微管相关蛋白轻链3(microtubule-associated protein light chain 3,LC3)在自噬中发挥多种作用,包括自噬泡膜形成、转运自噬底物和自噬小体运输,是自噬体的标志性分子[9]。p62中的LIR结构域与LC3上多个位点相互作用,将泛素化的自噬底物递送溶酶体中,进而与溶酶体结合,促使底物被选择性自噬。此外,p62是哺乳动物溶酶体激活的信号枢纽,也是激活自噬底物上Keap1-Nrf2信号通路枢纽,在选择性自噬中扮演着特定且不可或缺的角色[10]。
本研究中,p62与喉癌的浸润深度、淋巴结转移、病理分期有关,其阳性预示着患者的不良预后,表明p62促进肿瘤的生长及发展。癌细胞与所处的内外环境有着密切关系,称为肿瘤微环境。肿瘤微环境是近年来出现的新兴概念,已成为肿瘤研究的一个重要标志,肿瘤微环境通过提供营养物质使肿瘤细胞能够存活,由自噬介导的肿瘤微环境可能在调节肿瘤的发展、转移和治疗耐药中发挥重要作用,自噬与肿瘤微环境之间的相互作用越来越引起人们的关注。自噬可以由肿瘤微环境中的几种应激源诱导,同时自噬也可以改变肿瘤微环境。肿瘤微环境的生理特征明显不同于正常组织,由于肿瘤细胞快速生长,血管生成不足无法输送充足的氧气及能量至整个肿瘤,所以肿瘤微环境表现为缺氧、缺乏营养及能量、酸性和炎性反应[11]。越来越多的证据表明,自噬可以帮助肿瘤细胞分解大分子物质来提供能量,从而适应肿瘤细胞恶劣的微环境,从而有利于肿瘤细胞的存活[12]。失巢凋亡是指细胞与细胞外基质丧失接触后诱导的凋亡。癌细胞可通过血管及淋巴系统转移至远处组织和器官,在此期间,自噬可使癌细胞在失去细胞外基质的情况下存活和增殖,避免失巢凋亡[13]。一项研究表明,在肺转移模型中,抑制自噬不仅可以减少肝癌细胞的侵袭和迁移,而且还可以降低肝癌细胞抵抗失巢凋亡[14]。铂类药物为基础的化疗是喉癌治疗中重要方式之一,化疗耐药的产生降低了化疗疗效。研究表明癌细胞通过上调保护性自噬使肿瘤对抗癌药物产生抗药性[15],抑制自噬可以提高癌症患者化疗的效果。
总之,在肿瘤的发生、发展、抗癌治疗过程中,自噬起着至关重要的作用。p62是自噬重要调节因子,是解决抗癌治疗耐药、复发和转移的潜在治疗靶点,通过调控p62的表达为提高肿瘤治疗提供了潜在治疗策略。
