嗜糖假单胞菌麦芽四糖酶基因在地衣芽孢杆菌中的异源表达
2021-01-20楼志华刘翔张劲楠
楼志华,刘翔,张劲楠
1(江苏省奥谷生物科技有限公司,江苏 常州,213300)2(溧阳维信生物科技有限公司,江苏 常州,213300)
麦芽四糖酶 (glucan 1,4-α-maltotetraohydrolase),又名麦芽四糖淀粉水解酶,可以连续地催化淀粉状多糖中非还原型末端麦芽四糖残基的水解,主要产物为麦芽四糖[1]。而麦芽四糖因其独特的理化特性,一度被誉为最有希望的麦芽低聚糖[2],在食品加工行业有着广泛、重要的应用。
麦芽四糖酶基因主要来源于斯氏假单胞菌(Pseudomonasstutzeri)和嗜糖假单胞菌(Pseudomonassaccharophila),二者来源的麦芽四糖酶均为α构型。相比而言,嗜糖假单胞菌来源的麦芽四糖酶的热稳定性和pH稳定性均较好,在40 ℃以下和pH 5.5~11均能长时间保持稳定;在最适温度(55 ℃)、最适pH(6.7)以及在其他宿主内表达后酶活力也均较高[3]。这些因素表明嗜糖假单胞菌来源的麦芽四糖酶更适合于工业化应用,也因而备受学者的关注。国内,ZHOU、赵云等[4-5]在大肠杆菌中克隆表达了嗜糖假单胞菌来源的麦芽四糖酶,但获得的重组酶大部分是包涵体,重组酶活力并不高。2019年,张梓芊、杨亚楠等[6-7]在Bacillussubtilis中构建了表达系统胞外表达了嗜糖假单胞菌来源的麦芽四糖酶,发现其比活力为980.49 U/mg,通过发酵优化后,在摇瓶水平重组酶活力可高达147 U/mL。这些报道中,重组酶酶学性质基本一致,在芽孢杆菌中表达可获得更高的活力。国外,美国杰能科公司上市的麦芽四糖酶SAS3则以地衣芽孢杆菌为宿主进行重组表达[8],并且在地衣芽孢杆菌发酵产相关淀粉酶方面形成了技术封锁,因此导致国内纯化的麦芽四糖价格极高。地衣芽孢杆菌是优良的食品安全级表达宿主,被美国FDA认定为食品安全级菌株(Generally Recognized As Safe, GRAS)已有近40年的历史,而且该菌产酶能力高,胞外蛋白分泌能力大约是枯草芽孢杆菌的2倍[9]。然而,国内目前还未发现有关重组地衣芽孢杆菌表达麦芽四糖酶的研究。
本研究拟构建地衣芽孢杆菌表达系统,对来源于嗜糖假单胞菌的麦芽四糖酶基因进行木糖诱导表达,通过果聚糖合酶信号肽使麦芽四糖酶分泌至胞外,并对构建的重组菌进行初步发酵条件优化,以期为地衣芽孢杆菌的异源表达以及麦芽四糖酶的工业化应用提供参考。
1 材料与方法
1.1 菌株和质粒
本研究所用敲除了α-淀粉酶基因amyL和碱性蛋白酶基因aprE的地衣芽孢杆菌BacilluslicheniformisCICIM B1391(BLΔAE)、E.coliJM109以及大肠杆菌-芽孢杆菌穿梭质粒pHY300-PLK,均购于江南大学,由江苏省奥谷生物科技有限公司保藏。重组质粒pBLSY2由江南大学石贵阳教授惠赠,该重组质粒携带了来源于B.licheniformisCICIM B1391自身的木糖异构酶启动子及其调控蛋白基因、枯草芽孢杆菌果聚糖合酶信号肽基因sacBss、B.licheniformisATCC 14580的麦芽糖淀粉酶基因以及木糖异构酶基因的终止子ter。嗜糖假单胞菌麦芽四糖酶基因序列由NCBI数据库查寻获得,序列号为:X16732.1,将该序列和终止子ter一并委托上海生物工程有限公司合成,合成后的片段插入至质粒pET28a中,即pET28a-G4-ter。重组质粒pBLxys、pBLG4,重组地衣芽孢杆菌BLG4由本研究构建。
1.2 工具酶、引物和试剂
含DNA聚合酶的Taq和Pfu预混液、T4 DNA连接酶,Thermo Fisher公司;各种限制性内切酶、PCR产物纯化试剂盒、质粒提取试剂盒,TAKARA有限公司;引物由上海生物工程有限公司合成,引物序列见表1;酵母粉和蛋白胨,安琪酵母有限公司;其他试剂为国产分析纯或生化试剂。

表1 本研究所使用的引物Table 1 Primers used in this study
1.3 DNA操作技术
质粒提取、DNA片段纯化、回收等均参照TAKARA试剂盒说明书。PCR扩增反应、DNA琼脂糖凝胶电泳、酶切、连接以及转化子筛选等均参照分子克隆实验指南[10]。
1.4 木糖诱导分泌表达载体的构建
首先以重组质粒pBLSY2为模板,以PxylF、PxylsR为引物,扩增含木糖异构酶启动子及其调控蛋白基因和信号肽的基因片段Blxyl-sacBss,反应条件:95 ℃ 10 min,95 ℃ 30 s,54 ℃ 30 s,72 ℃ 2 min,30个循环,72 ℃ 10 min。然后分别同pHY300-PLK经HindⅢ和KpnⅠ酶切后通过胶回收克隆至pHY300-PLK,获得木糖诱导分泌表达的重组质粒pBLxys后转化至E.coliJM109,即E.coliJM109/pBLxys。再以pET28a-G4-ter为模板,以引物PxylsF、PterR扩增麦芽四糖酶结构基因,反应条件与上述一致,再分别同pHY300-PLK经KpnⅠ和XbaⅠ酶切后通过胶回收克隆至pBLxys,即为木糖诱导分泌表达麦芽四糖酶的重组质粒pBLG4,经过转化子筛选后,送去测序,测序正确后即获得携带pBLG4重组质粒的E.coliJM109/pBLG4。
1.5 重组地衣芽孢杆菌的构建
培养E.coliJM109/pBLxys、E.coliJM109/pBLG4,提取重组质粒pBLxys、pBLG4后,按文献[13]所述电转方法分别将其转入BLΔAE,从而获得重组地衣芽孢杆菌BLXYLS和BLG4。
1.6 麦芽四糖酶酶活定义及测定
麦芽四糖酶酶活力单位(U)定义为:在pH 7.0和50 ℃的反应条件下,每分钟分解可溶性淀粉生成相当于1 μmoL葡萄糖所需的酶量。
麦芽四糖酶酶活测定方法参照文献[5]。
1.7 发酵优化实验
LBG培养基(g/L):葡萄糖10.0,蛋白胨FP321 10.0,酵母粉FM408 5.0,NaCl 10.0。
发酵培养基(g/L):麦芽糊精 90,蛋白胨FP321 20,酵母粉FM408 10,玉米浆干粉5,(NH4)2HPO410,K2HPO4·3H2O 9.12,KH2PO41.36,CaCl20.50,MgSO4·7H2O 0.50。
在进行发酵优化实验时,均使用挡板摇瓶进行发酵,发酵前均加入终质量浓度为20 mg/L的四环素。每组实验做3个平行。
2 结果与分析
2.1 重组表达载体的构建
根据NCBI显示,嗜糖假单胞菌麦芽四糖酶基因序列(G4-ter)总长约1.7 kbp,编码551个氨基酸,理论上蛋白大小为59.9 kDa,而终止子序列总长为0.1 kbp,因此KpnⅠ和XbaⅠ酶切后应获得约1.8 kbp和6.3 kbp大小的2条核酸条带。Blxyl-sacBss基因片段长度约为1.4 kbp,经HindⅢ和KpnⅠ酶切后应获得约6.7 kbp和1.4 kbp大小的2条核酸条带。对获得的克隆宿主E.coliJM109/ pBLG4提取重组质粒pBLG4,质粒大小约8.1 kbp,构建重组表达载体图见图1。然后分别用HindⅢ、HindⅢ和KpnⅠ、KpnⅠ和XbaⅠ酶切,电泳鉴定结果如图2,结合测序结果,可以充分说明重组表达载体构建正确。
2.2 重组麦芽四糖酶的表达
将对照菌BLXYLS和重组菌BLG4分别进行摇瓶发酵,接种后8 h均加入10 g/L木糖进行诱导,然后继续培养30 h,离心后收集发酵液上清,分别检测二者胞外麦芽四糖酶活力。结果显示,只有重组菌BLG4检测到活力,而对照菌BLXYLS未检测到活力。将二者发酵液上清进行十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析,结果见图3。可以发现在约60 kDa处出现一明显的表达条带,这与理论推测的蛋白大小基本一致,表明重组菌成功地将麦芽四糖酶分泌到了发酵液中。
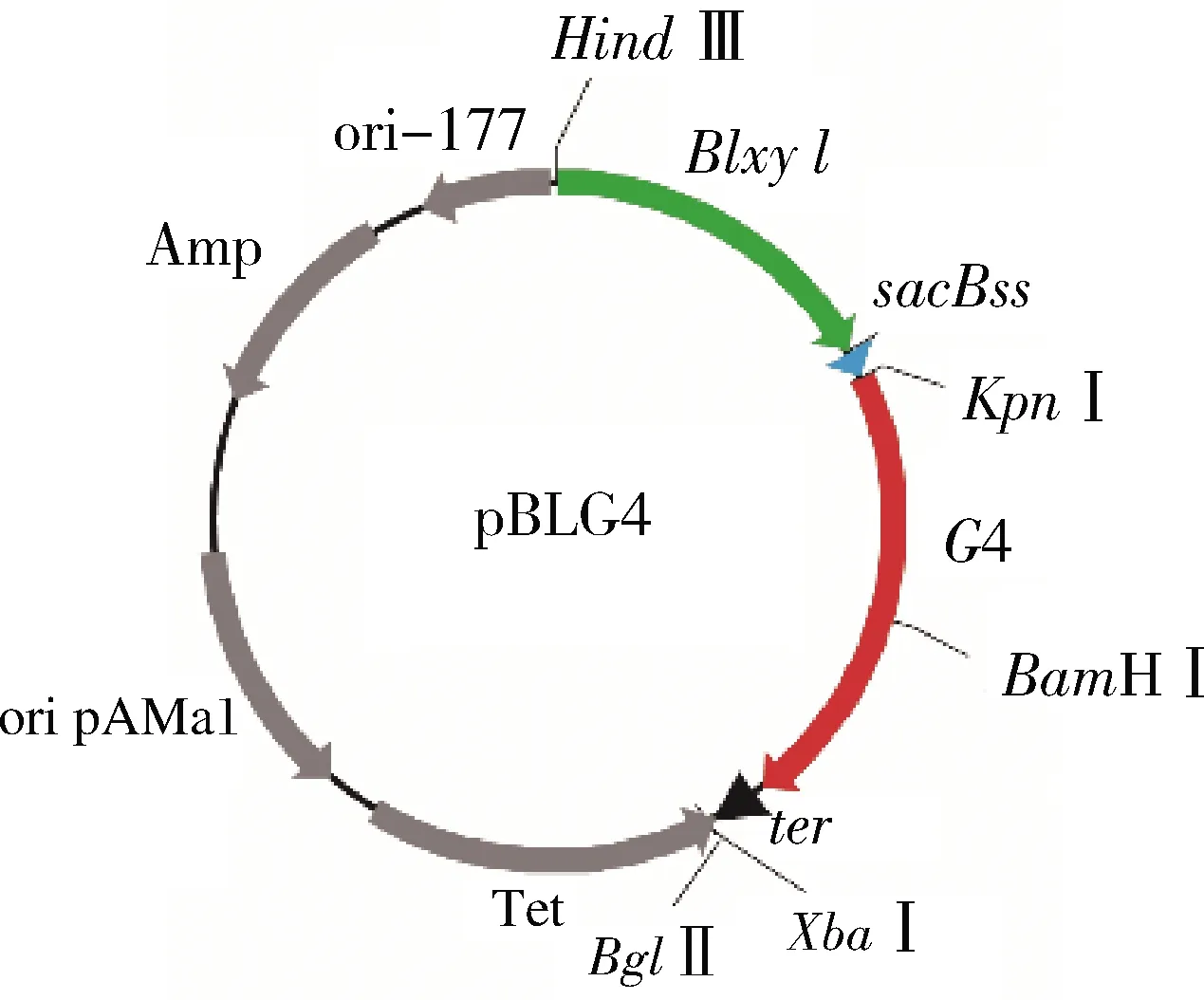
Blxyl-木糖异构酶启动子及其调控蛋白基因;sacBss-枯草 芽孢杆菌果聚糖合酶信号肽基因;G4-嗜糖假单胞菌 麦芽四糖酶基因;ter-木糖异构酶基因的终止子图1 重组表达载体pBLG4Fig.1 Diagram of recombinant expression vector pBLG4
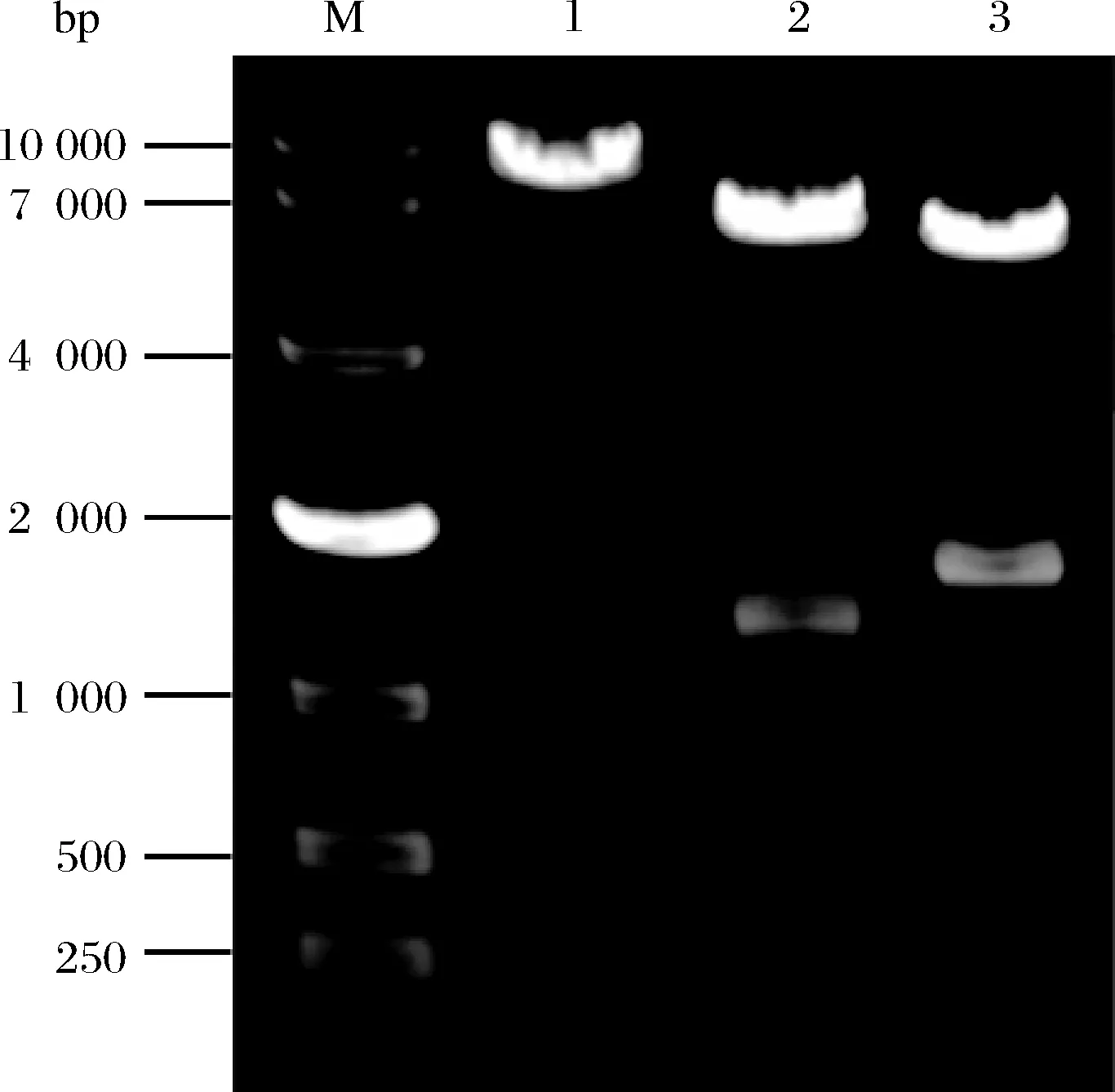
M-Maker;1-pBLG4/Hind Ⅲ;2-pBLG4/Hind Ⅲ+ Kpn Ⅰ; 3-pBLG4/Kpn Ⅰ+ Xba Ⅰ图2 重组表达载体pBLG4验证电泳图Fig.2 Electropherogram of recombinant expression vector pBLG4
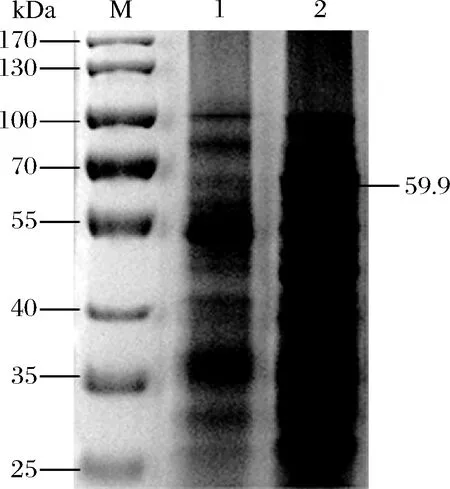
M-Maker;1-BLXYLS;2-BLG4图3 发酵液上清液SDS-PAGE电泳图Fig.3 SDS-PAGE electropherogram of fermentation broth supernatant
2.3 发酵条件优化
2.3.1 诱导剂添加时间对发酵的影响
重组菌接种后,在37 ℃、250 r/min下进行培养,分别在接种后的8、12、16、20、24、28、32 h取样检测OD600,并添加10 g/L木糖进行诱导,发酵至24 h时补加30 g/L麦芽糊精,发酵至48 h时添加10 g/L的木糖,然后继续发酵至72 h结束。发酵结束后,取样检测OD600和发酵液中的麦芽四糖酶活力,结果如表2、图4所示。结果显示,诱导剂添加时间对重组菌生长影响较小,但对发酵结束时胞外麦芽四糖酶酶活有显著影响。随着诱导剂添加时间的延迟(8~24 h),发酵结束时检测到的胞外酶活呈递增趋势,当发酵24 h添加诱导剂时,发酵结束时胞外酶活力高达(138.2±11.2) U/mL;而当28、32 h添加诱导剂时,发酵结束时酶活有所降低。
事实上,这与木糖操纵子在地衣芽孢杆菌中的转录特性有关,据文献[12-13]报道,在对数生长期到稳定期的转换期间木糖操纵子转录活性显著增加,并且这种较高的转录活性会维持近12 h。根据检测到的菌体量来看,发酵至24 h后,重组菌的生长速率明显降低,该时间点对应文献中对数生长期到稳定期的转换期间,因此,在发酵24 h时诱导能够检测到较高的麦芽四糖酶酶活。
2.3.2 诱导温度对发酵的影响
重组菌接种后,在37 ℃、250 r/min下进行培养,当培养至24 h时,添加10 g/L木糖进行诱导,并添加30 g/L麦芽糊精,分别转移至25、30、37、42 ℃,发酵至48 h时添加10 g/L的木糖和30 g/L,然后继续发酵至72 h结束。发酵结束后,取样检测OD600和发酵液中的麦芽四糖酶活力,结果如图5所示。可以发现,诱导温度对重组菌生长和产酶均有显著的影响。在25~37 ℃,随着温度升高,发酵结束后的菌体量也越来越高,而42 ℃时,菌体量又有所降低,这说明重组菌最适生长温度为37 ℃。当诱导温度为30 ℃时,胞外酶活力最高可达(161.4±10.4) U/mL,37 ℃次之,42 ℃时胞外酶活力最低。
重组菌在温度胁迫下的产酶特性是可以预见的。温度低时,菌体整体代谢速率较慢,酶的合成速率也会降低[14]。而温度较高时,尽管菌体代谢速率增加,但地衣芽孢杆菌分泌的其他蛋白酶也会增加[15],对重组酶的水解速率也会增加,另外重组酶自身的稳定性也可能有所下降。所以,诱导温度变化对重组菌生长和重组酶酶活力均有较大的影响。

表2 不同时间添加诱导剂发酵结束时的菌体量Table 2 Biomass at the end of fermentation under different induction time
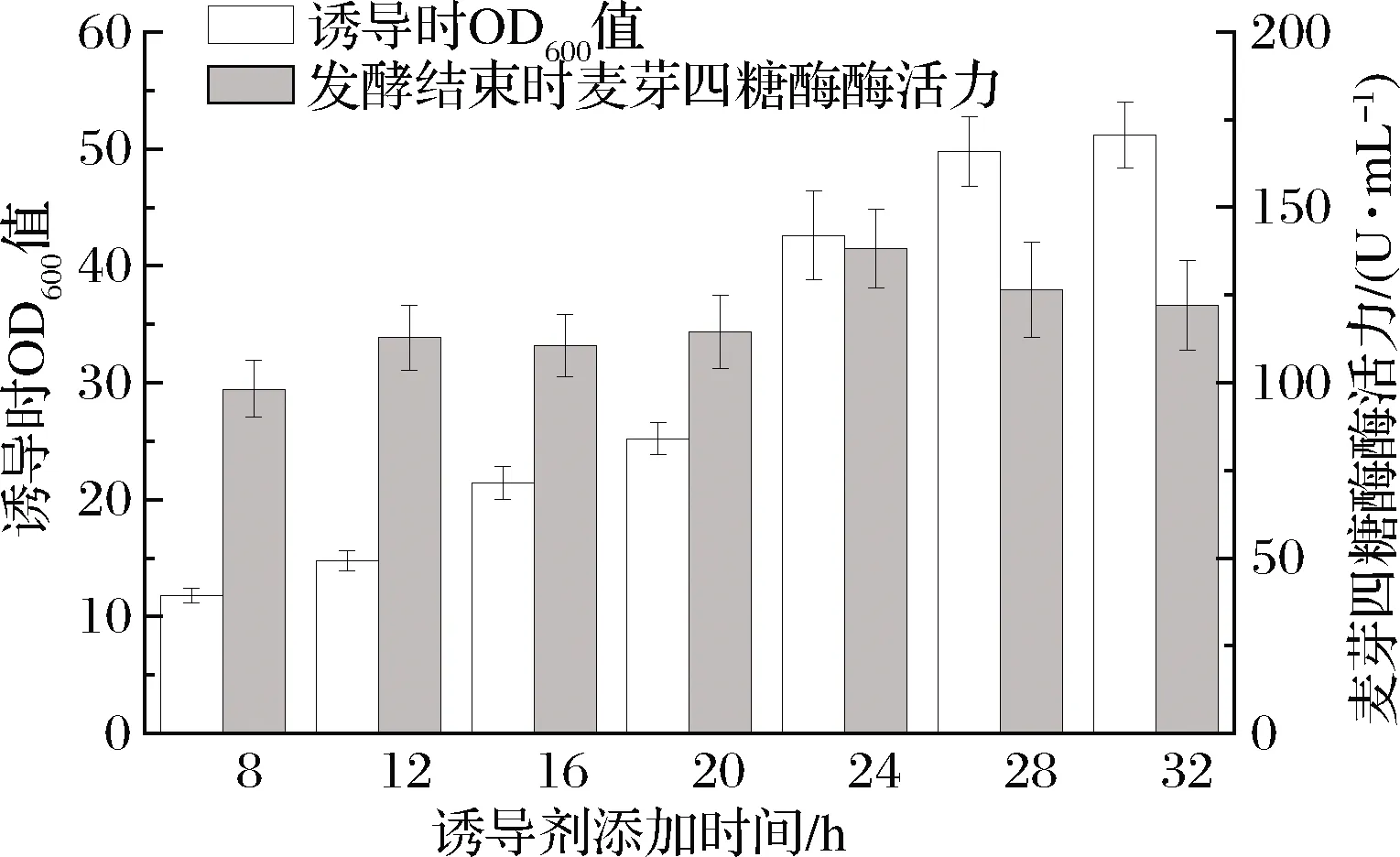
图4 诱导剂不同添加时间对重组菌表达麦芽四糖酶的影响Fig.4 Effect of different adding time of inducer on the expression of maltotetraose in recombinant bacteria
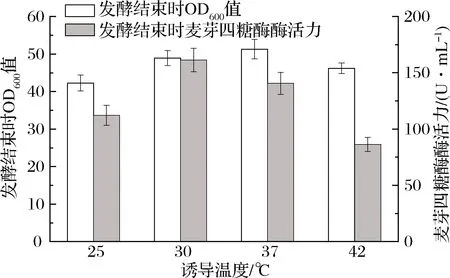
图5 诱导温度对重组菌表达麦芽四糖酶的影响Fig.5 Effect of induction temperature on the expression of maltotetraose in recombinant bacteria
2.3.3 发酵时间对发酵的影响
根据2.3.1和2.3.2的结果,在37 ℃、250 r/min下对重组菌进行培养,当培养至24 h时,添加2%木糖进行诱导,并转移至30 ℃继续发酵。诱导后每隔12 h检测菌体量OD600和麦芽四糖酶酶活。结果如图6所示。可以看到,发酵至84 h时,胞外检测到的最大酶活力为(168.2±9.41) U/mL,之后酶活力明显开始下降。显然,重组地衣芽孢杆菌胞外酶活力开始下降的时间要略晚于稳定期,这与2.3.1小节所记录的特性相符,表明木糖诱导型重组地衣芽孢杆菌发酵至稳定期结束时停止发酵最为合适。
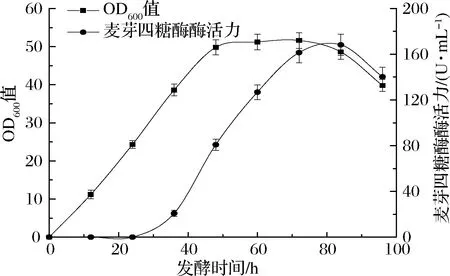
图6 重组地衣芽孢杆菌发酵过程曲线Fig.6 Growth and maltotetraose production curves of recombinant Bacillus licheniformis
在后续应用过程中,对重组酶的酶学性质进行了简单研究。以淀粉液为化液底物反应时,其最适pH为7.0,最适反应温度为50 ℃,并且在反应48 h后,相对酶活力仍能达50%以上,结合异淀粉酶进行转化,麦芽四糖转化率可达72.4%,其特性与文献报道[5-7]基本一致,表明重组酶的酶学性质未发生明显改变,有良好的应用前景。目前,国内对麦芽四糖酶的发酵还处于基础研究阶段,多见于在大肠杆菌、枯草芽孢杆菌中的表达,在地衣芽孢杆菌中的表达未见报道。杨亚楠等[7]在以枯草芽孢杆菌表达来源于嗜糖假单胞麦芽四糖酶的表达时,摇瓶水平酶活力可力达147 U/mL,本研究摇瓶水平酶活力可达(168.2±9.41) U/mL,较之有所提高,但提高有限。多项研究显示,地衣芽孢杆菌胞外蛋白分泌量可达枯草芽孢杆菌的2倍[9],这表明地衣芽孢的表达性能仍未被完全开发,其优势尚未完全发挥,可提升的空间仍然很大。据报道[1],美国杰能科公司也是通过重组地衣芽孢杆菌分批补料发酵,表达嗜糖假单胞菌的麦芽四糖酶,根据该酶的比酶活[7]及地衣芽孢杆菌的产酶特性,保守估计其发酵水平应在10 000 U/mL左右。就本研究结果来看,尽管继续通过发酵优化能够继续提升发酵水平,但提升效果可能有限,还需要充分挖掘地衣芽孢杆菌的表达潜力,提升其表达能力,诸如在密码子偏好性[16],酶蛋白修饰[17],蛋白酶基因继续敲除[18],高效启动子开发[19-20]等方面均可继续进行深入研究。
3 结论
本研究利用地衣芽孢杆菌木糖诱导分泌表达载体,对来源于嗜糖假单胞菌麦芽四糖基因进行了表达,重组酶成功地分泌至胞外,能够在发酵液上清液中检测到酶活力,而且目标蛋白大小符合理论大小。对重组菌进行了发酵条件优化:在24 h添加诱导剂,诱导温度30 ℃,发酵至稳定期结束停止发酵,摇瓶水平可高达(168.2±9.41) U/mL。
