后肾腺瘤的临床特征及文献分析(附82例报告)
2021-01-20杨谊吴凌枫陈立新唐春华苏元华
杨谊 吴凌枫 陈立新 唐春华 苏元华
后肾腺瘤(metanephric adenoma, MA)是发生于肾脏的罕见肿瘤,发病率约为成人肾脏上皮源性肿瘤的0.2%~0.7%,常见于50~60岁患者,男女比例约为1∶2[1]。当前缺乏大宗病例报告。现对我院病例及检索万方数据库、中国知网等部分病例进行总结,并结合文献对其临床诊断与治疗方法进行讨论。
对象与方法
一、一般资料
患者,女,45岁,体检发现右肾占位2 d入院,患者感尿液中泡沫较多1年余,平时无腰酸、腰痛,无尿急、尿痛,无胸闷、胸痛,无畏寒发热,无明显肉眼血尿,无腹泻、黑便。查体:一般情况好,心肺阴性,腹软无压痛,肝脾未及,移动性浊音(-)。上腹部未及肿大肾脏,双肾叩击痛(-),双输尿管行径区无压痛,膀胱区无隆起,压痛(-)。辅助检查:血常规、尿常规、凝血功能均正常,血钾3.5 mmol/L,血氯106 mmol/L。B超:右肾占位,左肾尿酸盐结晶。双肾CT平扫+增强:双侧肾脏平扫示双侧对称,位于脊柱两侧,大小正常,增强后右肾门水平后侧实质内见一直径约20 mm低密度灶,边界较清楚,略向后膨出,平扫呈等密度,CT值为40 HU,增强后为60 HU,密度均匀。双侧肾盂、输尿管未见明显扩张,肾周脂肪囊清楚,肾旁结构未见明显异常。腹膜后未见明显肿大淋巴结(图1、2)。诊断为右肾占位,性质待定,建议MR检查。
MRI平扫加增强:右肾中部后份皮质区见直径约1.5 cm类圆形异常信号灶,边界清楚,T1WI呈等信号,T2WI呈低信号,未见明显脂肪信号,增强扫描呈轻度强化改变。双肾肾盂未见扩张,形态良好。右肾中部外侧份及左肾上部见多个小囊样异常信号灶,直径2~5 mm不等,T1WI呈低信号,T2WI呈高信号,增强扫描未见明显强化。双侧肾上腺对称,信号未见明显异常。肾周间隙未见明显异常,筋膜未见明显增厚(图3、4)。诊断为右肾中部后份皮质区肿瘤,考虑良性肿瘤可能性大,建议穿刺活检。左肾上部多发囊肿,右肾中部外侧份小囊肿。术前诊断为右肾肿瘤(性质待定)。

图1 CT平扫图 图2 CT增强图 图3 MRI平扫图 图4 MRI增强图
二、治疗方法
患者在全麻下行开放右肾肿瘤剜除术,术中阻断肾动脉时间约15 min,于肿瘤边缘约0.5 cm左右钝性剜除肿瘤组织后用止血纱布填塞,用可吸收线缝合创口。
结 果
患者手术顺利,手术时间约90 min,术中出血约50 ml。术中见右肾肿瘤最大径约2.5 cm,表面光滑,突出于肾脏表面,位于中部背侧,与周围边界清。病理检查:巨检显示圆形组织1块,切面偏一侧见结节,大小2.5 cm×1.5 cm×1.6 cm,部分有包膜,边界清楚,淡黄色,质中(图5)。镜检显示肿瘤细胞排列紧密,呈腺泡状,间质不明显;肿瘤细胞形态单一,细胞核小、一致,染色质细腻,核仁不明显,核分裂象未见(图6、7)。免疫组化:CK7(-),EMA(-),Vim(+),AE1部分(+),AE3(-),CEA(-),Ki-67<5%(+)(图8)。病理诊断:右肾MA。本例随访至今11年余仍无瘤生存。
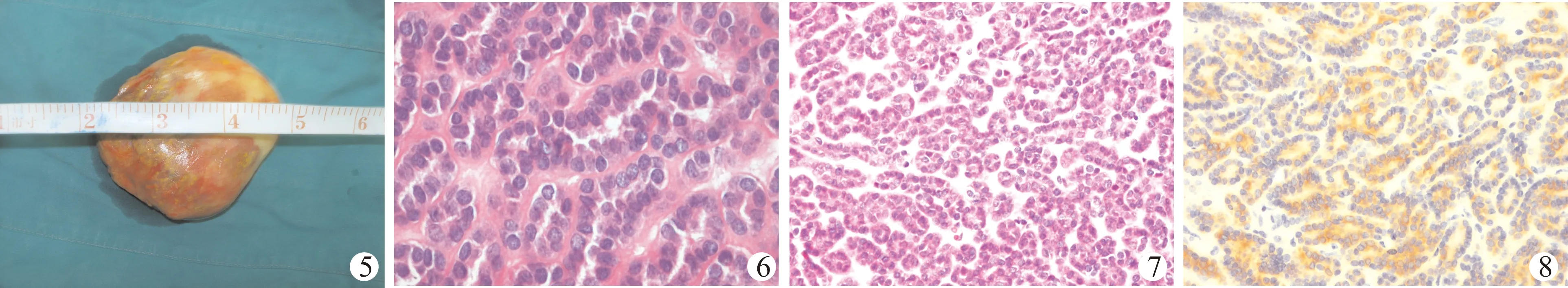
图5 手术切除肿物所示图 图6 镜下所见(HE染色,×100) 图7 镜下所见(HE染色,×200) 图8 免疫组化(EnVision法,×100)
我们检索了万方数据库,中国知网(2005年1月至2019年12月)等具有代表性的科研论文19篇,其中报道的病例数共81例,详细资料见表1。
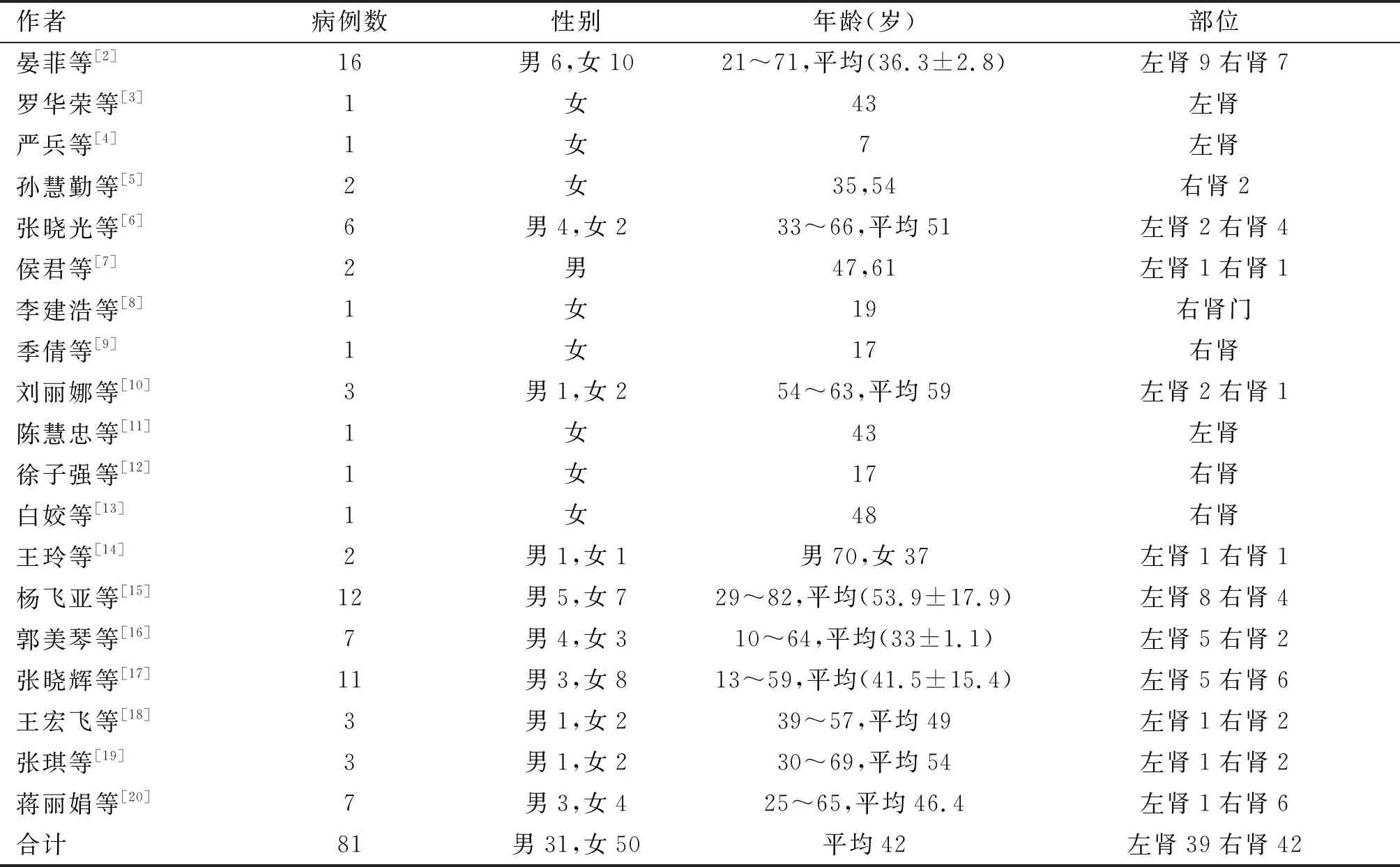
表1 检索文献的具体数据
讨 论
MA是一种非常罕见的肾脏良性肿瘤,1992年Brisigotti等[21]将其命名为MA。1998年WHO肾脏肿瘤病理组织学分型指出,肾腺瘤是来源于肾脏上皮组织的良性肿瘤,包括肾嗜酸细胞腺瘤、肾乳头状腺瘤和MA。2003年Kuroda等[22]认为MA、后肾腺纤维瘤和后肾基质性肿瘤在组织学上均属于后肾肿瘤,生物学行为为良性。
本病以女性为多见,男女比例约为1∶2(统计病例相似),年龄范围5~83岁不等。临床上可有疼痛、血尿和扪及肿块,但多数患者症状和体征不明显或在体检中发现,约40%病例是因其他疾病就诊,偶尔发现,本例亦如此;12%左右的患者可出现红细胞增多,B超对MA无特异性诊断价值,一般提示肿瘤大小及高、低回声肿块或等回声、高回声[23]。一般为实质性肿块。易与错构瘤相混淆,血管、平滑肌、脂肪其超声特点为强回声,其内回声往往不均匀。关于MA的影像学表现,由于病例少见缺乏认识,易引起误诊。一般来说,CT平扫表现为圆形或类圆形肿块,边界清楚,外生性生长明显,密度较肾实质高,均匀或欠均匀,有的少量钙化。CT动态增强扫描可见肿瘤有一定程度的强化,且具有延迟强化的特征。与典型的肾细胞癌有所不同,后者具有“快进快出”的强化方式,且皮质期强化非常明显,信号强度可高于肾皮质,并且强化常不均匀。季倩等[9]认为CT平扫肿瘤密度高于周围正常组织密度,而增强CT其强化程度低于邻近正常肾组织,应考虑MA可能。刘炜等[23]认为CT检查亦有表现为平扫肿瘤边界清晰,多为等密度或均匀性高密度,可见钙化,中央区缺血坏死,增强后实质部分多无或轻度强化,中央坏死区不强化等特点;有MR报道:在T1WI上肿瘤与其他组织为等信号,T2WI上病灶为低信号。本例与刘炜等报道相同,稍有差别的是未见明显脂肪信号,增强扫描呈轻度强化改变。尹克杰等[24]认为MRI表现为平扫肿块T1WI信号比正常肾实质略低,T2WI肿块信号均匀或不均匀,不均匀者由于肿块区内有坏死区,假包膜、出血、囊变坏死较少见,肿块内无瘢痕、脂肪及脂质。增强扫描病灶呈缓慢持续性强化。延迟扫描病变边缘清晰,信号均匀,略低于肾髓质的少血供病变。目前从影像学表现上很难对MA做出准确的术前诊断,但是,影像学检查中如果看到外生性明显的肾肿块,且T2WI呈低信号或具有延迟强化的特点,应考虑MA可能。组织病理学:①大体检查:肿瘤大小不一,包膜完整,实性,褐色或粉红色,偶见出血囊性物。本例表现圆形组织1块,切面偏一侧见结节,大小2.5 cm×1.5 cm×1.6 cm,部分有包膜,边界清楚,淡黄色,质中。②光镜检查,肿瘤的主体为小而不成熟,染色较深的立方状上皮细胞形成很小的腺泡或小管,形态相当一致,偶尔有肾小球样的乳头状结构形成,少数细胞可以扩张。瘤细胞无异型性,无核分裂象或罕见核分裂象。间质可以深染,无或很少间质细胞,可以分布在小腺泡之组织结构类似肾母细胞瘤灶的错构瘤成分,不含有后肾胚芽。部分肿瘤可出现坏死,少量沙砾体和骨小梁。本例患者肿瘤细胞排列紧密,呈腺泡状,间质不明显;肿瘤细胞形态单一,细胞核小,一致,染色质细腻,核仁不明显,核分裂象未见。③电镜观察:肿瘤细胞大小相对一致,不成熟,核无极性,胞质内细胞器稀少,排列成小管状或花环状。有时可以看到上皮细胞腔面有微绒毛,肿瘤灶小且周围有较为丰富的基底膜围绕。④免疫组织化学:多数细胞胞质S-100蛋白阳性,偶有蛋白(uimentin)阳性,菌酶和len7阳性。主要为膜着色。可有少数排列成乳头状或大管状的瘤细胞上皮抗原(emA)阳性;瘤细胞lenm1和HMB-45阴性。其免疫组织化学特征与胎儿肾的S状小体很类似。本例患者表现为:CK7(-),EMA(-),Vim(+),AE 1部分(+),AE 3(-),CEA(-),Ki-67<5%(+)。
鉴别诊断:①上皮性wilms瘤:刘宝安等[25]认为该瘤上皮成分较不成熟,在光镜和超微结构上类似于上皮型wilms瘤,诊断较为困难。然而二者区分开来又十分重要,MA细胞形态以极低或无核分裂活性量对鉴别两者的关系有帮助。②乳头状肾细胞癌:刘丽娜等[10]认为乳头状肾细胞癌需要重点鉴别,因为小管、肾小球、实性结构均与MA相似,前者肉眼或镜下常多灶性,胞质丰富,核仁明显,EMA及CK7均为阳性。③嗜酸细胞瘤:属于肾脏良性肿瘤,男性多于女性,多为单侧病变,大多数属于富血供的肿瘤;CT上可见肿瘤病灶中央星状稍低密度瘢痕影,是该病的典型征象[26]。
MA通常被认为是肾脏良性肿瘤,预后良好,无恶性潜能,行单纯肿块切除术或肾切除术后即可达到治愈目的。但Pins等[27]报道1例MA出现骨转移;Renshaw等[28]报道1例MA出现肾门、腹主动脉旁及腹主动脉分叉出现淋巴结转移。因此,相对不典型的细胞学特征和转移潜能,MA并不能被完全认为是良性病变,应对患者密切随访观察。
综上所述,MA是罕见的肾脏上皮肿瘤,临床和影像学特征不明显,术后病理检查才能确诊。免疫组织化学染色对其诊断及鉴别诊断有一定的价值。MA预后良好,但其生物学行为存在争议,术后仍需定期随访。