基于PAK6和Wnt/β-catenin信号通路的苦参碱对肺癌放疗敏感性的影响研究
2021-01-19李修炜王记南
李修炜,王记南,张 健
基于PAK6和Wnt/β-catenin信号通路的苦参碱对肺癌放疗敏感性的影响研究
李修炜,王记南,张 健
周口市中心医院 放疗科,河南 周口 466000
探究苦参碱对肺癌放疗敏感性的影响和作用机制。人非小细胞肺癌A549细胞分为对照组、2 Gy放疗组、4 Gy放疗组、苦参碱组、苦参碱联合2 Gy组、苦参碱联合4 Gy组、甘氨双唑钠联合2 Gy组、甘氨双唑钠联合4 Gy组,通过克隆形成、细胞增殖、细胞凋亡评价苦参碱对A549细胞放疗敏感性的影响;建立裸鼠皮下移植瘤模型,分为对照组、5 Gy放疗组、苦参碱组、苦参碱联合5 Gy组、甘氨双唑钠联合5 Gy组,记录小鼠瘤体积;Western blotting法检测A549细胞和小鼠瘤组织中β-连环蛋白(β-catenin)、p21激活蛋白激酶6(p21-activated protein kinase,PAK6)、c-myc、半胱氨酸蛋白酶3(Caspase-3)的表达。与单独放疗组相比,苦参碱联合放疗组A549细胞克隆形成、细胞增殖显著降低(<0.001),细胞凋亡显著增加(<0.001),裸鼠肿瘤体积显著降低(<0.001),细胞和裸鼠肿瘤组织中PAK6、c-myc、磷酸化β-catenin蛋白表达显著下调(<0.05、0.01、0.001),Caspase-3蛋白表达显著上调(<0.001)。苦参碱通过干扰PAK6表达,抑制Wnt/β-连环蛋白(Wnt/β-catenin)信号通路,从而提高肺癌的放疗敏感性。
肺癌;苦参碱;p21激活蛋白激酶6;Wnt/β-catenin信号通路;放疗敏感性
肺癌作为癌症之首,患者生存率仅15%,根据组织学差异将其分为小细胞肺癌和非小细胞肺癌,非小细胞肺癌又分为腺癌、鳞状细胞癌和大细胞癌[1]。肺癌早期临床症状不明显,大多数患者确诊时已发展为中晚期,预后较差[2]。目前肺癌的治疗方式主要为手术治疗和放疗,约65%非小细胞肺癌患者需要进行放疗来提高治疗效果,但长期的放疗会产生放疗敏感性降低、组织损伤等不良反应[3],因此选择科学合理的用药方式联合放疗以提高放疗的敏感性,对肺癌的临床治疗至关重要。
苦参碱是从豆科槐属植物苦参Alt. 中提取到的生物碱,对肿瘤有显著的治疗效果[4-6]。研究表明,苦参碱不仅可以抑制肿瘤细胞增殖,促进肿瘤细胞凋亡,还能够提高胃癌、乳腺癌等癌症的放疗敏感性[7-11]。苦参碱对肺癌放疗的作用及机制尚不明确,本研究通过考察苦参碱对肺癌放疗的影响和机制,为肺癌的临床治疗提供参考。
1 材料与仪器
1.1 细胞
人非小细胞肺癌A549细胞购自中国科学院上海生命科学研究所。
1.2 动物
SPF级Balb/c雌性裸鼠25只,4周龄,体质量18~20 g,购自郑州大学实验动物中心,合格证号SYXK(豫)2018-0004,饲养于恒温恒湿12 h昼夜交替的SPF级动物房内。所有动物实验遵循周口市中心医院有关实验动物管理和使用的规定,均符合3R原则。
1.3 药品与试剂
苦参碱(批号519-02-8,质量分数98%)购自上海迈瑞尔化学技术有限公司;甘氨双唑钠(批号201205284,质量分数95.0%)购自山东绿叶制药有限公司;DMEM培养基、胎牛血清购自美国Gibco公司;BCA蛋白定量试剂盒、MTT检测试剂盒、细胞凋亡检测试剂盒购自沈阳万类生物技术有限公司;p21激活蛋白激酶6(p21-activated protein kinase,PAK6)抗体、半胱氨酸蛋白酶3(Casepase-3)抗体、c-myc抗体、磷酸化β-连环蛋白(β-catenin)抗体、β-catenin抗体、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体、山羊抗兔IgG抗体均购自美国CST公司。
1.4 仪器
酶标仪(美国Thermo Fisher Scientific公司);23Ex医用高能电子直线加速器(美国Varian公司);流式细胞仪(美国Beckman公司);电子显微镜(日本Nikon公司);电泳仪(上海天能科技有限公司)。
2 方法
2.1 细胞培养
将于液氮保存的A549细胞于37 ℃水浴锅中迅速解冻,并用含10%胎牛血清的DMEM培养基于37 ℃、5% CO2培养箱中培养,当细胞生长至融合率达80%时进行传代,取对数生长期的细胞进行后续实验。
2.2 苦参碱对A549细胞增殖的影响
取对数生长期的A549细胞,以4×103/孔接种于96孔板,设置对照组和苦参碱(2、4、8 μmol/L,苦参碱以DMEM培养基溶解)组。细胞贴壁后,更换为含不同浓度苦参碱的DMEM培养基,对照组加入不含药物的培养基,分别培养24、48、72 h后,每孔加入20 μL MTT溶液孵育4 h,加入200 μL DMSO,采用酶标仪于490 nm处测定吸光度()。
2.3 苦参碱联合放疗对A549细胞增殖的影响
取对数生长期的A549细胞以4×103/孔接种于96孔板,设置对照组、2 Gy放疗组、4 Gy放疗组、苦参碱(4 μmol/L)组、苦参碱(4 μmol/L)联合2 Gy组、苦参碱(4 μmol/L)联合4 Gy组、甘氨双唑钠(25 μg/mL)联合2 Gy组、甘氨双唑钠(25 μg/mL)联合4 Gy组。苦参碱、甘氨双唑钠分别以DMEM培养基溶解,细胞贴壁后对照组加入不含药物的培养基,各给药组更换为含相应药物的DMEM培养基,各放疗组经2、4 Gy的电离辐射后,每孔加入20 μL MTT溶液孵育4 h,加入200 μL DMSO,采用酶标仪于490 nm处测定。
电离辐射条件:美国Varian 23Ex医用高能电子直线加速器,6 MV X射线,照射时细胞培养皿覆盖2 cm厚的有机玻璃板,照射源距离为100 cm,剂量率为3.2 Gy/min。
2.4 苦参碱联合放疗对A549细胞克隆形成的影响
将处于对数生长期的A549细胞以3×102/孔的密度接种于6孔板中,设置对照组、2 Gy放疗组、4 Gy放疗组、苦参碱(4 μmol/L)组、苦参碱(4 μmol/L)联合2 Gy组、苦参碱(4 μmol/L)联合4 Gy组、甘氨双唑钠(25 μg/mL)联合2 Gy组、甘氨双唑钠(25 μg/mL)联合4 Gy组。苦参碱、甘氨双唑钠分别以DMEM培养基溶解,对照组加入不含药物的培养基,各给药组加入含相应药物的DMEM培养基,各放疗组用2、4 Gy的X线照射,于培养箱中培养10~20 d,每7天更换1次培养基。当出现肉眼可见的克隆时终止培养,弃去培养基,于无水乙醇固定30 min,加入1 mL 0.01%结晶紫孵育1 h,弃去染色液,清洗后于显微镜下统计单克隆集落数,计算集落形成率。
集落形成率(PE)=集落数/接种细胞数
2.5 苦参碱联合放疗对A549细胞凋亡的影响
将处于对数生长期的A549细胞以5×105/孔接种于6孔板中,设置对照组、2 Gy放疗组、4 Gy放疗组、苦参碱(4 μmol/L)组、苦参碱(4 μmol/L)联合2 Gy组、苦参碱(4 μmol/L)联合4 Gy组、甘氨双唑钠(25 μg/mL)联合2 Gy组、甘氨双唑钠(25 μg/mL)联合4 Gy组。苦参碱、甘氨双唑钠分别以DMEM培养基溶解,对照组加入不含药物的培养基,各给药组加入含相应药物的DMEM培养基,各放疗组用2、4 Gy的X线照射。按照细胞凋亡检测试剂盒说明书,取5×105个细胞于离心管中,加入500 μL Binding Buffer重悬,加入5 μL Annexin V-FLTC、5 μL PI染料,混匀后室温避光孵育15 min,并设置Annexin V-FLTC和PI单阳性组用于调节荧光补偿,空白组用于调电压。采用流式细胞仪检测样品的荧光值,使用FlowJo v5.573软件分析细胞凋亡数。
2.6 苦参碱联合放疗对裸鼠皮下移植瘤模型的影响
根据预实验和文献报道[11-12],裸鼠适应性饲养1周后,随机分为对照组、5 Gy放疗组、苦参碱(50 mg/kg)组、苦参碱(50 mg/kg)联合5 Gy组、甘氨双唑钠(25 mg/kg)联合5 Gy组,每组5只。收集处于对数生长期的A549细胞,以PBS重悬,调整细胞密度为1×108/mL;75%乙醇溶液消毒小鼠左侧腋下,于裸鼠左侧腋下sc 100 μL A549细胞。苦参碱、甘氨双唑钠溶于生理盐水,当裸鼠肿瘤体积达100 mm3时,小鼠每2天ig 100 μL相应药物,对照组ig等体积生理盐水;放疗组小鼠每3天放疗1次。治疗期间隔天测量并计算瘤体积,给药3周后,小鼠脱颈椎处死,取肿瘤组织。
2.7 苦参碱联合放疗对A549细胞和肿瘤组织中PAK6、Casepase-3、c-myc、β-catenin蛋白表达的影响
取肿瘤组织50 mg于离心管中,加入250 μL RIPA蛋白裂解液和2.5 μL的PMSF蛋白酶抑制剂,冰上匀浆后12 000×、4 ℃离心10 min,取上清,即为组织总蛋白。取经苦参碱联合放疗后的A549细胞,加入200 μL RIPA蛋白裂解液和2 μL PMSF蛋白酶抑制剂,冰上裂解后12 000×、4 ℃离心10 min,取上清,即为细胞总蛋白。
BCA蛋白定量后于沸水浴加热变性,经SDS-PAGE凝胶电泳分离,转至PVDF膜,用5%脱脂牛奶封闭2 h,加入PAK6、Casepase-3、c-myc、磷酸化β-catenin、β-catenin、GAPDH抗体(1∶1000)于4 ℃孵育过夜,TBST洗涤后加入二抗,于室温孵育1.5 h,TBST洗涤后按照ECL试剂盒说明书配制发光液,将PVDF膜浸入发光液中反应0.5 min,曝光并拍照,用Image J软件进行分析。
2.8 统计学分析
3 结果
3.1 苦参碱对A549细胞增殖的影响
如图1所示,与对照组相比,苦参碱(2、4、8 μmol/L)组作用24、48、72 h后,A549细胞活力均显著下降(<0.001),说明苦参碱能够有效抑制A549细胞增殖。结合文献报道[9],选择中剂量4 μmol/L苦参碱进行后续实验。
3.2 苦参碱联合放疗对A549细胞增殖的影响
如图2所示,与对照组相比,除2 Gy放疗组外,其余各组细胞活力均显著降低(<0.05、0.01、0.001);与2 Gy放疗组相比,2 Gy放疗联合苦参碱、2 Gy放疗联合甘氨双唑钠组细胞活力显著降低(<0.001);与4 Gy放疗组相比,4 Gy放疗联合苦参碱、4 Gy放疗联合甘氨双唑钠组细胞活力显著降低(<0.001);与甘氨双唑钠联合放疗组相比,苦参碱联合放疗组细胞活力无显著差异。表明苦参碱能够增加A549细胞放疗的敏感性,与放疗增敏剂甘氨双唑钠效果相当。
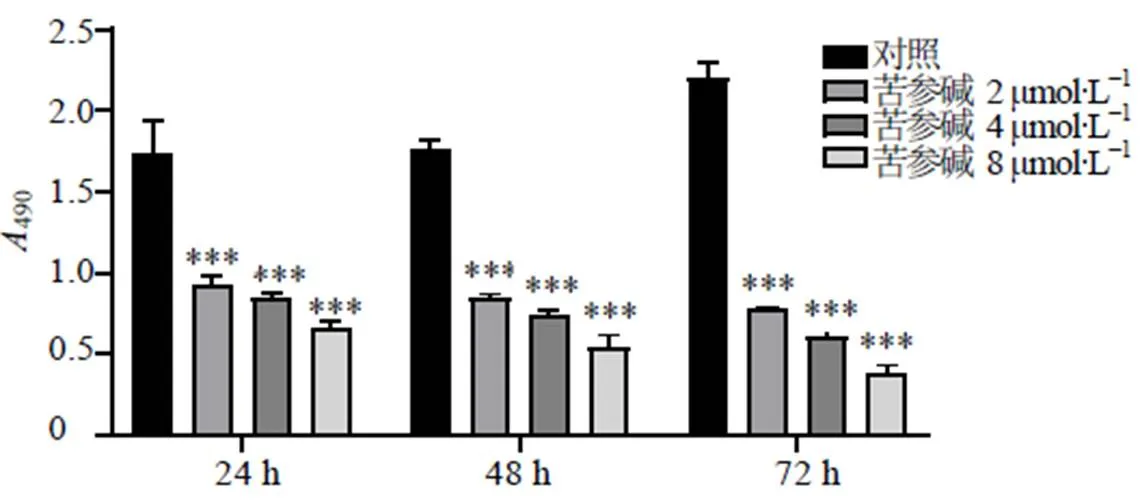
与对照组比较:***P<0.001
3.3 苦参碱联合放疗对A549细胞克隆形成的影响
如图3所示,对照组、2 Gy放疗组、4 Gy放疗组、苦参碱组、苦参碱联合2 Gy组、苦参碱联合4 Gy组、甘氨双唑钠联合2 Gy组、甘氨双唑钠联合4 Gy组细胞克隆形成率分别为(59.36±2.29)%、(58.67±1.13)%、(34.06±2.30)%、(38.09±1.08)%、(26.33±0.87)%、(19.04±1.18)%、(24.42±3.19)%(16.34±1.97)%。与对照组相比,除2 Gy放疗组外,其余各组细胞克隆形成率均显著降低(<0.001);与2、4 Gy放疗组比较,苦参碱联合放疗、甘氨双唑钠联合放疗组细胞克隆形成率显著降低(<0.001);苦参碱联合放疗组与甘氨双唑钠联合放疗组细胞克隆形成率无显著差异。表明苦参碱能够显著提高A549细胞的体外放疗敏感性。
3.4 苦参碱联合放疗对A549细胞凋亡的影响
如图4所示,对照组、2 Gy放疗组、4 Gy放疗组、苦参碱组、苦参碱联合2 Gy组、苦参碱联合4 Gy组、甘氨双唑钠联合2 Gy组、甘氨双唑钠联合4 Gy组细胞凋亡率分别为(4.28±1.07)%、(4.07±0.43)%、(6.20±0.20)%、(6.11±1.34)%、(12.93±2.06)%、(29.33±1.15)%、(14.06±0.27)%、(27.43±2.11)%。与对照组相比,除2 Gy放疗组外,其余各组细胞凋亡率均显著升高(<0.05、0.001);与2 Gy、4 Gy放疗组比较,苦参碱联合放疗、甘氨双唑钠联合放疗组细胞凋亡率显著升高(<0.001);苦参碱联合放疗组与甘氨双唑钠联合放疗组细胞凋亡率无显著差异。表明苦参碱联合放疗能够显著增加细胞的放疗敏感性。
3.5 苦参碱联合放疗对裸鼠皮下移植瘤的影响
如图5所示,与对照组比较,各组裸鼠瘤体积均显著降低(<0.01、0.001);与5 Gy放疗组比较,5 Gy联合苦参碱组和5 Gy联合甘氨双唑钠组裸鼠瘤体积均显著降低(<0.001),表明苦参碱能够显著增加裸鼠肺癌放疗敏感性。
3.6 苦参碱联合放疗对A549细胞和肿瘤组织中PAK6、Casepase-3、c-myc、β-catenin蛋白表达的影响
如图6所示,A549细胞中,与对照组比较,除2 Gy放疗组中仅c-myc蛋白表达显著降低外(<0.001),其余各组PAK6、c-myc、磷酸化β-catenin蛋白表达均显著降低(<0.05、0.01、0.001),Caspase-3蛋白表达显著升高(<0.01、0.001);与2、4 Gy放疗组比较,苦参碱联合放疗组、甘氨双唑钠联合放疗组PAK6、c-myc、磷酸化β-catenin显著降低(<0.05、0.01、0.001),Caspase-3蛋白表达显著升高(<0.01、0.001),表明苦参碱能够下调A549细胞PAK6表达,抑制Wnt/β-catenin信号通路,促进细胞凋亡。

与对照组比较:*<0.05**<0.01***<0.001;与2 Gy组比较:#<0.05##<0.01###<0.001;与4 Gy组比较:aaa<0.001
*< 0.05**< 0.01***< 0.001control group;#< 0.05##< 0.01###< 0.0012 Gy group;aaa< 0.0014 Gy group
图6 苦参碱联合放疗对A549细胞PAK6、Caspase-3、β-catenin、c-myc蛋白表达的影响
Fig. 6 Effect of matrine combined with radiotherapy on expressions of PAK6, Caspase-3, β-catenin and c-myc in A549 cells
如图7所示,皮下移植瘤裸鼠中,与对照组比较,各组PAK6、c-myc、磷酸化β-catenin蛋白表达均显著降低(<0.05、0.01、0.001),苦参碱联合放疗组、甘氨双唑钠联合放疗组Caspase-3蛋白表达显著升高(<0.001);与5 Gy放疗组比较,苦参碱联合放疗组、甘氨双唑钠联合放疗组PAK6、c-myc、磷酸化β-catenin显著降低(<0.001),Caspase-3蛋白表达显著升高(<0.001),表明苦参碱能够下调裸鼠皮下移植瘤模型PAK6表达,抑制Wnt/β-catenin信号通路。
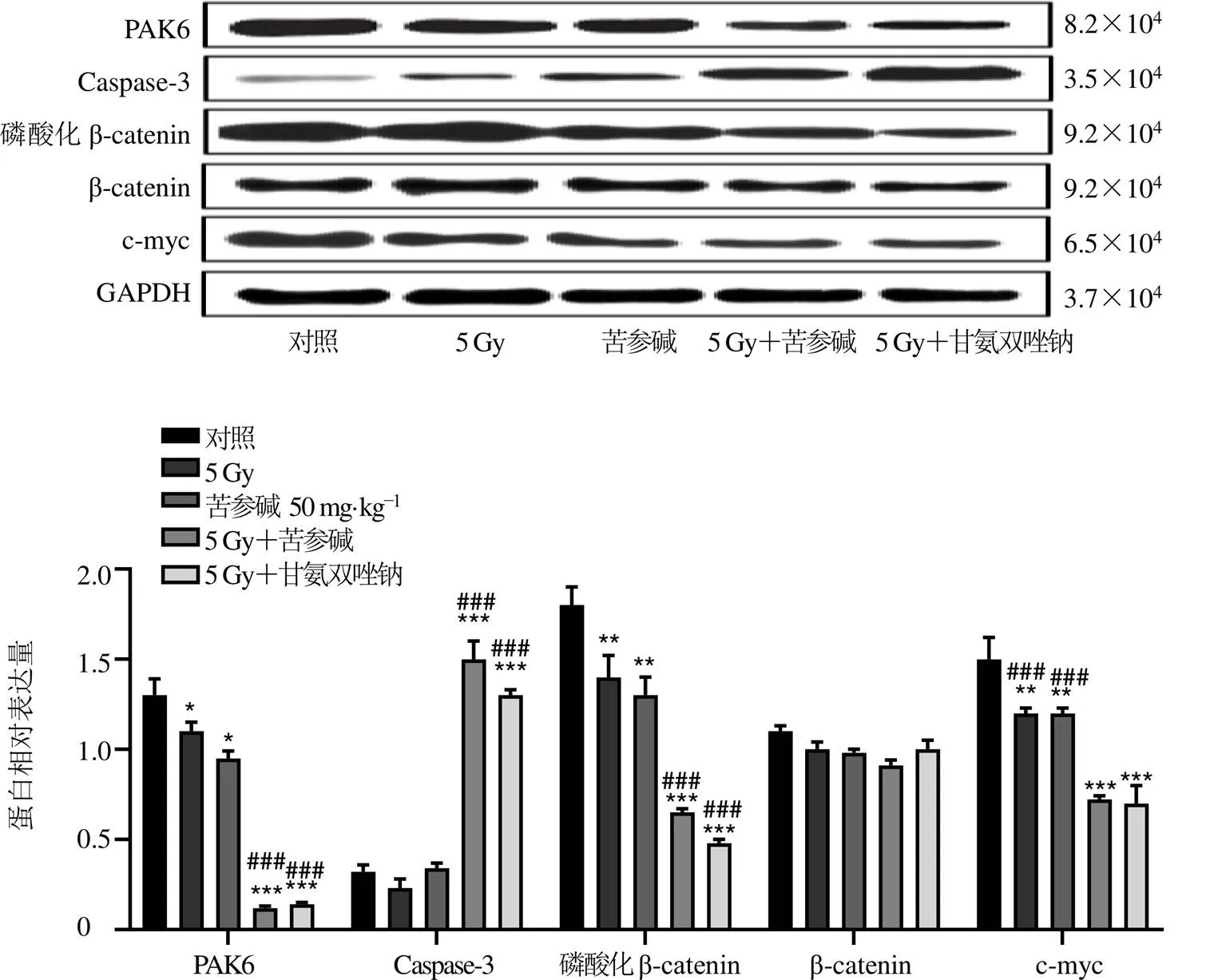
与对照组比较:*P<0.05 **P<0.01 ***P<0.001;与5 Gy组比较:###P<0.001
4 讨论
肺癌是世界上发病率和死亡率最高的恶性肿瘤,其主要治疗方式为手术和放疗,虽然目前较先进的三维立体放疗技术可以显著提高放疗的效果,但放疗敏感性问题仍未得到解决[13]。增加放疗频率和剂量是提高肿瘤放疗敏感性的主要手段,但其造成的严重肺损伤不利于患者的预后[14]。中药复合物、中药单体等用于肿瘤具有治疗效果良好、不良反应小等特点,因此越来越多的研究集中在中药联合放疗治疗肿瘤。苦参碱是从豆科槐属植物苦参中提取到的生物碱,可有效抑制肿瘤的增殖和迁移,但其联合放疗治疗肺癌尚未有明确的研究。本研究发现苦参碱联合放疗对A549细胞的增殖、克隆形成的抑制作用和对细胞凋亡的促进作用显著优于单独放疗;与单独放疗相比,苦参碱联合放疗可显著抑制裸鼠皮下移植瘤模型肿瘤的生长,表明苦参碱可提高放疗的治疗效果,增加放疗的敏感性。
PAK是一种丝氨酸/苏氨酸激酶,能够调控细胞形态维持、骨架支撑等[15]。研究表明,PAK6在肺癌、乳腺癌、前列腺癌等癌症中高表达,可促进肿瘤的发生发展[16-18]。本研究发现放疗后A549细胞中PAK6蛋白表达显著降低;苦参碱联合放疗后PAK6蛋白表达下调更加显著,表明苦参碱能够下调肺癌细胞PAK6蛋白表达,从而提高放疗的敏感性。细胞凋亡是一个复杂的细胞程序性死亡的过程,由细胞内多种基因共同调控。Caspase-3是Caspase蛋白家族的成员之一,是细胞凋亡的执行因子,Caspase-3活化后,酶切Caspase-3表达升高,细胞凋亡进入不可逆阶段。研究表明,干扰肿瘤细胞PAK6的表达可促进凋亡蛋白Caspase-3表达[19-20]。本研究发现苦参碱联合放疗可显著增加Caspase-3蛋白表达,提示苦参碱可能通过抑制PAK6表达,促进Caspase-3表达,进而促进细胞凋亡。Wnt/β-catenin信号通路是肿瘤细胞内经典的信号转导通路,可调控肿瘤的生长和转移,病理条件状态下,Wnt/β-catenin信号通路激活,β-catenin与其他蛋白分子结合形成复合物,调控相关蛋白的表达,促进肿瘤的发生发展[21]。c-myc是Wnt信号通路下游的靶基因,调控原癌基因和抑癌基因的表达。PAK家族蛋白与Wnt/β-catenin信号通路的激活密切相关[22-23]。本研究发现与单独放疗相比,苦参碱联合放疗能够显著抑制Wnt/β-catenin信号通路和下游c-myc的激活。
综上所述,苦参碱能够提高肺癌的放疗敏感性,其机制可能与抑制PAK6表达和Wnt/β-catenin信号通路,进而调控肿瘤细胞的生长和凋亡有关。
利益冲突 所有作者均声明不存在利益冲突
[1] Liu C C, Shi J F, Liu G X,. Cost-effectiveness of lung cancer screening worldwide: A systematic review [J]., 2019, 40(2): 218-226.
[2] Franciosi V, Barbieri R, Aitini E,. Gemcitabine and oxaliplatin: A safe and active regimen in poor prognosis advanced non-small cell lung cancer patients [J]., 2003, 41(1): 101-106.
[3] 张洁, 张小陆, 于杰, 等. 治疗前中性粒细胞与淋巴细胞比值对小细胞肺癌患者预后的意义 [J]. 河北医科大学学报, 2019, 40(3): 292-295.
[4] 曹建, 魏润杰, 邓茹芸, 等. 苦参碱及氧化苦参碱抑制肿瘤作用机制研究进展及展望[J].中草药, 2019, 50(3): 753-760.
[5] 张明发, 沈雅琴. 苦参碱的药动学研究进展[J].药物评价研究, 2020, 43(12): 2571-2578.
[6] 毛俐, 汪广杰, 张鑫, 等. 氧化苦参碱及苦参碱Au(III)金属配合物对肿瘤细胞增殖的影响及分子机制初探 [J]. 中草药, 2019, 50(3): 639-646.
[7] Zhao L, Zhang X, Cui S. Matrine inhibits TPC-1 human thyroid cancer cells via the miR-21/PTEN/Akt pathway [J]., 2018, 16(3): 2965-2970.
[8] 刘平, 陈晓杰. 苦参碱上调LncRNA BDNF-AS抑制宫颈鳞癌细胞增殖的机制研究[J]. 中草药, 2020, 51(6): 1593-1599.
[9] Luo C, Zhu Y, Jiang T,. Matrine induced gastric cancer MKN45 cells apoptosis via increasing pro- apoptotic molecules of Bcl-2 family [J]., 2007, 229(3): 245-252.
[10] 庞琪, 朱燕, 李陶, 等. 苦参碱通过抑制microRNA- 192调控顺铂耐受肺腺癌A549细胞对顺铂的敏感性 [J]. 中草药, 2019, 50(3): 653-658.
[11] Xiao X, Ao M, Xu F,. Effect of matrine against breast cancer by downregulating the vascular endothelial growth factor via the Wnt/β-catenin pathway [J]., 2018, 15(2): 1691-1697.
[12] 曾晖, 邹冰, 谭慧珍, 等. 苦参碱联合5-FU抑制人胃癌裸鼠移植瘤的生长作用及机制[J]. 广州中医药大学学报, 2006, 23(2): 164-167.
[13] 李红, 张震, 黄建敏, 等. 细胞因子诱导的杀伤细胞治疗晚期肺癌的临床观察 [J]. 郑州大学学报: 医学版, 2019, 54(3): 348-352.
[14] Rydén A, Blackhall F, Kim H R,. Patient experience of symptoms and side effects when treated with osimertinib for advanced non-small-cell lung cancer: A qualitative interview substudy [J]., 2017, 10(5): 593-603.
[15] Cai S W, Dong-Xia L I, Jun A N,. PAK6 signaling attenuates migratory and invasive abilities of non-small cell lung cancer cells [J]., 2014, 30(1): 67-71.
[16] Raja R, Sahasrabuddhe N A, Radhakrishnan A,. Chronic exposure to cigarette smoke leads to activation of p21 (RAC1)-activated kinase 6 (PAK6) in non-small cell lung cancer cells [J]., 2016, 7(38): 61229- 61245.
[17] Lee S R, Ramos S M, Ko A,. AR and ER interaction with a p21-activated kinase (PAK6) [J]., 2002, 16(1): 85-99.
[18] Kaur R, Xin Y, Lu M L,. Increased PAK6 expression in prostate cancer and identification of PAK6 associated proteins [J]., 2010, 68(14): 1510-1516.
[19] Zhao W, Yang J, Shi W,. Upregulation of p21- activated Kinase 6 in rat brain cortex after traumatic brain injury. [J]., 2011, 42(3): 195-203.
[20] Chen J, Lu H, Yan D,. PAK6 increase chemoresistance and is a prognostic marker for stage II and III colon cancer patients undergoing 5-FU based chemotherapy [J]., 2014, 6(1): 355-367.
[21] 朱睿明, 邢方岚, 张起顺, 等. miRNA-21过表达对乳鼠星形胶质细胞凋亡及Wnt/β-catenin信号通路相关蛋白表达的影响 [J]. 郑州大学学报: 医学版, 2018, 53(6): 768-771.
[22] Chen W, Xu W H. Wnt/β-catenin signaling regulatespupal development by up- regulating c-Myc and AP-4 [J]., 2014, 53: 44-53.
[23] Romero L E A, Cruz O V, Chernoff J. Pak1 links the Wnt/β-catenin pathway to ErbB2 signaling in breast cancer cells [J]., 2012, 73(12): 3671-3682.
Sensitivity of matrine to radiotherapy for lung cancer based on PAK6 and Wnt/β-catenin signaling pathways
LI Xiu-wei, WANG Ji-nan, ZHANG Jian
Radiotherapy Department of Zhoukou Central Hospital, Zhoukou 466000, China
To explore the effect and mechanism of matrine on radiosensitivity of lung cancer.Human non- small cell lung cancer A549 cells were divided into control group, 2 Gy radiotherapy group, 4 Gy radiotherapy group, matrine group, matrine combined with 2 Gy group, matrine combined with 4 Gy group, glycinazole sodium combined with 2 Gy group and glycinazole sodium combined with 4 Gy group; Clonal formation, cell proliferation, apoptosis were used to evaluate the effect of matrine on radiosensitivity of A549 cells. Subcutaneous transplantation tumor model in nude mice was established, which were divided into control group, 5 Gy radiotherapy group, matrine group, matrine combined with 5 Gy radiotherapy group, glycinazole sodium combined with 5 Gy radiotherapy group, tumor volume of mice were recorded; Western blotting was used to detect the expressions of β-catenin, p21-activated protein kinase (PAK6), c-myc and Caspase-3.Compared with radiotherapy group, the cell maturation and proliferation were significantly reduced (< 0.001), cell apoptosis was significantly increased (< 0.001), tumor volume of nude mice was reduced (< 0.001), the expressions of PAK6, c-myc and phosphorylation-β-catenin on A549 cells and tumor tissues were significantly downregulated (< 0.05, 0.01, 0.001), the expression of Caspase-3 was significantly increased (< 0.001) in matrine combined with radiotherapy group.Matrine could improve radiosensitivity of lung cancer through inhibiting the expression of PAK6 and Wnt/β-catenin signaling pathway.
lung cancer; matrine; PAK6; Wnt/β-catenin signaling pathway; radiotherapy sensitivity
R285.5
A
0253 - 2670(2021)02 - 0447 -07
10.7501/j.issn.0253-2670.2021.02.018
2020-06-20
河南省科技攻关项目(116108351126)
李修炜,硕士,主治医师,从事肿瘤相关研究。Tel: 18736236899 E-mail: lixiuwei1984@126.com
[责任编辑 李亚楠]
