银耳多糖为乳化剂制备槲皮素微乳研究
2021-01-19王君文尹启蒙李学艳易金玉黄莹颖吴文惠张朝燕
王君文,尹启蒙,李学艳,易金玉,黄莹颖,吴文惠, 2, 3, 4,张朝燕, 2, 3, 4*
银耳多糖为乳化剂制备槲皮素微乳研究
王君文1,尹启蒙1,李学艳1,易金玉1,黄莹颖1,吴文惠1, 2, 3, 4,张朝燕1, 2, 3, 4*
1. 上海海洋大学食品学院,上海 201306 2. 国家淡水水产品加工技术研发分中心,上海 201306 3. 上海水产品加工及贮藏工程技术研究中心,上海 201306 4. 农业部水产品贮藏保鲜质量安全风险评估实验室,上海 201306
研究以银耳多糖为乳化剂的槲皮素微乳处方和制备工艺。通过溶解度考察、配伍试验和伪三元相图的绘制优选微乳处方;采用银耳多糖为天然乳化剂,以油相、混合乳化剂及助乳化剂比例为考察因素,粒径、载药量及多分散指数(PDI)为评价指标,采用星点设计-效应面法优化槲皮素微乳处方并对其性质、溶出度及稳定性进行评价。槲皮素微乳处方中油相为三乙酸甘油酯(36%)、乳化剂为银耳多糖(23%)和聚山梨酯80(23%),助乳化剂为PEG400(18%);所得微乳外观均一透明,乳化后平均粒径为(25.04±0.94)nm,Zeta电位为(−13.20±0.68)mV,PDI为0.311±0.030,载药量为(30.17±1.02)mg/g;溶出度实验表明,槲皮素60 min在人工肠液和人工胃液的累积溶出度为87.95%和70.47%;储存稳定性实验、高速离心和高温实验结果表明,微乳的质量稳定。槲皮素微乳制备工艺简单,可以增加槲皮素的溶解度和溶出度,为相关制剂的进一步研究与开发提供参考。
槲皮素;银耳多糖;微乳;伪三元相图;星点设计-效应面法;溶出度;稳定性
槲皮素是一种黄酮类化合物,具有抗病毒、抗氧化、抗癌、抗炎、抗菌、心血管系统保护等多种功能[1-2],并且无致癌、致死等反应[3]。但槲皮素的水溶性极差,仅为15.86 μg/mL[4-5]。口服吸收差、生物利用度低是槲皮素主要的缺点。而微乳是水、油、乳化剂和助乳化剂按适当的比例混合,自发形成的各向同性,透明,热力学稳定的分散体系[6],可以提高难溶性物质的溶解度,增加药物与胃肠道的接触面积,促进药物的吸收。
微乳体系中乳化剂的使用至关重要,乳化剂能够改善乳液中各种构成相之间的表面张力,使之形成均匀稳定的分散体系。近年来,银耳多糖作为一种天然的乳化剂,其乳化性被学者们广泛研究。黄晓德等[7]研究了不同温度、银耳多糖浓度、pH、NaCl浓度条件下,银耳多糖对桉叶油的乳化能力。结果表明,银耳多糖对桉叶油有较好的乳化性。Zhang 等[8]在比较银耳多糖、魔芋胶和阿拉伯胶的乳化性时,发现银耳多糖具有更好的乳化稳定性,可较长时间保持乳化效果。张珊珊等[9]将银耳多糖作为一种乳化剂和增稠剂添加到花生蛋白饮料中,所制备的花生蛋白饮料体系稳定,稠度和黏度与市售相当。但目前,尚未有报道将银耳多糖作为乳化剂来制备微乳的方法。因此,本实验以槲皮素为原料药,以银耳多糖为天然乳化剂,和合成乳化剂聚山梨酯80(T80)混合使用,来制备槲皮素微乳。然后通过星点设计-效应面法优化处方,以期增大槲皮素的溶解度,为相关新剂型的研究奠定基础,同时为银耳多糖应用于微乳乳化剂中提供参考。
1 材料
1.1 仪器
ZEN3600型纳米粒度仪,英国Malvern公司;85-2型恒温磁力搅拌器,上海司乐仪器有限公司;H1650离心机,湘仪离心机仪器有限公司;RCZ-8型药物溶出度仪,上海黄海药检仪器有限公司;BSA224S型电子分析天平,上海舜宇恒平科学仪器有限公司;XW-80A 型旋涡混合仪,海门市其林贝尔仪器有限公司;L-2130液相色谱仪,日立高新技术集团;TECNAI F30透射电子显微镜(TEM),美国FEI公司。
1.2 试剂
槲皮素原料药(批号117-39-5,质量分数96%)、聚乙二醇800(PEG800)、普鲁兰多糖,九鼎化学科技有限公司;槲皮素对照品,批号117-39-5,质量分数98.5%,上海晶纯生化科技股份有限公司;银耳多糖,批号SQYE20190916,质量分数70%,西安圣青生物科技有限公司;胃蛋白酶、胰蛋白酶,国药集团化学试剂有限公司;磷酸二氢钾、氢氧化钠,上海凌峰化学试剂有限公司;聚乙二醇400(PEG400),兰拓生物科技有限公司;阿拉伯胶,阿拉丁生化科技股份有限公司;海藻多糖,索莱宝生物科技有限公司;00号透明胶囊壳,江苏长禾胶囊有限公司;油酸乙酯、三乙酸甘油酯、蓖麻油、大豆油、橄榄油、聚山梨酯20(T20)、T80、乙醇,均购于麦克林试剂有限公司。
2 方法与结果
2.1 银耳多糖的乳化性
银耳多糖的乳化性测定参照文献方法[10],分别称取5 mg银耳多糖、阿拉伯胶、普鲁兰多糖、海藻多糖,加入100 mL的蒸馏水,不断搅拌,配制成5 mg/mL的溶液,分别取50 mL溶液与等体积的三乙酸甘油酯混合,5000 r/min下均质1 min,将液体转移至10 mL离心管中,60 ℃水浴加热30 min后冷却至室温,于5000 r/min离心5 min,观察离心管内乳浊液的乳化情况。按照以下公式计算样品的乳化性(ES)。结果如表1所示,银耳多糖的ES值要大于阿拉伯胶、普鲁兰多糖、海藻多糖。表明,银耳多糖的乳化性要优于阿拉伯胶、普鲁兰多糖和海藻多糖。所以,将银耳多糖作为微乳的乳化剂具有一定的可行性。
ES=/
为乳化层高度,为离心管内液体总高度
2.2 槲皮素的含量测定
2.2.1 色谱条件[11]Waters C18色谱柱(250 mm×4.6 mm,5 μm);流动相为甲醇-0.4%磷酸水溶液(60∶40);体积流量1 mL/min;检测波长374 nm;进样量10 μL;柱温30 ℃;色谱图见图1。
2.2.2 对照品溶液的配制 精密称取槲皮素15 mg于50 mL量瓶中,甲醇溶解稀释,配制成质量浓度为300 μg/mL的对照品储备液。
2.2.3 供试品溶液的配制 精密量取微乳适量,置于100 mL量瓶中,甲醇超声破乳溶解并定容,摇匀,0.45 μm滤膜滤过,取续滤液,即得。
2.2.4 线性关系考察 分别取对照品溶液,甲醇稀释配制成质量浓度分别为6、15、30、60、150、300 μg/mL的系列槲皮素对照品溶液。在“2.2.1”项色谱条件下进样测定。以进样量为横坐标(),峰面积为纵坐标()进行线性回归,得回归方程=23.546+2.343 1,2=0.999 1,线性范围为6~300 μg/mL。
2.3 槲皮素在辅料中溶解度测定[12]
采用振摇法测定槲皮素在油相(油酸乙酯、三乙酸甘油酯、蓖麻油、大豆油、橄榄油)、乳化剂(T80、银耳多糖、T20)和助乳化剂(乙醇、丙三醇、PEG400、PEG800)中的饱和溶解度。精密称取上述辅料各2 g于西林瓶中,加入过量的槲皮素,涡旋混合1 min后,37 ℃下连续振荡24 h,于5000 r/min离心15 min,取上清液用甲醇稀释,按照“2.2”项方法测定槲皮素的质量浓度。
原则上采取对槲皮素有较高溶解度的油相、乳化剂、助乳化剂作为微乳的组成成分,以防止在储存过程中药物析出结晶[13]。槲皮素在各种油相、乳化剂和助乳化剂中的饱和溶解度如表2所示。在筛选的油相中,槲皮素在蓖麻油和三乙酸甘油酯中的溶解度最高,分别为2.31、2.08 mg/mL;在筛选的乳化剂中,在T20中的溶解度最高,为24.12 mg/mL;在筛选的助乳化剂中,在PEG400和PEG800中溶解度最高,分别为166.28、72.37 mg/mL。基于结果,最终选择蓖麻油和三乙酸甘油酯作为油相,PEG400和PEG800作为助乳化剂进一步用于处方的筛选。
2.4 配伍试验
2.4.1 油相与乳化剂的筛选 分别将油相(蓖麻油、三乙酸甘油酯)与乳化剂(T80、银耳多糖、T20)按照质量比为1∶9、2∶8、3∶7、4∶6、5∶5涡旋混合5 min,室温下静置,取空白微乳1 g,滴入100 mL的蒸馏水,100 r/min磁力搅拌,观察乳化情况,根据目测评价标准进行等级分类[13]。结果显示,在考察的用量比例范围之内,三乙酸甘油酯与T80、银耳多糖、T20配伍后相容性和乳化性能均较好,而蓖麻油与乳化剂配伍后相容性和乳化性能较差,形成白色凝胶物状,因此选择三乙酸甘油酯作为油相。因现有的合成乳化剂中不管用于何种给药途径,均不同程度地出现各种毒性[14-15],聚山梨酯类中T20的毒性大于T80,因此选用T80和银耳多糖作为乳化剂。
2.4.2 助乳化剂的筛选 分别将银耳多糖和T80与PEG400和PEG800按质量比1∶1混合,再将混合物与油相按质量比1∶9、2∶8、3∶7、4∶6、5∶5涡旋混合5 min,室温下静置,取空白微乳1 g,滴入100 mL的蒸馏水,100 r/min磁力搅拌,观察助乳化剂乳化情况。结果显示,PEG400和PEG800助乳化性能相似,因PEG400的载药量较大,且具有与各种溶剂的广泛相容性,是很好的溶剂和增溶剂,所以选择PEG400作为助乳化剂。
2.5 伪三元相图的绘制[16]
通过伪三元相图确定银耳多糖和T80比例,将银耳多糖和T80以1∶1、2∶1、1∶2混匀,再与PEG400按1∶1混匀,然后按质量比1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1,加入三乙酸甘油酯,磁力搅拌条件下,滴加蒸馏水至形成澄清透明的微乳,记录临界变化的加水量。通过Origin 9.1软件将临界点时三乙酸甘油酯、银耳多糖、T80、水各自质量分数绘制成伪三元相图,其3个顶点分别为油相、混合乳化剂、水。将能形成澄清或带有蓝色乳光的实验点定为伪三元相图中可形成微乳的处方点,连接这些点与水相顶点形成的封闭区域,即为微乳区[16],结果见图2,微乳区域面积越大,可形成微乳的处方越佳,最终确定银耳多糖和T80最佳比例为1∶1。
2.6 星点设计-效应面法优化处方
2.6.1 试验设计 星点设计是效应曲面中常用的设计方法,具有试验次数少、精度高等特点,其应用较为成熟[17-18]。本研究选择对微乳形成有显著影响的2个因素作为考察指标,即油相质量分数(1)、混合乳化剂与助乳化剂的比例m(2),油相质量比范围为10%~40%,m值为0.5~3.0,两因素的对应水平见表3。以微乳的载药量、粒径以及粒径的PDI为指标,确定最优处方。按照表4中处方比例精密称取油相、混合乳化剂、助乳化剂,涡旋混匀1 min,得空白微乳。精密称取空白微乳2 g,加入过量的槲皮素,涡旋混匀1 min,37 ℃下连续振荡24 h,得槲皮素微乳。精密称取槲皮素微乳1 g,加37 ℃水10 mL,100 r/min磁力搅拌至乳化完全,纳米粒度仪测定粒径和PDI。精密称取槲皮素微乳0.5 g,5000 r/min离心15 min,取上清液用甲醇稀释至适宜质量浓度,按照“2.2”项的方法进行测定,计算载药量。
2.6.2 模型拟合和方差分析 使用Design-Expert 8.0软件对数据进行多元回归线性拟合,得到2次多项式方程=0+11+22+312+412+522;而以载药量、粒径和PDI对数据进行拟合得到的回归方程分别为1=29.99-29.141-25.772+36.2312+13.8612+8.5222,2=0.998 9,2adj=0.997 4,<0.000 1;2=21.09+11.901-19.702-7.1312+5.2212+14.8022,2= 0.980 3,2adj=0.960 7,<0.01;3=0.45+0.161-0.122-0.05412+8.6612-0.07622,2=0.958 7,2adj=0.950 3,<0.01。再进行方差分析,可知各模型<0.01,模型水平显著;失拟项>0.05,相对于纯水平误差不显著;2、2adj均>0.95。表明2次多项式拟合结果较好,具有代表性,能客观准确地根据自变量的变化进行预测[12]。
2.6.3 效应面分析 由图3-a可知,随着油相比例的增加,微乳的载药量显著降低;当油相比例一定时,微乳的载药量随着m(混合乳化剂/助乳化剂)值的增加而减小,原因可能是m值越小,PEG400的含量越高,载药量越大。由图3-b可知,乳化后的粒径随着油相比例的增加而增大,适当地减少油相的比例,增加乳化剂的含量可使微乳的粒径减小。由图3-c可知,m值越大,乳化剂含量越高,PDI值越小,微乳体系越稳定。根据拟合方程,Design-Expert 8.0软件三维效应面图综合分析结果,在实验室范围内以载药量大小、粒径和PDI为原则,确定最优处方油相(三乙酸甘油酯)、乳化剂(银耳多糖-T80 1∶1)、助乳化剂(PEG400)质量比为36∶46∶18,即1=35.61,2=2.63。
2.6.4 最佳处方验证 最佳处方油相(三乙酸甘油酯)、乳化剂(银耳多糖-T80 1∶1)和助乳化剂(PEG400)的比例为36∶46∶18。测得的平均粒径为(25.04±0.94)nm,PDI值为0.311±0.030,最大载药量为(30.17±1.02)mg/g。结果见表5,可知实际值与预测值相当,所建模型预测性良好。
2.7 处方质量评价
2.7.1 外观和形态 在室温(20 ℃)下,槲皮素微乳呈现黄色。将微乳浓缩液用蒸馏水稀释100倍后,可得澄清透明的黄色溶液。取槲皮素微乳适量,37 ℃水稀释100倍,取适量微乳滴在铜网上,10 min后,用滤纸吸去多余液体,2%磷钨酸溶液负染色2 min,晾干后,于透射电镜下观察[13],结果显示,微乳液滴较小,呈球形(图4)。

图3 因素X1、X2对槲皮素微乳处方载药量(a)、粒径(b)和PDI (c)影响的效应面
2.7.2 粒径、PDI和Zeta电位 取槲皮素微乳0.1 g加入10 mL水中,搅拌均匀,取1 mL加入样品池,轻轻震摇,放入ZEN3600型纳米粒度仪中,测定粒径分布及Zeta电位。每份样品测定3次,取平均值。结果显示,槲皮素微乳的平均粒径为(25.04±0.94)nm,PDI值为0.311±0.030,Zeta电位值为(−13.20±0.68)mV。表明所制备的微乳粒径较小,分布较窄,体系较稳定。

图4 槲皮素微乳TEM图(100 nm)
2.8 溶出度评价
溶出度的测定方法参照文献报道[11],分别以人工胃液(simulated gastric fluid,SGF)、人工肠液(simulated intestinal fluid,SIF)、水作为溶出介质,体积均为500 mL,温度为(37.0±0.5)℃,搅拌桨转速为(50±1)r/min。将1 g槲皮素微乳(30 mg槲皮素原料药)放入00号透明胶囊壳中,开启仪器,分别在5、10、20、30、45、60 min取出溶出介质5 mL,同时补足等温等体积溶出介质,按照“2.2”项的方法,测定槲皮素的含量。同法,将30 mg原料药加入透明胶囊壳中,按照上述操作测槲皮素原料药累积溶出率,绘制溶出曲线,结果见图5。由图可知,SIF和SGF可以显著提高药物的溶出速率,10 min时药物已基本溶出。60 min时,槲皮素微乳在SIF、SGF、水中溶出速率已达到87.95%、70.47%、29.62%,而槲皮素原料药在SIF、SGF、水中的溶出速率仅为20.09%、13.91%、9.13%。在SIF、SGF、水中,以微乳的形式,槲皮素的溶出速率分别提高了67.86%、56.56%、20.49%,溶出度实验表明微乳可有效提高槲皮素的溶出速率。
2.9 稳定性实验
稳定性实验参照国家食品药品监督管理局于2006年颁布的《中药、天然药物稳定性研究技术指导原则》。
2.9.1 储存稳定性实验 将微乳常温放置60 d,分别于第0、1、3、7、15、30、60 d测定微乳的粒径、电位、PDI、载药量,结果见表6。30 d时,微乳的粒径、电位、PDI、载药量变化趋于稳定,且微乳外观澄清透明,无分层现象。储存稳定性实验表明,所制备的微乳体系较稳定。
2.9.2 高速离心实验 取微乳1 g于10 000 r/min离心15 min,离心后微乳外观澄清透明,无沉淀,无分层现象。
2.9.3 温度对微乳稳定性的影响 将4份等量微乳分装玻璃瓶中,拧紧瓶盖。分别于70、80、90、100 ℃下水浴加热30 min后,冷却至室温。24 h后观察微乳的外观、测定微乳的粒径及粒径分布、Zeta电位及药物含量有无变化[19]。结果显示,外观上微乳未出现分层、沉淀等现象;70~100 ℃处理后微乳的粒径由25.04 nm增大到35.78 nm,粒径分布图上微乳仍然呈现单峰,但微乳的体积分数减小,微乳的数量分布略有缩小(图6),可能热处理使粒子对乳化剂的吸附作用减弱,乳胶粒周围的双电层减薄,粒子聚并增多。
不同加热处理后微乳Zeta电位和槲皮素的质量分数变化如图7所示,电位由−13.2 mV上升到−9.11 mV;而微乳中槲皮素的质量分数由76.5%降到74.37%,降低2.13%。结果表明乳液经过热处理后仍然维持较好的贮藏稳定性,所制备的微乳体系较为稳定。
3 讨论
微乳处方的筛选关键在于合适的油相、乳化剂和助乳化剂。其中,油相的种类影响微乳的乳化效果,而本实验选择的三乙酸甘油酯与乳化剂和助乳化剂的配伍效果较好。乳化剂的种类和用量将影响乳滴的粒径,进而影响微乳的稳定性。高HLB的乳化剂可以促进水包油型微乳的形成及促进其在水中的扩散。本实验选择的T80具有较高的HLB值(15.0),可以抑制P-糖蛋白对药物的外排作用[20],促进药物的吸收。而天然乳化剂银耳多糖具有一定的分子极性,可以与油滴微表面以范德华力的形式相互结合,防止液滴之间的聚合[21],且多糖具有一定的黏度,可以削弱油滴分子之间因布朗运动而造成的自动聚合[22],有效提高乳液的稳定性。本实验筛选的助乳化剂PEG400已广泛应用于食品、药品领域,具有安全性高、稳定性好等优点,且槲皮素在其中的溶解度最高,选择其作为助乳化剂对提高微乳的载药量及稳定性具有重要意义。
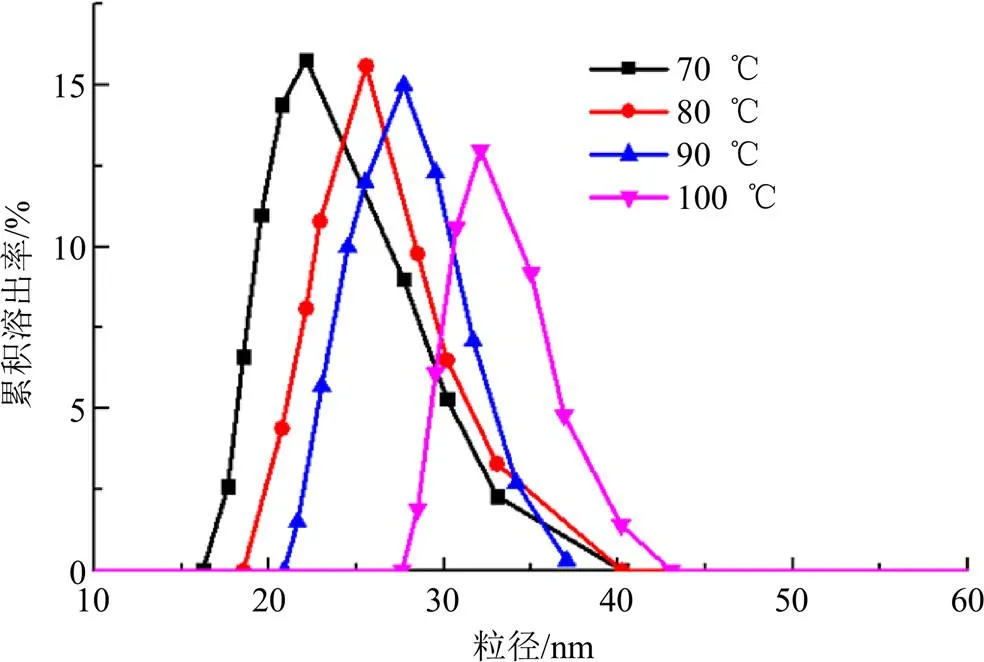
图6 不同温度处理后微乳的粒径分布图

图7 不同温度处理后微乳的Zeta电位和槲皮素质量分数
传统微乳中乳化剂浓度过高引起的毒性是限制其应用的主要因素之一。所以,有研究学者使用天然乳化剂阿拉伯胶来制备微乳。陈莉等[23]研究阿拉伯胶对绿原酸自微乳体内外性能的影响。结果表明,含阿拉伯胶的新型绿原酸自微乳在十二指肠、空肠、回肠的吸收量增加,新型绿原酸自微乳可以促进绿原酸在小肠的吸收。黄嗣航等[24]在对比含有阿拉伯胶的新型葛根素自微乳和传统自微乳性能中发现,新型葛根素自微乳和传统自微乳性的自乳化速率基本一致,含阿拉伯胶的自微乳对葛根素的促进吸收效果优于传统自微乳。而阿拉伯胶和银耳多糖属于天然乳化剂,且都具有葡萄糖醛酸等结构。所以,含银耳多糖的槲皮素微乳可能比传统的槲皮素微乳吸收效果更好,在体内应用方面具有一定的发展前景。
溶出度实验是模拟药物在体内溶出的关键步骤。在溶出度实验中,在SIF、SGF 60 min时槲皮素的累积释放率可达到87.95%、70.47%,相较于槲皮素原料药,槲皮素微乳呈现释放率高的特点。因此,本研究成功制备了含天然乳化剂银耳多糖的槲皮素微乳,降低了T80的一半用量,提高了槲皮素的溶出度,具有一定的实用价值和经济价值,为天然药物的研究应用提供了新的思路,后续将从其药效、临床应用等方面开展研究。
利益冲突 所有作者均声明不存在利益冲突
[1] Li Y, Deng Y, Tang Y,. Quercetin protects rat hepatocytes from oxidative damage induced by ethanol and iron by maintaining intercellular liable iron pool [J]., 2014, 33(5): 534-541.
[2] 徐浩, 高艺璇, 王向涛. 槲皮素磺酸化衍生物合成及其体内外抗肿瘤研究 [J]. 药物评价研究, 2018, 41(11): 1945-1950.
[3] 谭启. 槲皮素磷脂-壳聚糖纳米粒制剂及其经皮给药的研究 [D]. 济南: 山东大学, 2012.
[4] 平其能. 中药成分的胃肠转运与剂型设计 [M]. 北京: 化学工业出版社, 2010: 424-426.
[5] 邓卓丹, 陈文学, 兰思琪, 等. 玉米醇溶蛋白-卵磷脂-槲皮素纳米颗粒的制备与抗氧化特性 [J]. 食品与发酵工业, 2019, 45(23): 103-108.
[6] Baxamusa S, Ehrmann P, Ong J. Acoustic activation of water-in-oil microemulsions for controlled salt dissolution [J]., 2018, 529: 366-374.
[7] 黄晓德, 钱骅, 赵伯涛, 等. 银耳粗多糖对桉叶油的乳化性研究 [J]. 中国野生植物资源, 2014, 33(1): 9-11.
[8] Zhang J, Zhang Y K, Liu Y,. Emulsifying properties of: A novel promising food emulsifier [J]., 2019, 15(3/4).
[9] 张姗姗, 吴琼, 王冰聪. 银耳多糖对花生蛋白饮料稳定性的影响 [J]. 食品科技, 2017, 42(7): 200-204.
[10] 王艺涵, 吴琴, 迟原龙, 等. 酸碱法和酶法辅助提取银耳粗多糖的特性研究 [J]. 食品科技, 2019, 44(4): 200-204.
[11] 胡英, 陈海靓, 梁文权. 槲皮素自乳化释药系统的制备和质量评价 [J]. 中国中药杂志, 2007, 32(9): 805-807.
[12] 马祖兵, 李小芳, 谢龙, 等. 大黄素-桂皮醛自微乳的制备及体外评价 [J]. 中成药, 2019, 41(1): 1-7.
[13] 张小飞, 果秋婷, 邹俊波, 等. 黄芪甲苷自乳化释药系统的制备及大鼠在体肠吸收研究 [J]. 中草药, 2019, 50(13): 3037-3043.
[14] Fatouros D G, Karpf D M, Nielsen F S,. Clinical studies with oral lipid based formulations of poorly soluble compounds [J]., 2007, 3(4): 591-604.
[15] Patel A R, Vavia P R. Preparation andevaluation of SMEDDS (self-microemulsifying drug delivery system) containing fenofibrate [J]., 2007, 9(3): E344-E352.
[16] 赵惠茹, 史洋, 陈红, 等. 芦丁自微乳处方的优化 [J]. 中成药, 2019, 41(1): 23-26.
[17] 吴伟, 崔光华. 星点设计-效应面优化法及其在药学中的应用 [J]. 国外医学: 药学分册, 2000, 27(5): 292-298.
[18] 江兴龙. 葛根素自微乳化释药系统及其固体化研究 [D]. 重庆: 重庆医科大学, 2013.
[19] 张云天. 青砖茶多糖的理化特性及乳化活性研究 [D].武汉: 湖北工业大学, 2018.
[20] Rao Z C, Si L Q, Guan Y B,. Inhibitive effect of cremophor RH40 or tween 80-based self-microemulsiflying drug delivery system on cytochrome P450 3A enzymes in murine hepatocytes [J]., 2010, 30(5): 562-568.
[21] 张伟玲, 刘晓娟. 槲皮素自微乳制剂的制备 [J]. 山东大学学报: 医学版, 2016, 54(3): 41-44, 49.
[22] 倪石磊. 槲皮素微纳米载体的制备与评价 [D]. 南京: 东南大学, 2015.
[23] 陈莉, 侯成贤, 杨燕飞. 天然乳化剂阿拉伯胶对绿原酸自微乳体内外性能的影响 [J]. 中国药房, 2017, 28(25): 3502-3505.
[24] 黄嗣航, 龙晓英, 袁飞, 等. 含天然乳化剂的新型葛根素自微乳与传统自微乳体内外性能的对比研究 [J]. 中国药学杂志, 2014, 49(17): 1530-1534.
Preparation of quercetin microemulsion withpolysaccharide as emulsifier
WANG Jun-wen1, YI Qi-meng1, LI Xue-yan1, YI Jin-yu1, HUANG Ying-ying1, WU Wen-hui1, 2, 3, 4, ZHANG Chao-yan1, 2, 3, 4
1. Food Science School, Shanghai Ocean University, Shanghai 201306, China 2. National Freshwater Aquatic Products Processing Technology R&D Center, Shanghai 201306, China 3. Shanghai Seawater Product Processing and Storage Engineering Technology Research Center, Shanghai 201306, China 4. Ministry of Agriculture Aquatic Product Storage Quality and Safety Risk Assessment Laboratory, Shanghai 201306, China
To study the prescription and preparation process of quercetin microemulsion containingpolysaccharide as emulsifier.The prescription was optimized through solubility investigation, compatibility test and ternary phase diagram method.polysaccharide was used as natural emulsifier, the ratio of oil phase, mixed emulsifier and co-emulsifier were used as the examination factors, and particle size, drug loading capacity and polydispersity index (PDI) were used as evaluation indicators. The central composite design-response surface method was used to optimize the formulation of quercetin microemulsion and evaluate its properties, dissolution and stability.The oil phase of the quercetin microemulsion prescription was glycerol triacetate (36%), the emulsifier waspolysaccharide (23%) and T80 (23%), and the co-emulsifier was PEG400 (18%); The resulting microemulsion had uniform and transparent appearance; The average particle size was (25.04 ± 0.94) nm, the potential was (−13.20 ± 0.68) mV, the PDI was 0.311 ± 0.030, and the drug loading was (30.17 ± 1.02) mg/g. The dissolution test showed that the cumulative dissolution rate of quercetin in simulated intestinal fluid and simulated gastric fluid at 60 min was 87.95% and 70.47%. Preliminary stability test, high-speed centrifugation and high-temperature test results showed that the quality of microemulsion was stable.The preparation process of quercetin microemulsion is simple, which can increase the solubility and dissolution of quercetin, and provide reference for further research and development of related preparations.
quercetin;polysaccharide; microemulsion; pseudo-ternary phase diagram; central composite design-response surface method; dissolution; stability
R283.6
A
0253 - 2670(2021)02 - 0378 - 08
10.7501/j.issn.0253-2670.2021.02.010
2020-09-01
国家自然科学基金项目(81750110548)
王君文(1996—),女,硕士研究生,研究方向为中药新制剂、新剂型、新技术。Tel: 16621525121 E-mail: wendywww1996@163.com
张朝燕,女,副教授,硕士生导师,研究方向为中药新制剂、新剂型、新技术。Tel: 15692165855 E-mail: chyzhang@shou.edu.cn
[责任编辑 郑礼胜]
