血府逐瘀汤通过影响BMP9表达抑制Notch信号通路调节髓核细胞增殖的机制
2021-01-18郭义林俊
郭义 林俊
(萍乡市中医院骨科,江西 萍乡 337000)
椎间盘退变是由多种因素引起的一种退行性疾病。随着人口老龄化和预期寿命的延长,发病率逐渐增加,给患者带来了极大的痛苦和沉重的社会负担〔1〕。髓核变性是早期椎间盘退变的主要病理变化,表现为细胞外基质(ECM)的逐渐变化。ECM主要由聚集蛋白聚糖和Ⅱ型胶原(Col2a1)组成,且其逐渐减少,Ⅰ型胶原取代Col2a1,导致纤维化和弹性模量的损失〔2〕。髓核变性治疗的相应缺陷包括手术或保守治疗。据推测,随着衰老和变性,髓核细胞经历表型转化并被分泌非典型纤维ECM的成纤维细胞所取代〔3〕。这表明细胞微环境的变化和分解代谢介质的存在可能促进异常增殖和分化。细胞因子介导髓核细胞功能的转变得到了其他研究的支持。此外,类似于软骨细胞,本课题组前期研究表明,椎间盘细胞的增殖和分化依赖于Notch信号通路〔4〕。血府逐瘀汤是一种中医处方剂名,由各种中草药及果实种仁按照一定的比例配合而成,具有一定的活血化瘀,行气止痛作用。骨形态发生蛋白(BMP)9是转化生长因子(TGF)-β超家族的成员,它是一种强生长分化因子,最初是从生长小鼠的肝脏中分离出来的〔5〕。它在间充质干细胞的软骨形成分化的促进运动中起重要作用。髓核和软骨中ECM的主要成分相似,其本质是聚集蛋白聚糖和Col2a1。本文主要探讨血府逐瘀汤通过影响BMP9表达抑制Notch信号通路调节髓核细胞增殖的机制。
1 资料与方法
1.1实验动物 雄性Sprague-Dawley(SD)大鼠36只,6~8周龄,体重190~220 g,各实验大鼠置于相同的环境中,12/12 h黑暗循环,并将大鼠在温控(22±2)℃的房屋中饲养。实验程序均经动物保护和使用委员会批准,并根据实验动物护理和使用指南进行实验。
1.2建立腰椎间盘组织模型并分组 随机分为3组,对照组12只,其他24只。通过腹膜内注射10%水合氯醛给大鼠施用麻醉(3 ml/kg)。将大鼠麻醉,置于具有固定肢体的俯卧位。使用脱毛剂制备背部皮肤上4 cm×8 cm的区域。然后将灭菌的覆盖片放在大鼠上,沿着后腰的棘突切割中线切口。切割皮肤后,进行骨膜下剥离以充分暴露棘突,关节突和椎板。咬骨钳用于去除棘突,关节突,棘上韧带和棘突间韧带。双侧竖脊肌切开。然后将皮下筋膜和皮肤逐层缝合回来。给药方法:动物模型建立后,将其中12只大鼠腹腔注射50 mg/kg血府逐瘀汤。6 w后,再次对标记的大鼠进行磁共振成像(MRI)检查,然后处死所有大鼠。收集腰椎间盘组织将一个片段中间固定在2%戊二醛中,将另外两个片段保存在-20 ℃。
1.3实验方法
1.3.1髓核原代细胞培养及BMP9转染 使用的腺病毒包括携带绿色荧光蛋白基因的腺病毒(Ad-GFP),腺病毒介导的BMPq(Ad-BMP)9和Ad-BMP9抑制剂,髓核 P0传代通过使用0.25%胰蛋白酶消化(NPC),传代,并返回培养箱4 h。此时大多数细胞黏附在板上。添加Polybrene和不同组的腺病毒(MOI值100),并且感染效率保持在50%。使其髓核细胞进行BMP9超表达与抑制表达,感染后6~8 h更换培养基,在感染24 h后进行后续实验。
1.3.2蛋白印记分析 将椎间盘组织在RIPA裂解缓冲液中于4 ℃匀浆5 min,得到10%匀浆。RIPA缓冲液中于4 ℃裂解45 min,离心(10 000 r/min,4 ℃,5 min)并收集上清液用于下一个实验。根据制造商的方案,使用二喹啉甲酸(BCA)蛋白质测定试剂盒测量总蛋白质浓度。在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质样品并转移至聚偏氟乙烯(PVDF)膜。将膜在含有5%脱脂奶粉的tris缓冲盐水和吐温20(TBST)中封闭1.5 h。用TBST洗涤膜,然后与相应的辣根过氧化物酶(HRP)-缀合的第二抗体(1∶5 000)在室温下孵育1.5 h。再次洗涤膜后,用增强的电化学发光(ECL)试剂观察结合的抗体,并使用Quantity One软件通过光密度分析进行定量。GAPDH的检测用作对照。
1.3.3免疫荧光和髓核细胞鉴定 将原代髓核细胞消化,重悬于培养基中,以5×104个细胞/孔接种于24孔板中的无菌细胞载玻片上,并培养24 h。用PBS洗涤细胞,并使用4%多聚甲醛在室温下将细胞固定20 min。用PBS洗涤细胞3次,并且每次加入0.5%Triton 10 min。用PBS洗涤细胞,并使用山羊血清阻断非特异性结合1 h。血清被完全吸入,并将细胞与第一抗体(兔抗Col2a1或小鼠抗聚集蛋白聚糖在4 ℃过夜孵育。将板在室温下放置1 h并用PBS洗涤。在避免光照的同时进行后续步骤。将第二抗体(山羊抗兔,红色荧光;山羊抗小鼠,绿色荧光)温育1 h。用PBS洗涤细胞,并用4′6-二脒基-2-苯基吲哚(DAPI)将细胞核染色10 min。用PBS洗涤载玻片,转移到载玻片上,用甘油密封后用荧光显微镜拍照。在随后的实验中通过使用具有红色荧光的二抗进行免疫荧光检测髓核细胞中ECM的表达。
1.3.4RNA提取和半定量RNA分析 通过使用GeneJET RNA纯化试剂盒收集每组具有腺病毒感染的髓核细胞用于RNA提取。通过使用分光光度计测量RNA浓度。通过使用逆转录和反转录第一链cDNA合成试剂盒。使用以下反应条件:在25 ℃下放置5 min,然后在42 ℃下放置60 min。通过在70 ℃加热5 min终止反应。使用以下反应条件:在95 ℃下初始变性2 min,进行1个循环;在95 ℃变性30 s,在55 ℃退火30 s,在72 ℃延伸1 min;最后在72 ℃延伸5 min。使用1.5%琼脂糖凝胶在80 V下进行凝胶电泳35 min。RT-PCR引物序列:Notch1:上游引物:AGGGCTTCCATTGTATTGAGGT、下游引物:ATCATCTTGGCATCCCTCTTG;DLL1:上游引物:ACCACAGTCCATGCCATCCACT、下游引物:GTATATTTGGGACCCCGTAGA;BMP9:上游引物:ACGATCTGTTTCCCCTCATCT、下游引物:ATGCAGGGATGATGTTCTG;GAPDH:上游引物:CGACAACTTTGGCATTGTGG、下游引物:TAAGTCGATCCCTAGTGACAA。
1.3.5CCK8检测髓核细胞增殖 使用CCK8测定法检测BMP9对髓核细胞的增殖影响。除特异性结构外,所有实验使用Ad-GFP作为对照组,并遵循前面提到的感染方法,并比较Ad-GFP和Ad-BMP9感染的细胞。将细胞接种于96孔板中。1×104细胞/孔,每组使用3个重复。在细胞感染后24 h加入CCK8试剂(10 ml),并将平板放回培养箱中2 h。通过自动微板读数器在450 nm下测量吸光度。
1.3.6TUNEL分析髓核细胞的凋亡率 根据制造商的说明,使用ApopTag过氧化物酶原位凋亡检测试剂盒评估细胞凋亡。简言之,从在室温下用10 U/ml DNase Ⅰ处理20 min的正常细胞阳性对照样品。将切片用3.0%H2O2预处理,与末端脱氧核苷酸转移酶在37 ℃反应1 h,然后与地高辛配基的核苷酸底物在37 ℃温育30 min。在3,3-二氨基联苯胺(DAB)中孵育5 min后,表现出DNA片段化的细胞核变为深棕色。将组织切片用苏木素复染,固定,并通过光学显微镜观察。
1.4统计学方法 采用SPSS20.0软件进行t检验、方差分析。
2 结 果
2.1各组BMP9 mRNA的相对表达 诱导模型组BMP9 mRNA表达较对照组明显降低(1.15±0.22、3.26±0.18,P<0.05)。而血府逐瘀汤组BMP9 mRNA表达(2.88±0.31)较诱导模型组明显升高(P<0.05)。
2.2CCK8检测髓核细胞的增殖 模型诱导组髓核细胞的含量明显低于对照组、血府逐瘀汤组〔41.4±2.47)、(82.35±1.52)、(73.52±3.23),P<0.05〕。见图1。
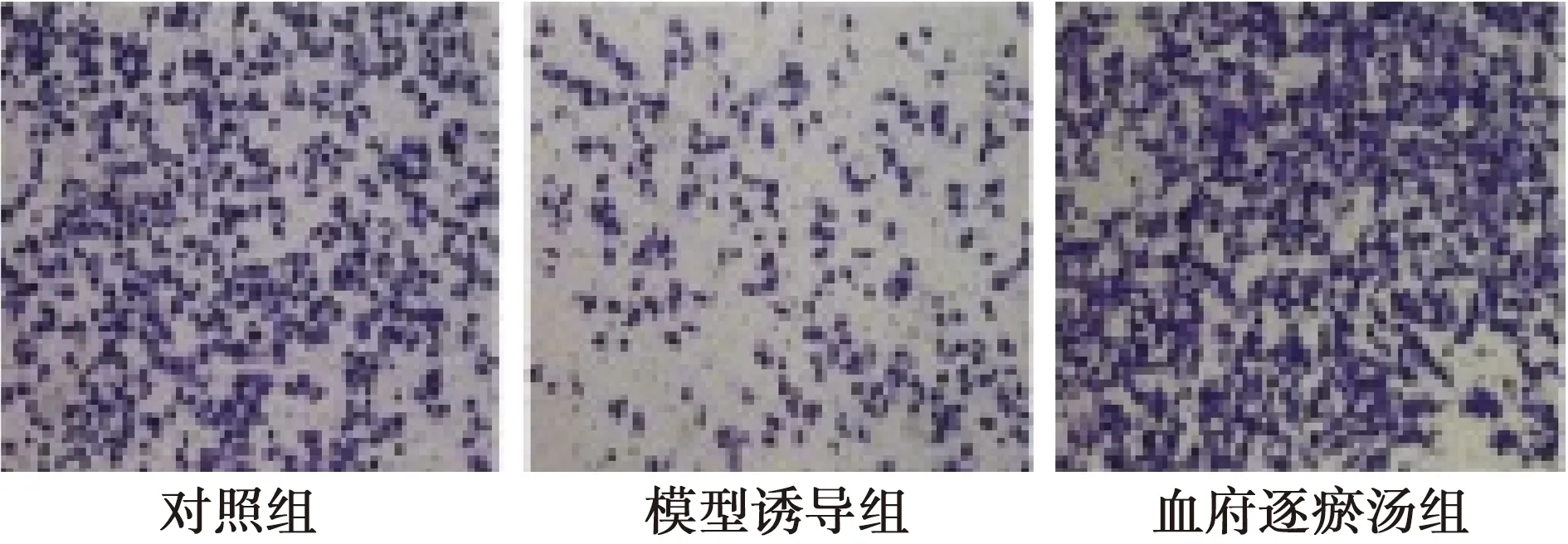
图1 CCK8检测(×100)
2.3BMP9促进髓核细胞中的ECM表达 模型诱导组聚蛋白多糖(Aggrecan)和Col2a1蛋白表达明显低于对照组(P<0.05),血府逐瘀汤组Aggrecan和Col2a1蛋白表达明显高于模型诱导组(P<0.05)。见表1。

表1 各组Aggrecan和Col2a1蛋白表达比较
2.4BMP9对Notch信号配体mRNA表达的影响 通过RT-qPCR检测Notch信号传导途径中BMP9对Notch1和DLL1的mRNA表达的影响,细胞培养组和BMP9转染组Notch1和DLL1 mRNA明显低于BMP9抑制转染组(P<0.05)。细胞培养组和BMP9转染组BMP9 mRNA表达明显高于BMP9抑制转染组(均P<0.05)。见表2,图2。
2.5TUNEL分析 BMP9抑制转染组较对细胞培养组、BMP9转染组细胞凋亡率明显升高,细胞活力明显下降(均P<0.05)。见表3。
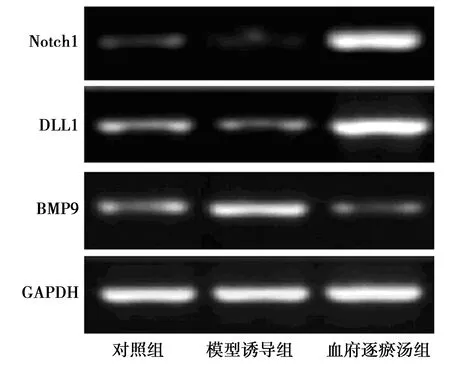
图2 BMP9、Notch1和DLL1的mRNA检测

表2 各组BMP9、Notch1和DLL1 mRNA表达情况

表3 各组髓核细胞的凋亡率、细胞活力测定
3 讨 论
背痛是肌肉骨骼残疾的主要原因,虽然确切原因尚不完全清楚,但椎间盘退变被广泛接受为主要原因〔6〕。目前,没有有效的疾病改善疗法可用于背痛,主要是由于我们对椎间盘稳态和变性的分子机制的有限理解。椎间盘退变是一种特殊的纤维软骨组织,由髓核纤维环,软骨终板和生长板软骨组成〔7〕。Notch信号传导是一种进化上保守的途径,在多种组织的发育和稳态中起重要作用,而其失调涉及多种疾病。随着衰老和变性,髓核细胞经历表型转化并被分泌非典型纤维细胞外基质的成纤维细胞所取代〔8,9〕。这表明细胞微环境的变化和分解代谢介质的存在可能促进异常增殖和分化。细胞因子介导髓核细胞功能的转变得到了其他研究的支持〔10〕。此外,类似于软骨细胞,有研究表明,椎间盘细胞的增殖和分化依赖于Notch信号通路。Notch信号传导主要由Notch受体(哺乳动物中的Notch1-4)通过其配体(包括哺乳动物中的DLL1的结合触发,两者都在两个相对细胞的表面上表达〔11,12〕。 Notch受体-配体结合激活Notch受体的两个连续酶促切割,其将其细胞内结构域(NICD)释放到细胞质中〔13〕。生理Notch信号传导是维持关节软骨所必需的,而Notch信号传导的持续激活导致软骨退化和骨关节炎〔14〕。
据报道Notch信号通路的所有成分,即受体,配体和靶基因,都在椎间盘细胞中表达〔15〕。本研究表明,Notch信号传导对维持椎间盘缺氧灶中髓核细胞增殖至关重要。BMP9是一种强生长分化因子,在间充质干细胞的软骨形成分化运动中起重要作用〔16,17〕。之前的报道称髓核和软骨中ECM的主要成分相似,其本质是聚集蛋白聚糖和Col2a1〔18,19〕。本研究结果说明较椎间盘退变组大鼠升高,这表明诱导模型组ECM表达下降,对髓核细胞的生长具有不利因素。通过血府逐瘀汤的药物处理后,给药组大鼠中Col2a1蛋白表达升高,对髓核细胞的增殖具有一定的促进作用。研究表明Notch信号通过调节软骨基质中的合成代谢和分解代谢分子在关节维持和骨关节炎中发挥双重作用〔20〕。
本研究结果证实证明血府逐瘀汤可促进BMP9表达,而转染高表达的BMP9髓核细胞抑制Notch1和DLL1在髓核细胞的生物功能,促进了髓核细胞的增殖,为椎间盘退变疾病的治疗提供了可能有效的方法,BMP9通过抑制Notch信号通路中的Notch1和DLL1从而干扰髓核细胞的增殖发育,其中血府逐瘀汤可促进诱导模型组中BMP9的表达,进而促进髓核细胞的增殖。
