结直肠癌中LC3与不同表型肿瘤相关巨噬细胞的相关性及其临床意义
2021-01-18范守仁吴淑华李扬扬许晓阳温菲菲郭宁杰贾真真
范守仁,吴淑华,李扬扬,许晓阳,何 双,温菲菲,刘 柳,郭宁杰,贾真真
1.滨州医学院临床医学院,山东 烟台 264003;2.滨州市第二人民医院病理科,山东 滨州 256800;3.滨州医学院附属医院病理科,山东 滨州 256600
肿瘤的发生、发展与其所在的微环境密切相关,肿瘤免疫微环境的改变可通过调控细胞因子释放、改变肿瘤血管生成等多种途径影响肿瘤的发生、发展、浸润及转移等[1]。肿瘤微环境是由多种细胞及基质等相互作用形成的网络性微生态系统[2]。其中,免疫细胞是免疫微环境中极为重要的部分,免疫细胞的类型、浸润位置及密度在很大程度上反映肿瘤的免疫状态。在众多的免疫细胞中肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)及其产物在肿瘤的发生、发展过程中发挥重要作用。研究显示,TAM的数量和功能因肿瘤细胞或间质细胞的改变而极化为不同的表型,从而发挥不同作用[3]。因此,有效募集TAM并诱导其向具有抗肿瘤能力的TAM极化有可能成为增强肿瘤免疫的新思路。近期研究表明,自噬在维持肿瘤细胞能量代谢、促进肿瘤细胞休眠和免疫逃逸、调控基质细胞分化等方面发挥重要作用[4]。本课题组前期研究显示,结直肠癌中的自噬水平与肿瘤相关抗原及周围淋巴细胞、CD68阳性巨噬细胞浸润量有关[5]。本研究通过检测自噬相关因子LC3、M1型TAM标志物CD16及其分泌物IL-1、TNF-α以及M2型TAM标志物CD163及其分泌物IL-10、TGF-β的表达,计数肿瘤微环境中CD16+、CD163+、CD68+细胞及CD4+、CD8+、CD20+淋巴细胞的数量,探讨自噬水平与不同表型TAM及免疫细胞的关系及其临床意义。
1 材料和方法
1.1 材料
1.1.1 组织标本
收集滨州医学院附属医院病理科及滨州市第二人民医院病理科2013年1月—2014年12月存档的具有完整随访资料的结直肠癌标本。入选标准:根据2019版世界卫生组织(World Health Organization,WHO)消化系统肿瘤分类标准,诊断为原发性结直肠癌;首次手术治疗;术前未进行任何放化疗。排除标准:术前合并溃疡性结肠炎、克罗恩病或其他炎性肠病;患有系统性红斑狼疮等自身免疫疾病或长期口服免疫抑制剂;术后30 d内死亡及非肿瘤性死亡。每年进行电话或门诊随访,直至2019年12月或患者死亡,失访者不予入组。
1.1.2 试剂
LC3、CD16、CD163、CD4、CD8、CD20、CD68、IL-1、IL-10、TNF-α及TGF-β抗体均购自美国Abcam公司,羊抗兔/鼠二抗及免疫组织化学试剂盒购自北京中杉金桥生物技术有限公司。
1.2 方法
1.2.1 H-E切片初筛
调取滨州医学院附属医院病理科存档入选标本的所有H-E切片,由两名资深病理科医师采用双盲法重新阅片诊断。每例患者的肿瘤组织切片为4~6张,选取淋巴细胞浸润最多的相应石蜡组织进行连续切片。
1.2.2 免疫组织化学
按照免疫组织化学EnVision法染色:将切片脱蜡至水,高压热修复抗原,3%H2O2去除内源性过氧化物酶,根据美国Abcam公司推荐浓度稀释并加入一抗,4 ℃过夜,磷酸盐缓冲液(phosphate-buffered saline,PBS)洗涤后加二抗37 ℃温育30 min,二氨基联苯胺(diaminobenzidine,DAB)显色,苏木精复染,分化,脱水透明,中性树胶封片。采用美国Abcam公司提供的阳性组织作为阳性对照,用PBS代替一抗作为阴性对照。
1.2.3 免疫组织化学结果判定标准
LC3主要表达于肿瘤细胞的细胞膜或细胞质,以出现黄色或棕黄色颗粒为阳性标志。选取10个阳性细胞数最多的高倍镜视野,根据细胞染色强度和阳性细胞比例判定实验结果:细胞无染色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞数≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。将两项评分结果相乘,≥4分判为阳性。
CD16、CD163及CD68主要表达于巨噬细胞的细胞膜和(或)细胞质,CD4、CD8、CD20主要表达于淋巴细胞的细胞膜和(或)细胞质,以细胞膜出现棕黄色和(或)细胞质内出现棕黄色为阳性标志。IL-1、IL-10、TNF-α及TGF-β表达于间质细胞的细胞膜和细胞质,以细胞质或细胞膜内出现棕黄色为阳性标志,肿瘤细胞阳性不计入阳性细胞数。400倍镜下选取阳性密度最高的5个视野,计数阳性细胞数,取平均值。计数高于平均值者为阳性,低于平均值者为阴性。
1.3 统计学处理
采用SPSS 23.0软件进行数据分析。组间比较及蛋白表达与临床病理学参数之间的相关性采用χ2检验;蛋白表达的相关性用Spearman相关性分析;生存分析采用Kaplan-Meier法,并以log-rank法检验;采用COX比例风险回归模型进行多因素生存分析。P<0.05为差异有统计学意义。
2 结果
2.1 结直肠癌与正常黏膜中各因子的表达情况
免疫组织化学检测结果显示,自噬相关因子LC3、M1型TAM标志物CD16及M2型TAM标志物CD163在结直肠癌组织中的表达均高于正常黏膜组织;结直肠癌组织中CD4+、CD8+、CD20+淋巴细胞及CD68+巨噬细胞的浸润量明显高于正常黏膜,差异均有统计学意义(P均<0.05,图1,表1)。
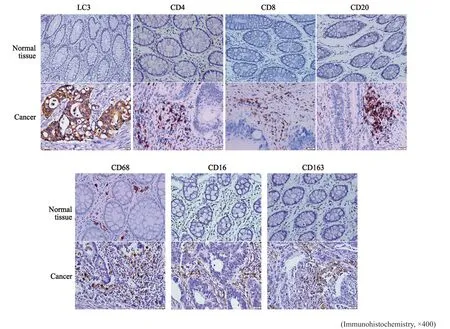
图1 结直肠癌中各因子的表达情况Fig.1 The expression of marker in colorectal cancer
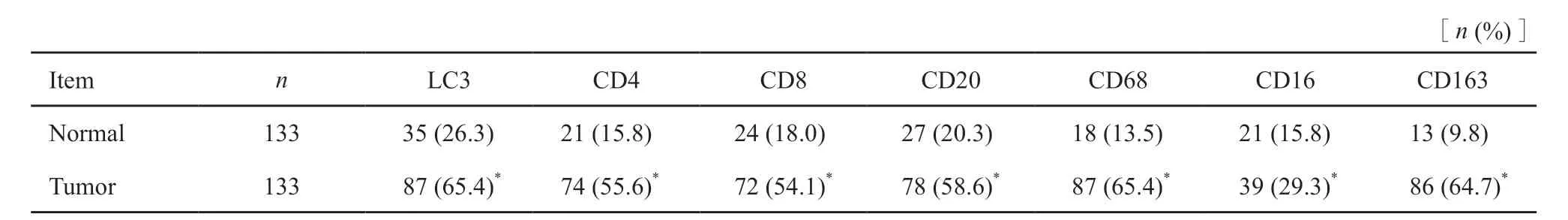
表1 结直肠癌与正常黏膜中各因子表达的情况Tab.1 The expression of marker in colorectal cancer and normal tissue
2.2 结直肠癌中自噬相关因子LC3与肿瘤微环境中TAM的数量及占比的关系
根据LC3的免疫组织化学检测结果将结直肠癌分为LC3+组和LC3-组。结果显示,LC3+组中CD16的表达均高于LC3-组,而CD163在LC3+组中的表达均低于LC3-组(P<0.05)。Spearman相关分析显示,LC3表达水平与M1型TAM呈正相关,而与M2型TAM呈负相关(P<0.05,图2,表2)。
本研究在L C 3+组及L C 3-组中分别计数CD68+巨噬细胞、CD16+M1型TAM、CD163+M2型TAM阳性细胞数,计算不同表型TAM在巨噬细胞中的占比。结果显示,LC3+组中M1型TAM在巨噬细胞中的占比为58.5%(62/106),高于M 2 型TA M(39/106,36.8%),而LC3-组中M1型TAM在巨噬细胞中的占比为15.1%(11/73),低于M2型TAM(58/73,79.5%),差异有统计学意义(P<0.05)。

图2 结直肠癌中自噬相关因子LC3及不同表型TAM的关系Fig.2 The relationship of LC3 and TAM with different phenotypes in colorectal cancer

表2 结直肠癌组织中自噬相关因子LC3与不同表型TAM的相关性Tab.2 Correlation between LC3 and TAM in colorectal cancer
2.3 结直肠癌中自噬相关因子LC3及不同表型TAM与IL-1、TNF-α、IL-10、TGF-β的相关性
进一步根据CD16、CD163免疫组织化学检测的结果,将其分为阳性组与阴性组。结果显示,LC3+组和CD16+组中IL-1、TNF-α的表达水平均高于LC3-组和CD16-组,而CD163+组中IL-10、TGF-β的表达水平高于CD163-组,差异均有统计学意义(P均<0.05)。Spearman相关分析显示,LC3、CD16均与IL-1、TNF-α的表达呈正相关;CD163则与IL-10、TGF-β的表达呈正相关(P<0.05);而LC3与IL-10、TGF-β的表达无显著相关性(P>0.05,表3)。
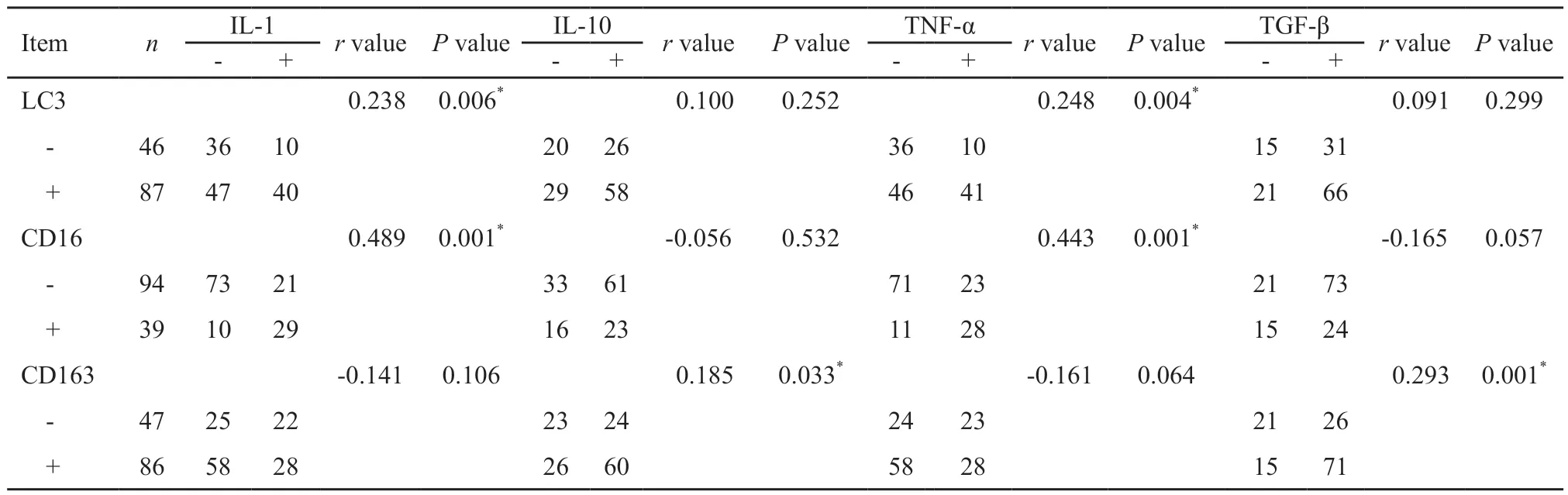
表3 结直肠癌中自噬相关因子LC3、不同表型TAM与其产物的相关性Tab.3 Correlation of LC3,TAM with different phenotypes and their products in colorectal cancer
2.4 结直肠癌中不同表型TAM与CD4+、CD8+、CD20+淋巴细胞浸润的相关性
CD16+组中CD4+、CD8+、CD20+淋巴细胞浸润阳性率高于CD16-组,CD163+组中CD4+、CD8+、CD20+淋巴细胞浸润阳性率低于于CD163-组,差异有统计学意义(P<0.05,表4)。Spearman相关分析显示,M1型TAM的表达与CD4+、CD8+、CD20+淋巴细胞浸润均呈正相关,而M2型TAM的表达与CD4+、CD8+、CD20+淋巴细胞浸润均呈负相关(P<0.05,表4)。
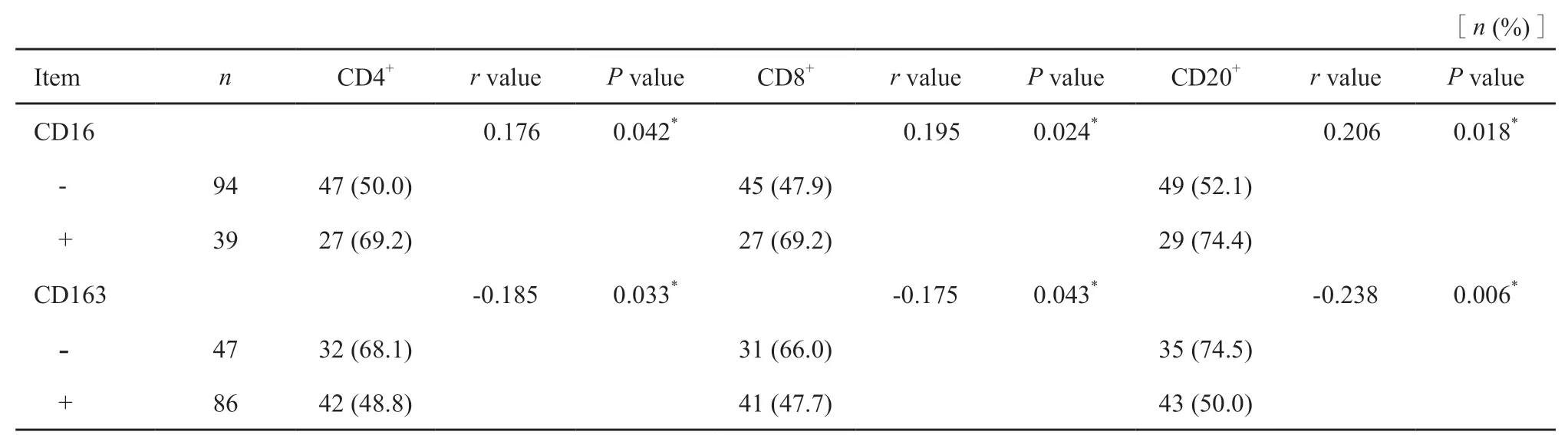
表4 结直肠癌中不同表型TAM与CD4+、CD8+及CD20+淋巴细胞浸润的相关性Tab.4 Correlation of TAM with CD4+,CD8+ and CD20+ lymphocyte infiltration in colorectal cancer
2.5 结直肠癌中LC3、CD16、CD163的表达与临床病理学特征的相关性
LC3、CD16、CD163的表达与肿瘤直径、浸润深度及淋巴结转移密切相关。其中LC3与肿瘤直径呈正相关,LC3、CD16均与肿瘤浸润深度、淋巴结转移呈负相关,CD163与肿瘤浸润深度及淋巴结转移呈正相关,差异均有统计学意义(P<0.05,表5)。
2.6 LC3、CD16、CD163与结肠癌患者预后的相关性分析
133例结直肠癌患者的中位生存时间为60个月,平均5年生存率为62.11%。Kaplan-Meier分析显示,LC3、CD16、CD163、TNF-α、IL-1及淋巴结转移与结直肠癌患者预后密切相关(P<0.05,图3)。CD163表达阳性患者5年生存率为34.61%,明显低于阴性患者(65.51%),而LC3、CD16表达阳性患者5年生存率分别为65.13%、66.67%,明显高于阴性患者(29.49%、30.85%,P<0.05,图3)。COX回归模型分析显示,LC3、CD16、CD163及淋巴结转移是结直肠癌预后的独立危险因素(P<0.05,表6)。
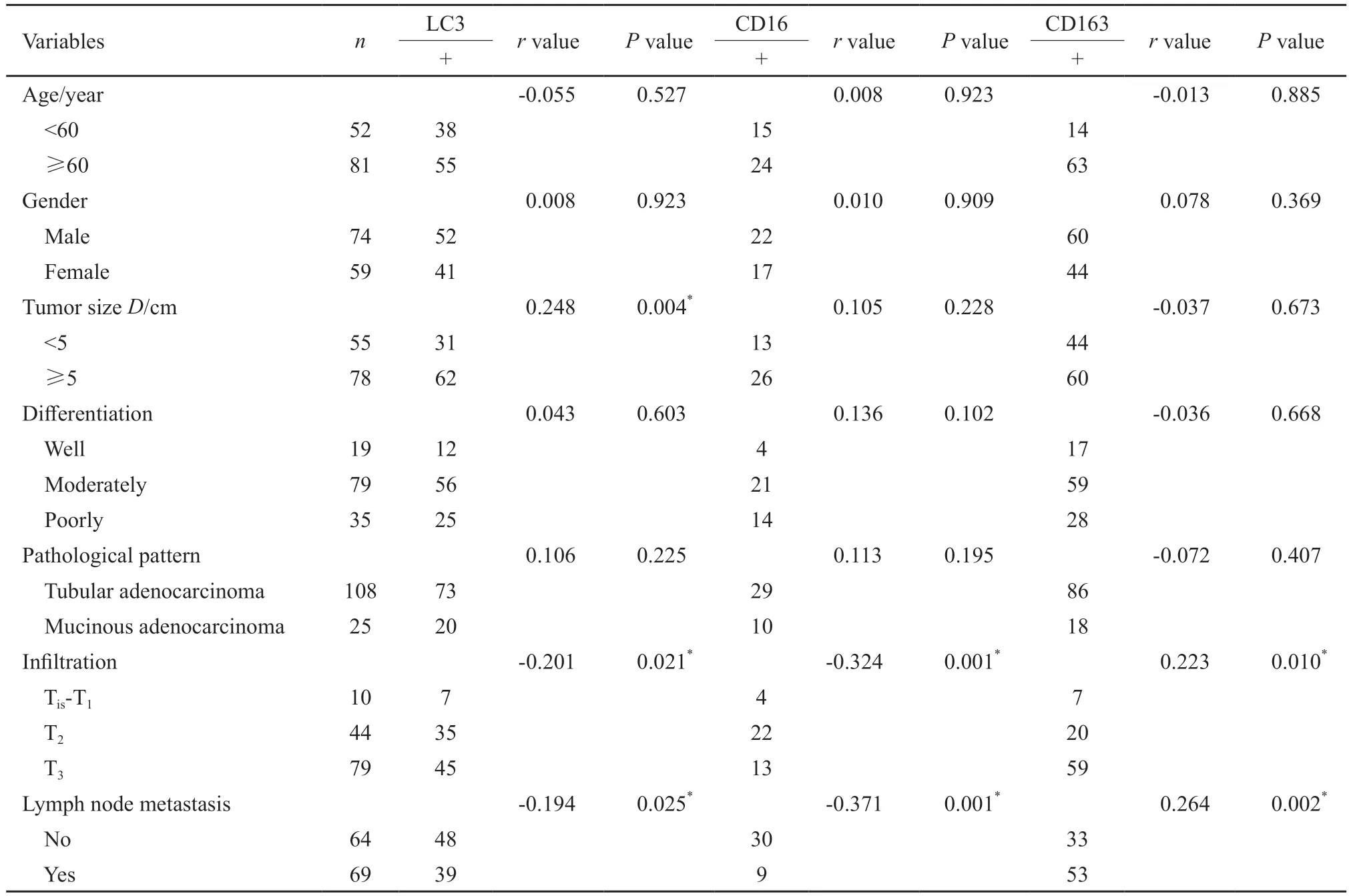
表5 LC3、CD16及CD163的表达与结直肠癌临床病理学特征的相关性Tab.5 Correlation between the expressions of LC3,CD16 and CD163 and clinicopathological features in colorectal cancer
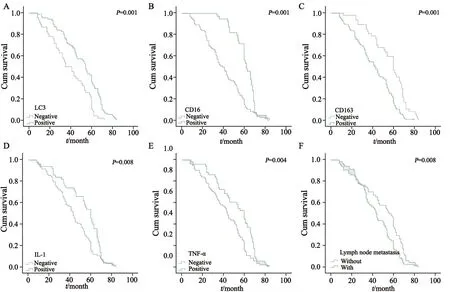
图3 结直肠癌患者预后生存曲线Fig.3 Survival curve in colorectal cancer patients
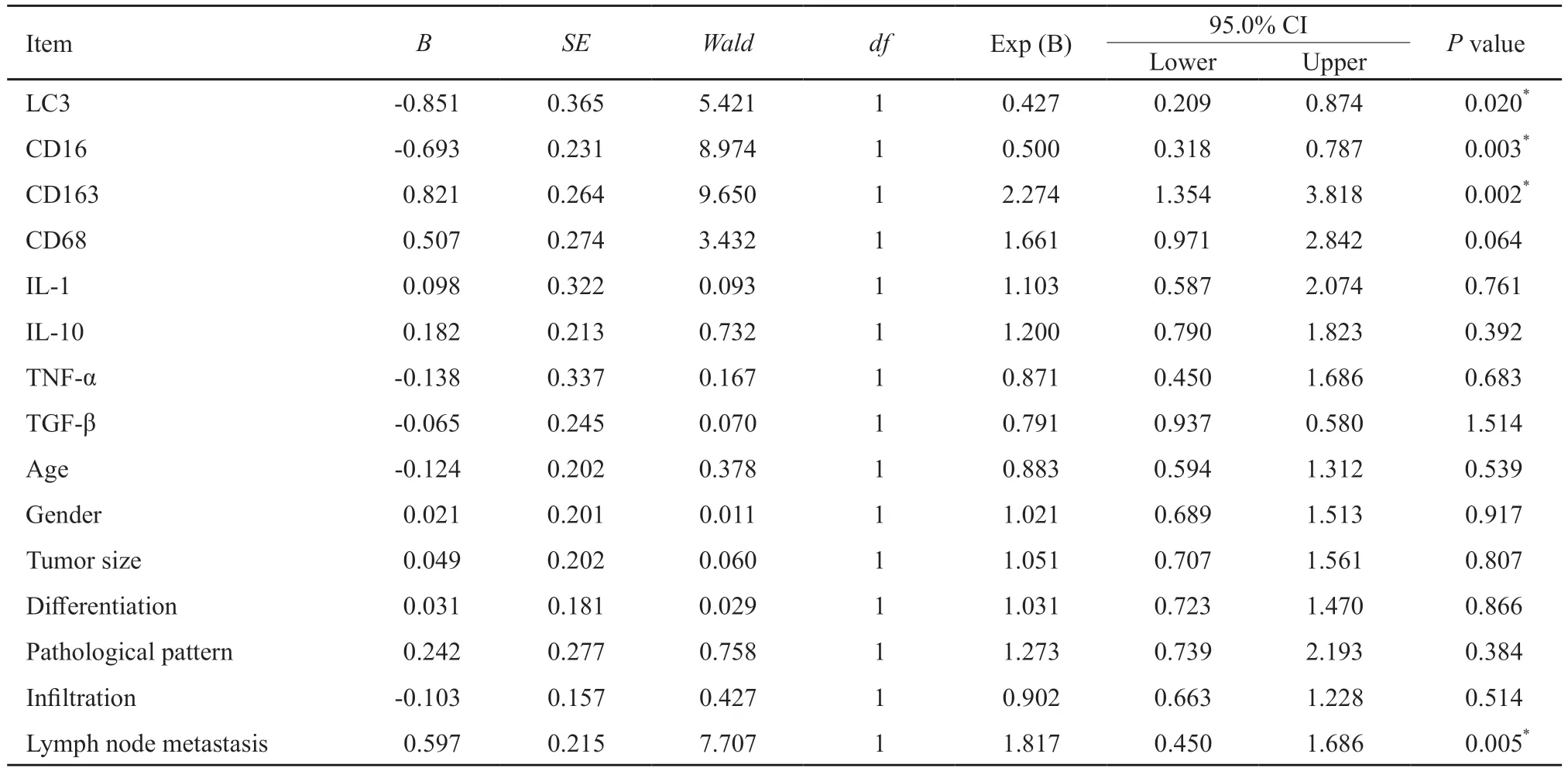
表6 影响结直肠癌患者预后多因素生存分析Tab.6 Multivariate analysis of prognosis in patients with colorectal cancer
3 讨 论
TAM是肿瘤局部免疫微环境的重要组成成分,是一种平均寿命短且不能在肿瘤组织中增殖的细胞,需在肿瘤生长和进展过程中持续募集补充[3]。TAM具有极化不稳定性,能被肿瘤细胞募集、调控而极化为不同表型。TAM的前体细胞为肿瘤组织中的巨噬细胞,经不同的细胞因子诱导极化为经典活化的巨噬细胞(M1型)和替代性活化的巨噬细胞(M2型)。M1型TAM负责提呈肿瘤特异性抗原,同时增强抗肿瘤免疫反应[6],而M2型TAM抗原提呈能力较弱,并可通过多种途径促进肿瘤的生长、侵袭和转移[7]。Zhou等[8]的研究证明,降低胶质母细胞瘤中的M2型TAM表达,可抑制肿瘤生长。近年来多项研究表明,结直肠癌中M2型TAM明显增高,预后较差,在结肠癌细胞株中诱导TAM向M1型极化从而发挥抗癌作用[9-10]。本研究显示,结直肠癌中TAM的浸润量高于正常黏膜组织,其中M2型TAM的浸润量高于M1型TAM,且与患者预后呈负相关,而M1型TAM的高表达有利于患者预后。这与既往的研究一致,提示结直肠癌中的TAM以M2型极化为主,不同表型TAM在肿瘤中的浸润量可能成为影响患者预后的危险因素。然而,有关肿瘤细胞及周围微环境对TAM极化的影响及其效应尚缺乏进一步研究。因此,深入研究影响TAM极化的相关因素,有效募集巨噬细胞并诱导巨噬细胞向M1型巨噬细胞极化,可能成为增强肿瘤免疫及肿瘤靶向治疗的新途径。
近期有研究表明,M1型与M2型TAM之间可相互转化[11-12]。而激活PI3K/mTOR信号转导通路可促进巨噬细胞向M2型极化,抑制PI3K/mTOR通路则致使其向M1型极化[13-14]。众所周知,PI3K/mTOR是细胞生长增殖的重要信号转导通路,也是调控自噬的主要通路[15]。自噬是广泛发生于真核细胞内的重要生物学现象,近年来研究发现,在胃癌[16]、肺癌[17]及子宫内膜癌[18]等多种实体肿瘤中存在自噬的异常激活现象。本课题组的前期研究表明,结直肠癌中的自噬水平不仅与肿瘤发生、发展密切相关,也与肿瘤相关抗原及周围CD4+、CD8+、CD68+淋巴细胞浸润量有关[5,19]。由此可见,在肿瘤细胞和肿瘤微环境(如基质细胞、内皮细胞和免疫细胞)中自噬的作用极其复杂。然而,有关肿瘤自噬水平与肿瘤微环境中不同免疫表型TAM的关系,尤其是对巨噬细胞极化的影响报道罕见。本研究结果显示,LC3+组中M1型TAM的数量高于M2型TAM,而在LC3-组中,M1型TAM的数量低于M2型TAM。同时,本研究结果显示,结直肠癌的自噬水平不同,不同表型的TAM占比不同,提示肿瘤自噬水平与TAM的极化具有相关性。结合前期研究我们推测,结直肠癌自噬水平的升高,可引起肿瘤细胞表面及周围微环境中抗原物质的增加,进而招募巨噬细胞聚集并向M1型TAM极化,参与抗原提呈,募集淋巴细胞,以增强抗肿瘤免疫反应。同时,本实验中LC3+组中M1型TAM所占巨噬细胞比例高于M2型TAM所占比例的结果提示,自噬异常激活时可引起M2型向M1型TAM的再极化,使肿瘤微环境中M1型TAM所占巨噬细胞比例升高,从而进一步增强抗肿瘤免疫反应。因此,结直肠癌的自噬水平及肿瘤微环境中不同极化表型的TAM占比,在一定程度上影响患者的预后。积极促进肿瘤微环境中TAM向M1型极化、募集和再极化,对于增强肿瘤免疫反应,抑制肿瘤进展可能具有重要的临床意义。
肿瘤免疫包括机体对肿瘤的非特异性免疫和特异性免疫两方面,其中细胞免疫是肿瘤特异性免疫的重要部分。T淋巴细胞、NK细胞和巨噬细胞等对肿瘤细胞均具杀伤作用,其主要通过所产生的细胞因子发挥作用。研究表明,M1型TAM高表达MHC-Ⅰ类和MHC-Ⅱ类分子,提呈抗原的同时可分泌促炎因子,如IL-1、IL-12、IL-23、TNF-α等细胞因子,进而促进抗肿瘤免疫[7,20]。Wu等[21]研究发现,IL-1β参与乳腺癌抗肿瘤免疫反应,并抑制乳腺癌转移。Ray等[22]的研究表明,IL-1β和TNF-α的产生参与小鼠结直肠癌的生长、侵袭和转移。M2型TAM则可释放TGF-β、IL-10等免疫抑制因子,通过抑制T细胞、B细胞的增殖,参与调节肿瘤免疫逃逸[23]。Martínez-Campos等[24]研究发现,胃癌中TGF-β、IL-10高表达可降低肿瘤细胞中的MHC-Ⅰ类抗原,并降低细胞毒性T淋巴细胞介导的免疫应答。然而,有关肿瘤微环境中自噬水平改变能否影响不同表型TAM所产生的细胞因子及其效应尚未见报道。本研究结果显示,结直肠癌中LC3的表达水平及M1型TAM均与IL-1、TNF-α及CD4+、CD8+、CD20+淋巴细胞浸润呈正相关,M2型TAM则与其分泌产物IL-10、TGF-β呈正相关,而与淋巴细胞浸润呈负相关。提示结直肠癌中自噬水平不仅可影响不同表型TAM的极化,同时可影响其分泌产物的表达,在肿瘤特异性免疫方面发挥重要作用。推测异常激活的自噬不仅可增加M1型TAM的极化及抗原提呈能力,同时其产物IL-1及TNF-α可刺激CD4+、CD8+T细胞活化,促进CD20+B细胞增殖和分泌抗体,增强抗肿瘤的细胞免疫作用。反之,低水平自噬环境中,M2型TAM增加,其分泌产物IL-10及TGF-β则可抑制细胞免疫功能,促进肿瘤免疫逃逸。因此,有效地调节肿瘤细胞自噬水平可能成为激活肿瘤免疫反应的新途径。
近年来,TAM与肿瘤的生物学行为及预后的关系成为新的关注点。Chen等[25]的研究表明,肿瘤组织中M2型巨噬细胞高表达胰腺癌患者较低表达患者的生存率更低。Qiu等[26]的研究表明,乳腺肿瘤中M2型TAM高浸润量与患者预后不良相关,其可能的机制是由于M2型TAM抑制CD8+T细胞功能、降解细胞外基质、促进血管生成并抑制吞噬功能。M2型TAM高表达还与肿瘤耐药及预后不良相关[27]。本研究结果显示,LC3、CD16、CD163的表达与肿瘤直径、浸润深度及淋巴结转移密切相关。Kaplan-Meier及COX回归模型分析表明,LC3、CD16及CD163是结直肠癌预后的独立危险因素。提示结直肠癌中自噬活性改变了肿瘤相关巨噬的极化状态,促进了M1型TAM的募集,可增加对肿瘤性抗原的提呈作用,同时促进其分泌IL-1、TNF-α等促炎因子,进而诱导淋巴细胞聚集,诱发抗肿瘤免疫效应,在一定程度上抑制肿瘤的进展,延长肿瘤患者存活时间。而M2型TAM大量聚集则促进肿瘤免疫逃逸,影响患者预后。因此,检测结直肠癌中自噬相关因子及不同表型TAM标志物对判断结直肠癌患者的预后具有重要参考价值,可作为评估结直肠癌患者预后的潜在分子标志物。
总之,结直肠癌中过度自噬可引起肿瘤微环境内抗原物质的增加,进而引起巨噬细胞募集并向M1型TAM极化,从而诱导淋巴细胞浸润以增强抗肿瘤免疫反应。同时过度自噬可减少M2型TAM极化,进一步避免肿瘤免疫逃逸,以增强抗肿瘤免疫治疗的效果。因此,深入研究自噬水平的改变与不同表型TAM的相关性及其分子机制,对于判断肿瘤预后以及探索结直肠癌免疫治疗新靶点具有重要意义。然而,本研究仅对各因子蛋白水平的变化及相关性进行了初步探讨,仍需增加样本量并进一步开展体外实验及动物实验,以揭示其功能及分子机制。
