乳腺癌寡转移系统治疗联合SBRT的困惑和前景
2021-01-18
上海交通大学医学院附属瑞金医院放射治疗科,上海 200025
转移性乳腺癌(metastatic breast cancer,MBC)被认为不可治愈,系统治疗仍为标准治疗方式[1]。出现远处转移是总生存率(overall survival,OS)的不利因素[2]。但在MBC中,部分患者转移病灶有一定的自限性,即寡转移乳腺癌(oligometastatic breast cancer,OMBC),其5年OS优于多发转移[3]。因为病程上的自限性和转移灶数目的相对有限性,OMBC的治疗原则应介于可手术乳腺癌和MBC之间,局部治疗有更重要的地位。一方面,立体定向放射治疗(stereotactic body radiation therapy,SBRT)或立体定向消融放疗(stereotactic ablative radiotherapy,SABR),因其肿瘤局部高剂量和正常组织低剂量的优势,被更多地运用于OMBC的局部治疗[4-5];另一方面,鉴于乳腺癌属于全身性疾病,基于分子分型的系统治疗是OMBC治疗不可或缺的组成部分[1],如何最优化地将两者进行整合,仍存在诸多探讨空间。本综述将力争梳理该领域的困惑和前景,为OMBC的治疗提供参考。
1 乳腺癌寡转移的概念:病灶数目和生物行为,哪个更重要
1995年,Hellman等[6]首次提出了寡转移的概念,是指介于局限原发灶和广泛转移的中间状态,肿瘤负荷低,通常≤5个转移灶[7],有潜在治愈可能[8]。关于寡转移的定义尚未统一,通常认为其转移有限,可通过对寡转移灶的局部治疗改善患者生存[9]。根据寡转移状态的出现时间,可进一步将其定义为起始性寡转移和异时性寡转移。前者即诊断最初就存在转移,后者指原发灶经过一段时间治疗后出现的转移[10]。无论起始性还是异时性,都很难在第一个转移灶出现的时候判断其是否性质上属于寡转移。因此需要结合转移灶数目、出现时间、部位及发展速度综合判断。
寡转移的潜在生物学特性也有别于多发转移。miR-200c的表达升高可能是使寡转移向多发转移进展的潜在生物学标志[11]。基线循环肿瘤细胞(circulating tumor cell,CTC)<5/7.5 mL全血也是OMBC可能的标志[12]。PET/CT可能是临床判别真正寡转移的有效手段。有研究报道,OMBC经SBRT后,NaF-PET/CT显示完全代谢缓解的患者在随访2年内未出现疾病复发或进展,而部分代谢缓解的患者出现远处转移[13]。因此,OMBC需要更个体化的治疗,局部治疗也有更高的地位[14]。
2 SBRT靶区:部分转移灶还是所有病灶
2.1 SBRT/SABR简述
SBRT来源于立体定向放射外科(stereotactic radiosurgery,SRS),其疗程短,分次剂量大,能够精确照射病灶,并且临近正常组织受照剂量小。这使放疗在OMBC中的角色从姑息治疗转变为潜在治愈可能[15]。有学者认为SBRT这一术语不足以反映它通过高剂量带来的高局部控制率乃至根治的特点,由此提出SABR[16]。目前,美国癌症研究所已将SBRT和SABR收录,代表同种治疗方式。SBRT的质量控制要求高于常规分次外照射[17-18]。最佳的剂量分割尚无定论,有研究认为BEDisocenter>150 Gy10可以达到较好的局部控制效果[19]。
2.2 SBRT靶区范围
SBRT在OMBC的靶区范围存在探讨空间。肿瘤种植理论认为,原发肿瘤可以向自身和远处播散肿瘤细胞[20]。原发灶经标准治疗后行所有转移灶的局部治疗是OMBC生存的有利因素[21-23]。因此,覆盖所有病灶的局部治疗是有利的。
目前已有多项前瞻性研究要求在原发灶通过局部治疗得到控制的前提下行所有转移灶的SBRT。SABR-COMET是一项多瘤种Ⅱ期随机对照的多中心临床研究,入组了原发灶治疗后3个月以上未进展的寡转移患者,包括OMBC,对SABR组行所有转移灶SABR(30~60 Gy/3~8次),中位随访25个月,发现SABR能使无进展生存期(progression-free survival,PFS)延长2倍[24]。另有两项前瞻性研究对所有寡转移灶行SBRT或IMRT,2年局部控制率接近100%[13,25]。对所有病灶局部治疗后超过30%的OMBC生存期超过9年[26]。因此对于OMBC而言,控制所有病灶能取得很好的局部控制率及生存效果。不良反应多为1~2级[13,25,27]。以NRG-BR002为代表的多项临床试验(NCT02364557、NCT02089100、NCT03808337、NCT02759783)正在入组颅外OMBC,在控制原发肿瘤的前提下对所有寡转移灶行局部治疗。
由于存在远隔效应,SBRT只照射部分病灶是否可行呢?远隔效应指局部放疗可诱发全身免疫调节,从而控制未放疗部位的肿瘤[28]。但是放疗也会激活免疫抑制通路,因此放疗联合免疫治疗可以协同促进抗肿瘤免疫和远隔效应[29-31]。OX40 Breast(NCT01862900)试验对乳腺癌的肝或肺转移行SBRT联合免疫治疗,并保留一个未放疗病灶,以此评估放疗与未放疗病灶的缓解差异。
尽管在小鼠模型中,放射线照射至皮下植入的肿瘤,联合免疫治疗取得了很好的远隔效应[32],但临床上乳腺癌多为内脏转移,远隔效应并不理想。在一项对部分转移灶行SBRT并联用粒细胞-巨噬细胞集落刺激因子的Ⅱ期研究中,乳腺癌患者发生未照射部位部分缓解的仅占5/14[33]。另一项针对SBRT联合pembrolizumab的研究中,对有临床症状的转移灶行SBRT,未放疗部位的反应率仅为13%[34]。而对OMBC行所有转移灶SBRT,可使程序性死亡受体表达增加,T细胞对肿瘤相关抗原应答增强[30],并且有利于释放肿瘤相关抗原,减少肿瘤介导的免疫抑制,避免肿瘤与免疫细胞的代谢竞争[35]。因此,能否通过远隔效应仅照射部分转移灶仍需进一步研究。
3 可能从SBRT局部治疗获益的OMBC患者选择
OMBC患者行SBRT局部治疗的临床研究对相关预后因素进行了探索,为临床决策中患者的选择提供了参考。Milano等[36]在前瞻性研究中发现,SBRT前经系统治疗后稳定或缓解的患者2年OS优于系统治疗后进展的患者,并且多因素分析显示,仅有骨转移或仅有单发转移灶者可使死亡风险分别降至1/4和1/3。另一项前瞻性研究也得出了相似的结论[37]。对于仅有骨寡转移的乳腺癌患者,单发转移灶、激素受体(hormone receptor,HR)阳性,以及放疗前经系统治疗缓解,均与更好的OS相关。而肿瘤靶区(gross tumor volume,GTV)>25 cm3的患者局部控制率较差,后续出现远处广泛转移的风险更高[26]。另一项回顾性分析也发现HR+与更好的OS相关,并且原发病灶淋巴结分期pN0-1的生存优于pN2-3[23]。有研究报道了OS的有利因素,包括无病生存期(disease-free interval,DFI)>12个月,表明肿瘤状态更为“惰性”的OMBC患者更有可能从SBRT局部治疗中获益[27,38]。调查显示,临床上肿瘤医师也更倾向于为DFI超过1年的OMBC患者推荐SBRT[5]。综上所述,肿瘤负荷小、肿瘤呈现较为“惰性”的状态、转移灶经全身治疗后稳定或缓解及HR+的OMBC患者是从SBRT局部治疗中获益的潜在对象。
4 SBRT联合免疫治疗或基于分子分型的特异性抗乳腺癌治疗
4.1 SBRT联合免疫治疗
4.1.1 三阴性乳腺癌(triple-negative breast cancer,TNBC)
晚期TNBC由于缺乏可靶向治疗的受体,全身治疗仍以化疗为主,但预后不佳。研究发现,肿瘤通过程序性死亡[蛋白]-1(programmed death-1,PD-1)通路抑制T细胞的抗肿瘤免疫效应,而TNBC存在较高的程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)表达水平,因此PD-1/PD-L1是晚期TNBC的一个重要靶点[39]。已有研究支持单用PD-1/PD-L1抑制剂治疗晚期TNBC。虽然少于3个转移器官或DFI超过12个月的患者客观缓解率更高,但显然单药并不能治愈寡转移的TNBC患者[40-41]。Ⅱ期临床研究NCT03483012拟探索atezolizumab联合SRS对于TNBC脑转移患者的有效性和安全性(表1)。对于寡转移的TNBC,免疫治疗与SBRT联合是否优于单用免疫治疗,有待更多的临床研究。
4.1.2 不限分子分型
临床前研究已证实,放疗联合PD-L1单抗治疗可以协同促进CD8+T细胞应答,优化肿瘤免疫微环境,促进肿瘤消退[42]。BOSTON Ⅱ(NCT02303366)试验拟探索pembrolizumab联合SABR对颅外OMBC的安全性和有效性(表1)。
O X 40 信号转导通路与乳腺癌免疫相关,可以活化效应T细胞,抑制调节性T细胞(regulatory T cell,Treg)。OX40激动剂可以促进该通路的抗肿瘤效应[43]。OX40 Breast(NCT01862900)试验对肝或肺有限转移的乳腺癌联合OX40激动剂和SABR(表1)。
4.2 SBRT联合其他基于分子分型的特异性抗肿瘤治疗
在SBRT前经全身治疗病灶未进展,或SBRT后继续全身治疗,是生存的有利因素[36,44]。Ⅱ期研究NCT02759783、NCT02581670在对转移灶行SBRT的基础上联合基于分子分型的系统治疗(表2)。由于预后因不同分子分型而异,几项在研临床试验包括NCT02089100、NCT03808337、NCT02364557(表2)将根据HR、人表皮生长因子受体2(human epidemal growth factor receptor 2,HER2)状态进行入组或分层,以基于分子分型判断联合治疗是否优于单用全身治疗。
在一项OMBC研究中,有8例HR+、HER2-的患者在疾病进展并经SABR后未更换内分泌治疗方案,2年随访后仍处于无病生存状态[13],提示SABR可能增加OMBC内分泌治疗的获益,推迟细胞毒性化疗药物的使用。对于HR+、HER2-的晚期乳腺癌患者,芳香化酶抑制剂(aromatase inhibitor,AI)+CDK4/6抑制剂已成为一线治疗方案。这一方案在异时性转移患者的缓解率中高于起始性转移,并且非内脏转移的患者可获得更长的PFS[45-46],这可能意味着对于肿瘤惰性且负荷小的患者从AI与CDK4/6抑制剂的联合方案中获益更大。CIMER(NCT04220476)试验将来曲唑+palbociclib作为OMBC一线内分泌治疗的同时,对试验组患者行所有病灶SBRT(50 Gy/5次)(表2)。

表1 SBRT联合免疫治疗在OMBC的相关临床研究Tab.1 Clinical trials in OMBC treated with SBRT with immunotherapy
在HER2+患者中,脑转移的发生风险很高[47]。由于血脑屏障的影响,脑转移更依赖于局部治疗。因此对于HER2+的脑寡转移患者,局部治疗联合靶向治疗是否有效仍需进一步探索。由于拉帕替尼可以透过血脑屏障[48],Ⅱ期随机研究(NCT01622868)拟对少于10个脑转移灶的乳腺癌患者行SRS联合拉帕替尼是否优于单用SRS进行探索(表2)。
但是,SBRT与系统治疗的使用时间和顺序仍未达成共识。多数研究在SBRT期间暂停化疗,但允许同步靶向或内分泌治疗。有研究认为,在发现寡转移病灶1个月内开始SBRT有利于PFS[23]。因此如何尽早开始SBRT又不影响系统治疗的干预需要进一步研究。
4.3 SBRT联合全身治疗在不同寡转移部位的疗效差异
对于不同寡转移部位的乳腺癌患者而言,SBRT联合基于分子分型全身治疗的局部控制率或生存结局存在差异。骨是乳腺癌常见的转移部位。对仅1~3个骨转移灶的OMBC患者行全身治疗及所有转移灶SABR后2年的局部控制率和PFS分别为100%和65%[13]。肝和肺也是乳腺癌常见的转移部位,对肝和(或)肺内1~3个转移灶的OMBC患者经全身治疗联合SBRT后,2年局部控制率、PFS和OS分别为90%、27%和66%[27]。对肝脏寡转移的OMBC患者进行的回顾性分析显示,2年OS为57%[49]。另一项Ⅱ期研究报道了肝脏寡转移乳腺癌患者5年的随访结果,局部控制率达86.1%[50]。而脑转移由于血脑屏障的限制,更依赖于局部治疗。Yang等[51]对脑寡转移乳腺癌的回顾性分析发现,2年局部控制率和OS分别为71%和41%,表明骨寡转移患者SBRT联合全身治疗能取得优于其他部位寡转移患者的疗效,肝和肺寡转移患者的局部控制率并不差,但是PFS低,可能是因为更多的后续转移灶发生。不同转移部位、不同分子分型可能都会影响SBRT联合系统治疗的疗效,个体化评估和策略制定是非常重要的。
由于远隔效应的可能性,不同寡转移部位是否影响SBRT联合免疫治疗的效果也需要深入探究。一项Ⅱ期单臂研究对转移性TNBC行pembrolizumab联合放疗(30 Gy/5次),13周后4/9的患者疾病稳定或缓解,但由于病例数过少,该研究并未对不同转移部位的疗效差异进行比较[52]。Ko等[53]学者认为,放疗可以增加肿瘤细胞的突变负荷,因此放疗结合免疫治疗的模式更适合于低肿瘤突变负荷(tumor mutation burden,TMB)的患者,而不同寡转移部位的TMB可能有所不同。并且不同寡转移部位的免疫微环境存在差异,加上放疗免疫抑制和免疫活化的双向作用取决于不同放疗部位,这些都可能导致不同寡转移部位影响SBRT联合免疫治疗的效果[54],需要后续临床研究的进一步探索。
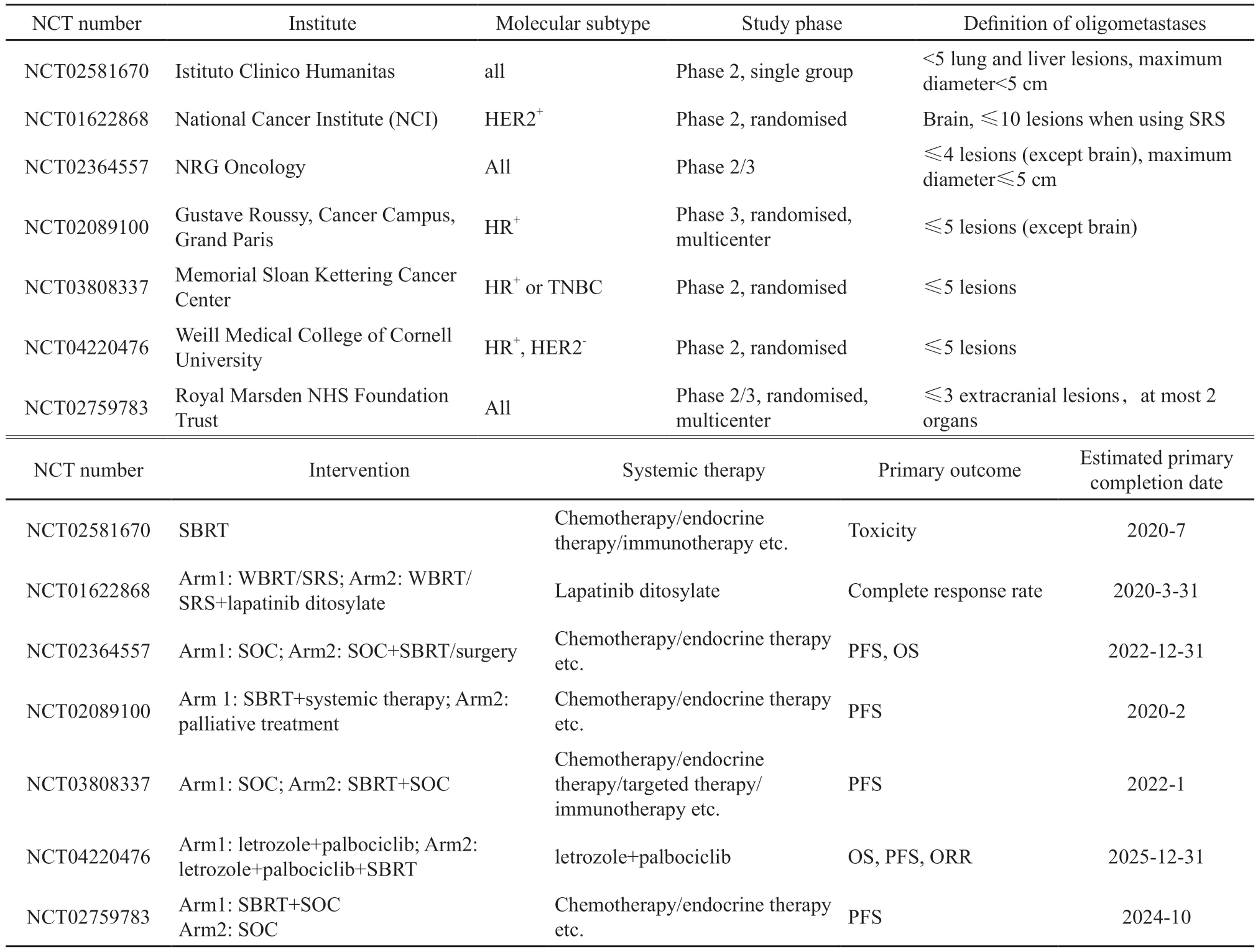
表2 SBRT联合其他系统治疗在OMBC的相关临床研究Tab.2 Clinical trials in OMBC treated with SBRT with other systemic therapy
5 小结
SBRT联合系统性治疗在OMBC中的应用备受关注。未来需要解决的问题包括:①统一寡转移的定义;② 加强关于寡转移相关生物学标志的基础研究,筛选出真正能从SBRT获益的OMBC;③确定SBRT的最佳剂量分割,使毒性最小化,疗效最大化;④ 明确SBRT联合系统治疗的最佳时序;⑤ 探究不同寡转移部位对SBRT联合系统治疗的影响。期待更多Ⅲ期临床研究通过长期随访,确认SBRT联合系统治疗是否优于当下的标准治疗方式。
