保留乳房治疗专家共识(2020年版)
2021-01-18中国抗癌协会乳腺癌专业委员会中国医师协会外科医师分会乳腺外科医师委员会
中国抗癌协会乳腺癌专业委员会,中国医师协会外科医师分会乳腺外科医师委员会
1 前言
1.1 背景
2016年,1篇发表在国际著名肿瘤学期刊Lancet Oncol上的文章引起了医学界广泛的关注,文章报道了一项基于荷兰国家癌症登记数据库2000—2004年的真实世界数据所进行的大型队列研究,结果发现,早期乳腺癌患者接受保乳手术加放疗的10年乳腺癌相关生存率优于接受全乳切除的患者;而保乳手术加放疗的10年无远处转移生存的优势可见于T1N0患者,但在更高分期的患者中则未发现[1]。这项分析同此前一些相对小样本的研究一起向世人传递出一个新的信号,早期乳腺癌患者如果接受保留乳房治疗不仅比全乳切除手术创伤小和更美观,而且还可能有生存上的获益[2-8]。这无疑会提振那些有意向接受保留乳房治疗的患者的信心,同时也会使一部分乳腺外科医师与患者的术前谈话方式发生微妙的改变。
自从1971年,Fisher等[9]根据NSABP B-04的研究结果首次提出“乳房和腋窝的不同处理方式或处理范围并不影响患者的预后”以来,人们对于乳腺癌保留乳房治疗就开始了一段积极的探索之路。欧美国家先后开展了NSABP B-06、Milan-1、EORTC 10801等大型前瞻性随机对照研究[10-15]。在经过长达20年的跟踪随访之后,上述研究几乎一致地发现保乳手术联合术后全乳放疗(whole breast irradiation,WBI)与全乳切除的疗效是相当的。因此,从20世纪80年代开始保乳治疗很快取代全乳切除术成为欧美地区早期乳腺癌的首选治疗措施,来自美国的报道显示,保乳率从1988年的18.7%快速跃升到1998年的64.5%[16-18]。然而自2006年开始,欧美一些国家的保乳率出现小幅下滑,全乳切除占比反而上升了约6%[18],其可能的原因是一期乳房重建手术在临床上的推广,当然也包括其他因素如乳腺MRI的应用、乳腺癌易感基因检测技术的普及以及医师和患者对后续局部复发风险及再次治疗的顾虑等。但即便如此,在大多数欧美发达国家,保乳手术的实施仍非常普遍,一项欧洲4个国家(意大利、比利时、德国和瑞士)的2010年早期乳腺癌数据显示,其保乳率达到78%[19]。
亚洲地区保乳手术的实施率普遍要低于西北欧和北美地区,但在亚洲几个相对发达的经济体内近些年报道的保乳率也均超过了40%,例如,日本为59.3%,韩国为62.3%,新加坡为55.8%,中国香港为40.5%[20-23]。
1.2 中国保乳手术现状
在中国大陆地区,从20世纪90年代才开始陆续有报道实施保乳手术,近年来保乳率有一定上升趋势[24-25]。最近一项对全国范围内有一定代表性的、年乳腺癌手术量超过200例的110家医院进行的问卷调查显示,保乳率在40%以上的医院仅占5.5%,保乳率不到20%的医院占一半,保乳率不到10%的医院占16.3%;而且保乳率高低与医院所在地区人均GDP和医院年手术量呈正相关[26]。实际上在更广大的中国欠发达地区以及农村,保乳率小于10%是普遍现象,有些甚至不足5%[27-28]。总体来说,目前中国早期乳腺癌的手术治疗方式仍停留在以全乳切除为主的水平。
分析国内保乳率较低的原因,主要包括主观和客观两个方面。主观原因有:①某些医师对保乳治疗的理念不认同,认为全切就能达到根治效果,这种情况目前虽属于少数,但并不罕见。② 医师对保乳治疗经验不足,将保乳治疗的适应证控制得过于严格,由于在保乳治疗方面起步相对较晚,所以即便是在中国的一些城市地区保乳经验的缺乏仍属于普遍现象,农村地区更是如此。③医师怕承担责任,顾虑一旦患者局部复发容易引起纠纷,而且由于现阶段中国乳腺癌幸存患者中保乳患者比例尚低,因此认为替患者选择全乳切除术更简单明了的医师也不少。客观原因有:①医疗资源不足和不均衡,主要是放疗设备的缺乏,医疗资源多集中在大医院,对于家离医院较远的患者不便利,手术后的多次放疗、往返治疗也需付出大量时间和交通成本,因而令医师和患者放弃。个别县级医院目前还存在乳腺影像学和病理学评估团队跟不上需求的情况。② 患者经济条件不允许且未被医保覆盖,多见于少数经济欠发达地区和农村。③民众对乳腺癌防范意识较淡,多数患者就诊时已经失去保乳机会,多见于医疗卫生欠发达的地区。保乳手术是能充分体现乳腺癌多学科诊疗全程管理水平的外科技术之一,从患者选择、外科实施到术前术后治疗都依赖于病理学、影像学、肿瘤内科及整形外科的协作。一台“完美”的保乳手术,一定是多学科参与并实现流程最优化的结果。
1.3 现有指南与规范
从指南和规范看,由邵志敏教授牵头每2年更新和发表于《中国癌症杂志》的《中国抗癌协会乳腺癌诊治指南与规范(2019年版)》第7章浸润性乳腺癌保乳治疗临床指南对保乳的外科技术(适应证、禁忌证、局部复发高危因素及术前谈话)、病理取材及术后放疗分别进行了专门的叙述,其他影像学、病理学等章节也对涉及保乳的内容进行了补充[29]。2019年,中华医学会外科分会乳腺外科学组由宋尔卫院士牵头,在《中华外科杂志》全文刊发了《早期乳腺癌保留乳房手术中国专家共识(2019版)》,对保乳手术的适应证、禁忌证、术前准备、术前谈话、手术实施也进行了分章节详述[30]。2018年由中国抗癌协会乳腺癌专业委员会和中国医师协会外科医师分会乳腺外科医师专委会发布的《乳腺肿瘤整形与乳房重建专家共识(2018年版)》则对肿瘤整形手术(oncoplastic surgery,OPS)在乳腺癌中的应用进行了共识要点阐述和临床证据分析[31]。美国、欧洲、日本等乳腺外科医师协会/行业专业委员会也发布了一系列保乳的技术指南和关于切缘、放疗、OPS的指南更新。
1.4 指南要点、形式与内容特点
随着民众对癌症防治认知程度的不断提高,以及中国医疗整体水平的上升,今后中国大陆地区实施乳腺癌保乳治疗的患者比例一定会持续提高。因此,对于广大医务工作者而言,应该顺应这种潮流和形势,坚决克服理念缺乏、经验不足和怕担责任等主观存在的障碍,加强业务学习和经验交流,从而缩短与发达国家在早期乳腺癌手术治疗方面的差距,更好地为中国乳腺癌患者服务。衷心希望这样一部由来自全国各地资深专家们集体编撰的《保留乳房治疗专家共识(2020年版)》可以为广大中国医师的临床实践工作提供有益的指导和参考。
本共识专家组以中国抗癌协会乳腺癌专业委员会委员、中国医师协会外科医师分会乳腺外科医师专委会委员为主体,核心成员涵盖乳腺外科、肿瘤内科、放疗科、病理科、影像科、整形外科及护理等学科,包含保乳手术的指征、影像学评估、病理学评估、手术技术、术后放疗、局部复发及处理、特殊情况下的保乳治疗及保乳术后随访等方面,由执笔专家撰写共识初稿,并经专业委员会常委及多学科资深专家提供修改建议和意见,最终编撰而成。
本共识以“专家共识推荐”的形式进行要点归纳和推荐,同时列出相关临床证据水平及专家推荐级别。编撰小组通过查阅文献(截至2020年5月),反复讨论论证成文,辅以核心要点的数据解读以飨读者。
1.5 共识的证据级别
专家小组对证据和共识的分类采用卫生系统中证据推荐分级的评估、制订与评价(The Grading of Recommendations Assessment,Development and Evaluation,GRADE)系统。
证据级别
⑴ 高质量:证据基于高水平前瞻性随机对照研究或随机对照临床试验的Meta分析,研究结果具有高度可信性和推广性。
⑵ 中等质量:证据基于低水平随机临床试验或设计良好的非对照试验或队列研究,可信度一般。
⑶ 低质量:证据基于病例对照研究、回顾性研究、亚组分析、专家共识或科学假设,可信度较低。
推荐级别
⑴ 强推荐:证据级别较高,结果与因素具有显著相关性时,专家组给予强推荐。
⑵ 一般推荐:证据级别较低,结果与因素相关性不显著或无明确证据显示相关性时,专家组给予一般推荐。
2 保乳指征
2.1 共识要点
⑴ 保乳手术的适应证:针对有保乳意愿,能够达到切缘阴性及满意外形效果的患者。
证据级别:中等质量;推荐级别:强推荐。
⑵ 保乳手术的绝对禁忌证:病灶广泛且难以达到切缘阴性,不可耐受放疗的患者。
证据级别:高质量;推荐级别:强推荐。
⑶ 保乳手术局部复发的高危因素包括活动性结缔组织病,同侧乳房既往接受过乳腺或胸壁放疗,肿瘤直径大于5 cm,侵犯乳头,切缘接近,已知乳腺癌遗传易感性强等临床病理学特征。患者在充分知情的情况下,可以选择行保乳手术。
证据级别:中等质量;推荐级别:一般推荐。
2.2 文献数据解读
自19世纪80年代开始,多项国际多中心前瞻性临床试验通过长达20年的随访数据证实,对早期乳腺癌进行保乳手术是安全、等效的一种手术方式。循证医学数据显示,保乳手术在切缘阴性的基础上联合局部放疗,能达到与全乳切除术疗效一致而生活质量显著提高,保乳手术已经成为早期乳腺癌标准的治疗策略[1-2]。
然而详细参阅全球不同国家、协会所制订的保乳手术指征,彼此之间仍存在着较大差异。
例如国际上应用较广泛的美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南[3]并无明确适应证的条目,提示符合切缘阴性以及满意的外形即可保乳。在绝对禁忌证中,罗列了妊娠期间放疗、弥漫恶性特征钙化、病灶广泛虽达到切缘阴性但无法获得满意外形、弥漫切缘阳性、ATM基因突变等内容,然而对肿瘤大小、肿瘤位置、患者意愿、炎性乳腺癌、是否接受新辅助治疗、是否多个病灶等均未涉及。特别是多中心、多灶性乳腺癌,近期针对10项研究、19272例患者进行的Meta分析发现,多中心、多灶性乳腺癌患者保乳术后累积局部复发风险为5.6%,而单病灶保乳术后局部复发风险为4.2%,多中心、多灶性乳腺癌患者全乳切除术后局部复发风险仅为2.0%[4]。因此由美国乳腺外科医师协会(American Society of Breast Surgeons,ASBS)制订的保乳指南[5]提出多中心(两个及以上象限受累)、炎性乳腺癌等情形为保乳手术绝对禁忌证,并将非常大的乳房、肿瘤与乳房体积比较大、新辅助治疗降期等情形罗列为相对禁忌证。两个指南另一项明显的争议在于“切缘阳性”是否可以保乳。NCCN指南认为切缘局灶阳性[显微镜下局灶阳性,无广泛导管内癌成分(extensive intraductal component,EIC)]是保乳的相对禁忌证,无需补充广泛切除,可采用后续瘤床加量放疗,然而ASBS指南认定切缘阳性必须补充切除手术,如果持续阳性则为保乳的绝对禁忌证。德国妇科肿瘤小组(German Gynecological Oncology Group,AGO)指南[6]则更为强调切缘阴性的重要性,首先认定墨染切缘无肿瘤累及(no ink on tumor)是切缘阴性的定义,推荐一系列的外科操作方法,包括术中超声引导、术中切缘接近的补充广泛切除、石蜡切片中切缘阳性的再次手术等,以获取最终切缘阴性,认定如补充切除后切缘仍呈阳性或诊断为炎性乳腺癌,不推荐行保乳手术。
因此从中国的临床实践出发,合理参考国际指南和共识,结合中国当前国情[7],制订明确、可操作的保乳手术指征,是确保乳腺癌患者肿瘤治疗效果,提升其满意度和生活质量的前提、基础与根本保障。
2.2.1 保乳治疗的适应证
主要针对有保乳意愿,切缘阴性且术后能够达到良好乳房外形效果的患者。
⑴ 临床Ⅰ、Ⅱ期的早期乳腺癌:肿瘤大小属于T1和T2分期,且乳房有适当体积,肿瘤与乳房体积比适当,术后能够保持良好乳房外形的早期乳腺癌患者。对于多灶性乳腺癌(同一个象限的多个病灶),也可尝试进行保乳手术。
⑵ Ⅲ期患者(炎性乳腺癌除外):经术前治疗降期后达到保乳手术标准时也可以慎重考虑。
2.2.2 保乳治疗的绝对禁忌证
⑴ 妊娠期间放疗:对于部分妊娠期患者,可以在妊娠期完成保乳手术,放疗在分娩后进行。
⑵ 病变广泛,且难以达到切缘阴性或理想外形。
⑶ 弥漫分布的恶性特征钙化灶。
⑷ 肿瘤经局部广泛切除后切缘阳性,再次切除后仍不能保证病理学切缘阴性者。
⑸ 炎性乳腺癌。
2.2.3 保乳治疗后与局部复发相关的危险因素
国际上多项指南和共识,将部分不太适合进行保乳手术的情形归纳为“相对禁忌证”,在临床实践中可能导致不必要的争议。因此,专家组经讨论后建议按照“保乳术后与局部复发风险相关的因素”进行筛选和罗列。本共识认为存在以下因素的患者,可以有选择地进行保乳手术,但需强调术前对患者进行详细的说明并签署知情同意书,存在以下因素将导致更高的局部复发风险,患者在充分知情的前提下可以选择行保乳手术。
⑴ 活动性结缔组织病,尤其是硬皮病和系统性红斑狼疮或胶原血管疾病者,对放疗耐受性差。
⑵ 多中心病灶(多中心病灶指在2个或2个以上象限存在1个及以上病灶,或病理学类型和分子分型完全不一样的两个乳腺病灶)。
⑶ 同侧乳房既往接受过乳腺或胸壁放疗者,需获知放疗剂量及放疗野范围。
⑷ 肿瘤直径大于5 cm者。
⑸ 侵犯乳头(如乳头Paget’s病)。
⑹ 已知乳腺癌遗传易感性强(包括BRCA1/2等已知的致病性突变),保乳术后同侧乳腺肿瘤复发(ipsilateral breast tumor recurrence,IBTR)风险增加的患者。
3 保乳手术的影像学评估
3.1 共识要点
⑴ 术前完善影像学评估,包括双侧乳房、腋窝及内乳淋巴结。
证据级别:中等质量;推荐级别:强推荐。
⑵ 推荐乳腺X线检查与MRI评估乳房病灶,超声检查评估腋窝淋巴结。
证据级别:高质量;推荐级别:强推荐。
⑶ 对于临床可疑腋窝淋巴结建议进行病理学检查,可采用超声引导下细针抽吸细胞学检查或空芯针活检来评估。
证据级别:高质量;推荐级别:强推荐。
⑷ 对临床不可触及病灶以及新辅助化疗前的病灶可行影像学引导下空芯针活检(core-needle biopsy,CNB),并放置标记物。
证据级别:中等质量;推荐级别:强推荐。
⑸ 术中保乳标本可考虑行乳腺X线摄片或超声检查,定位并评估切缘。
证据级别:中等质量;推荐级别:一般推荐。
3.2 文献数据解读
3.2.1 保乳术前影像学评估
对拟行保乳或乳房重建手术的患者,术前影像学评估推荐联合多种影像学检查方法,主要包括乳腺X线、乳腺超声与乳腺MRI,评估内容包括双侧乳房、区域淋巴结,主要目的在于协助临床医师纳入符合保乳条件的患者、排除保乳禁忌证以及明确病灶范围。考虑到乳腺X线与超声检查对多灶多中心病变检出率较低的局限性[1-2],推荐术前行MRI检查,尤其针对腺体致密型患者。MRI的优势包括:①更全面地获知乳房的解剖学特征,如腺体脂肪比例、皮下脂肪厚度、胸壁结构及腋窝等信息;② 更为准确地评估病灶的位置、形态、累及范围、与周围结构的关系,评估乳头乳晕区域是否受累等情况;③对多灶多中心病变有更高的敏感性;④ 检出临床触诊阴性以及对侧乳房的可疑病灶,并能够引导穿刺活检;⑤ 评估内乳淋巴结。目前对保乳手术前乳腺MRI的价值仍存在一定争议,早期的研究结果表明其并不能降低局部复发风险,对远期生存率无影响,未能降低再手术率,且同时增加了全乳切除率[3-5],但由于这些早期的研究设计存在较多局限性,如MRI设备陈旧、MRI引导的活检定位未开展、各中心阅片能力差异、入组患者的选择等不足之处,需要更多设计合理的临床试验进一步验证,目前否认术前MRI的价值尚为时过早[6]。
乳腺X线检查用于观察肿块、结构扭曲、钙化灶,判断钙化灶和肿块的相对位置,以确定手术切除范围。
超声检查对腋窝淋巴结评估准确率较高,且可引导活检,推荐对腋窝淋巴结行超声评估。乳腺PET/CT能够提高多灶多中心病变的检出率,但由于受到空间分辨率限制,对病灶形态范围的精确评估能力有限,较小病灶不易显示,目前在保乳术前评估中的应用价值有限。
3.2.2 术前影像学引导下乳房和腋窝活检
3.2.2.1 影像学引导下对临床不可触及乳房病灶的定位活检
活检方式:影像引导下的空芯针活检、真空辅助活检、导丝定位开放活检。
适应证:①乳腺X线,临床无法触及的钙化、结构扭曲;② 乳腺MRI,临床无法触及且仅在MRI上发现的病灶建议再次行超声复查,若超声能够发现病灶则建议超声引导活检,仍未能发现病灶者行MRI引导下定位/活检;③超声,临床无法触及且仅在超声上显示的病灶。
对拟行保乳手术的患者,MRI定位活检建议仅用于对治疗决策产生影响的病变。乳腺MRI存在较高的假阳性率,建议结合功能成像综合评估以期降低假阳性率,避免误判使原本能够接受保乳手术的患者失去保乳机会或接受不必要的活检。MRI引导下真空活检在乳腺癌患者中的阳性预测值(positive predictive value,PPV)约为70%,高于筛查人群(约33%)[7]。MRI定位活检成功率与雌激素水平密切相关,建议在月经周期第2周进行,行激素替代治疗的患者建议停药4~6周。当MRI引导下的活检在技术上不可行时,可先通过MRI引导下导丝定位后再行手术切除。
3.2.2.2 超声引导下区域淋巴结细针穿刺
美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)、欧洲肿瘤内科学会和中国抗癌协会推荐对影像学评估可疑淋巴结行影像学引导下穿刺活检。其中,超声引导下细针抽吸活检(fine-needle aspiration biopsy,FNAB)以其安全、操作简便的优势成为临床最常用的方法,超声引导不仅能提高取材成功率,也有助于在穿刺过程中避开血管,有利于保护重要组织结构以及判断穿刺后有无血肿发生[2]。但FNAB无法分辨组织结构,不能进行肿瘤免疫组织化学评价,其仅获取细胞学材料,某些形态异常的细胞无法准确判断,这些都可能影响病理学诊断。CNB可以弥补FNAB的不足,但是腋窝淋巴结,尤其是锁骨区域淋巴结多与血管、神经伴行,穿刺时应在准确的超声引导下谨慎操作,避免造成附带损伤。推荐选择超声引导下对临床可疑区域淋巴结进行穿刺活检以明确诊断,并根据患者的淋巴结状态、临床诊断需求以及穿刺医师的经验酌情选择FNAB或CNB。
超声影像上见淋巴结皮质增厚>3 mm或偏心性增厚;淋巴门结构消失或淋巴结纵径增加都提示淋巴结转移的可能。超声检查判断腋窝淋巴结转移的灵敏度在25%~87%,特异度在77%~100%。对超声检查可疑的腋窝淋巴结进行穿刺活检可显著提高判断淋巴结阳性的灵敏度和特异度。当有多个可疑的腋窝淋巴结时,宜选取最可疑的淋巴结进行超声引导下FNAB并记录可疑淋巴结数目[8-9]。
3.2.2.3 超声引导下前哨淋巴结活检(sentinel lymph node biopsy,SLNB)
超声造影可有效地引导定位SLNB[10]。Zhou等[11]通过回顾性分析认为,超声造影+蓝染料示踪与吲哚菁绿(ICG)+蓝染料的方法效果相当,检出率分别为98.4%和98.1%。目前关于该技术的研究仍处于小样本探索阶段,需要更多大样本随机临床试验的验证,以进一步完善这种系统,提高灵敏度,为外科SLNB提供替代方法。
PEONY研究发现,新辅助化疗后腋窝淋巴结由阳性转为阴性而人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性的患者中,尽管使用双示踪剂引导行SLNB,假阴性率仍高达17.2%。SENTINA及ACOSOG Z1071等研究均指出,在新辅助化疗后使用双示踪剂法进行SLNB、检出的SLN数量在3枚及以上、治疗前标记物标记或使用腋窝超声筛选患者等能够使得SLNB的假阴性率处于可接受的范围内[1,12-17]。
3.2.3 新辅助化疗前、后乳房和腋窝病灶的定位方式
3.2.3.1 新辅助化疗患者乳房病灶的定位
新辅助化疗前可通过影像学引导(常用超声)在病灶中心或病灶边缘处放置钛夹,有助于寻找手术区域、引导病理标本的取材[18]。相关临床试验显示,金属标记物有助于保乳术前评估并使5年局部控制率提高6.9%[19],但需同时考虑钛夹在MR图像上形成的伪影所致的假阴性。
新辅助化疗后残留病灶较小临床无法触及时推荐通过影像学引导下导丝定位后行手术切除。新辅助化疗后影像学完全缓解者存在约10%的假阴性,如治疗前未放置标记物,建议参考基线检查中病灶的位置予以定位后再行手术。
5%~20%的患者术中无法定位标记物,需术前或术中再定位。术前导丝定位、注射染料或同位素示踪剂可提高术中乳腺标记物检出率;离体切除标本再利用术中X线摄影、超声检查有助于标记物再确认。
基线含有恶性钙化的病灶在行保乳手术前建议对钙化行X线立体定位并明确钙化灶范围,确保将钙化灶完整切除。
3.2.3.2 新辅助化疗患者腋窝转移淋巴结放置标记物
新辅助化疗前阳性淋巴结放置标记物,术前导丝定位,准确定位切除阳性淋巴结,能够提高腋窝手术的准确性,对新辅助治疗后降期保乳的患者推荐对穿刺阳性的淋巴结进行标记定位。是否所有接受新辅助治疗的患者都需要标记阳性淋巴结尚无定论,尽管中国专家对降期保腋窝持审慎观点,87%的专家推荐行阳性淋巴结标记,以利于后期新辅助治疗过程中和术后的淋巴结状态评估[20]。
新辅助治疗后将标记淋巴结和前哨淋巴结同时切除的腋窝手术方式,称为靶向腋窝清扫术(targeted axillary dissection,TAD)。新辅助治疗后临床和影像学评估腋窝淋巴结阴性的患者可以考虑TAD。对于淋巴结阳性的乳腺癌患者经新辅助治疗后临床淋巴结阴性者,TAD可以降低SLNB的假阴性率,低至2%[21]。高达20%病例中,标记的淋巴结并非前哨淋巴结,因此仍需不断改进定位的方式,包括导丝定位、放置核素粒子或磁性反射物标记、纹身标记等[22-24]。
新辅助治疗后手术前,对标记的淋巴结进行评估,可以确定哪些患者需要接受腋窝淋巴结清扫。研究表明,化疗后标记淋巴结细针抽吸细胞学检查的灵敏度为42.2%,特异度为100%,阴性预测值40.6%,假阴性率53%,细针抽吸细胞学检查预测残余病变的精确性仍不理想[25-28]。
3.2.3.3 标记物放置时机
乳腺原发灶建议在新辅助治疗前或治疗2个周期后病灶缩小时放置,腋窝淋巴结在病理学检查证实为转移后即可放置。
3.2.3.4 标记物放置数量
目前乳腺标记物放置数量尚无标准。兼顾定位准确性和节省费用,建议乳腺原发灶中心放置1枚,如病灶周围放置4枚则可更准确地评估肿瘤切缘;转移腋窝淋巴结放置1枚。
3.2.3.5 标记物放置影像学方法选择
超声引导下放置标记物准确性更高[29],优先推荐。目前国内已上市产品均不适合在MRI下放置[30]。
3.2.4 术中影像学引导的保乳手术及组织标本的影像学评估
3.2.4.1 术中超声引导的保乳手术
对于临床不可触及病灶的患者,应根据术前肿瘤定位信息确定切除范围,术中超声引导可以提高保乳手术切除的准确性。对于新辅助治疗后降期的乳腺癌病灶,部分治疗后病灶退缩为多灶性小病灶,术前、术中的影像学检查对保证切缘阴性尤为重要,术中超声引导定位可显著地降低患者切缘阳性率和再切除率。与此同时,保乳术中超声引导定位可以在保证切缘安全的前提下,有效地减少过多的正常乳腺组织切除,进而能改善患者的乳房外观及满意度[27]。
3.2.4.2 超声检查在术中标本评估中的作用
术中标本超声(intraoperative specimen ultrasonography,IOUS)检查,通过测量标本内病灶低回声边缘至标本边缘(上、下、内、外切缘)的辐射状距离,以评估保乳术是否达到适宜的切缘,给术者提供即刻的切缘信息。超声仪器的可移动性,也为手术室放置超声仪器,进而实时超声评估保乳术中标本提供了可行性。
3.2.4.3 乳腺X线检查在术中标本评估中的作用
乳腺X线检查包含恶性钙化或结构扭曲的保乳手术标本,术中行X线摄片以明确病灶是否被完整切除以及病灶和各切缘的位置关系;对新辅助治疗前/后放置过标记物的组织标本行X线摄片有助于确保病理取材部位准确。
根据《中国抗癌协会乳腺癌诊治指南与规范(2019年版)》[26],术中组织标本影像学评估注意事项:①术中组织标本需行摄片记录病灶和穿刺针的位置;② 钙化灶标本应立即摄片,观察目标钙化灶是否被完整取出;③标本离体后可考虑用标记物标记切缘的4个方向再进行摄片,以利于在X线片上评估钙化灶在标本上的确切位置以确定补充切除的方向;④ 推荐将影像学资料与标本一同送病理科供病理科医师参考。
基于3个大型临床研究EORTC22922、10925和MA20的Meta分析以及法国研究的结果,对于高危的患者淋巴结阳性或肿瘤位于中央或内侧区域进行内乳以及锁骨区域的放疗有助于延长总生存率,降低局部和远期复发率[31]。既往术中内乳淋巴结活检的研究显示,内乳淋巴结阳性率因肿瘤所在象限不同而异,为10%~40%,但全身系统治疗后内乳淋巴结复发率小于5%[26]。一些腋窝阴性的患者也可能发现内乳淋巴结转移,所以目前的内乳淋巴结放疗可能存在过度治疗以及低估治疗的风险,有一定争议。
2020年王永胜教授团队发布研究结果,在腋窝淋巴结阳性的患者中,进行内乳SLNB,创伤较小,未化疗患者中的检出率超过70%;其内乳淋巴结转移率在初次手术者为39.8%,新辅助治疗后为13.3%[32]。乳腺MRI用于评估内乳淋巴结转移也有很好的表现[33-34]。对于保乳手术的患者,术前腋窝淋巴结证实阳性,以及MRI或CT等影像学检查提示内乳淋巴结转移,可尝试行内乳前哨淋巴结评估或行内乳区淋巴结活检。
内乳淋巴结在超声、CT、MRI、PET/CT上的显示率分别约为10%、16%、16%、14%[35-36]。影像学鉴别良恶性主要基于解剖学特征,短径>1 cm、淋巴门消失、长短比<2、不均匀强化的内乳淋巴结需考虑转移,PET/CT能够提高诊断灵敏度,但对<1 cm的内乳淋巴结鉴别诊断仍然存在较大困难。内乳淋巴结核素显像率较低,且容易受到注射部位及剂量的影响。目前,影像学对内乳淋巴结转移的诊断标准尚未确立,联合多种影像学方法综合评估以及应用新技术能够提高诊断准确性,多项研究指出影像学提示增大的内乳淋巴结与疾病预后相关,虽然目前影像学对内乳淋巴结评估的灵敏度及特异度难以满足临床需求,但对于疾病分期及制定治疗方案仍然具有较大的参考价值[37-38]。
4 保乳手术的病理学评估
4.1 共识要点
⑴ 对保乳手术标本切缘应进行规范的病理学评估。
证据级别:高质量;推荐级别:强推荐。
⑵ 建议在取材前,对保乳手术标本切缘进行染料染色,以便判断真正的手术切缘和切缘距离。
证据级别:高质量;推荐级别:强推荐。
⑶ 保乳标本切缘取材方法包括垂直切缘放射状取材和切缘离断取材。
证据级别:高质量;推荐级别:强推荐。
⑷ 保乳手术切缘的病理学评估报告中建议包括以下内容:墨染切缘状态(阳性或阴性),各切缘与肿瘤的距离,以及距切缘最近处肿瘤的类型(原位癌或浸润性癌)。
证据级别:高质量;推荐级别:强推荐。
⑸ 保乳标本“阳性切缘”指墨染切缘处有导管原位癌(ductal carcinomain situ,DCIS)或浸润性癌侵犯。接受WBI的Ⅰ和Ⅱ期浸润性癌保乳患者,“墨染切缘处无肿瘤”为“阴性切缘”。接受WBI的DCIS保乳患者,“墨染切缘距肿瘤2 mm”为“安全距离”。
证据级别:高质量;推荐级别:强推荐。
4.2 文献数据解读
乳腺癌保乳标本的病理学评估主要包括病变性质的判断和切缘的评价,其中切缘状态是影响患者局部复发的重要因素。保乳标本上病变可表现为明确的肿块,也可表现为散在的颗粒样区域。以钙化灶为临床表现的DCIS,建议对照乳腺钼靶X线摄片对可疑病变和切缘进行取材。保乳手术需要报告6个手术切面(前、后、上、下、内、外侧)的切缘状态。保乳标本切缘取材主要有2种方法:垂直切缘放射状取材和切缘离断取材[1]。无论采取何种取材方法,建议在取材前结合外科标记将标本切缘涂上染料,有条件的单位可将6处标本切缘涂上不同颜色的染料,以便在镜下观察时能对手术切缘作出准确的定位,并正确测量肿瘤和切缘的距离。①垂直切缘放射状取材(图1):根据手术医师对保乳标本做出的方位标记,垂直于基底将标本平行切成多个薄片(建议间隔5 mm),观察每个切面的情况。描述肿瘤大小、所在位置及肿瘤距各切缘的距离,取材时将大体离肿瘤较近处的切缘(如小于10 mm)与肿瘤一起全部取材,大体离肿瘤较远处的切缘抽样取材。镜下观察时根据不同颜色对切缘做出定位,并通过目镜中的标尺测量切缘与肿瘤的距离。② 切缘离断取材(图2):将6处切缘组织离断2~3 mm厚度,离断的切缘组织全部取材,镜下观察切缘的累犯情况。两种方法各有优缺点。“垂直切缘放射状取材”的优点是能准确测量病变与切缘的距离,缺点是工作量较大。“切缘离断取材”的优点是取材量相对较少,能通过较少的切片对所有的切缘情况进行镜下观察,缺点是不能准确测量病变与切缘的距离。研究表明,不同的取材方法会导致切缘阳性率的差别,与“垂直切缘放射状取材”相比,“切缘离断取材”的标本切缘阳性率相对较高[2]。切缘与肿瘤的距离会影响临床进一步的治疗策略,因此有条件的病理中心应首选垂直切缘放射状取材。补充切缘送检时,若外科医师对补充切缘中真正的切缘做了标记,可用染料对真正切缘处进行涂色,并垂直于标记处切缘将标本连续切开并送检。保乳标本手术切缘的病理学评估需建立在常规标本切缘充分取材的基础上。保乳标本切缘术中评估的目的是明确切缘情况,以便及时采取进一步的手术方案。术中冷冻切片检查是常用的术中病理学评估方法,但术中病理学评估在实际操作中存在诸多问题。首先是切缘取材的局限性,术中由于时间所限,只能在6处手术切面抽样取材做冷冻切片检查,并不能代表所有切缘的情况。其次,由于切缘组织常含有较多脂肪,冷冻制片有一定难度,可能会影响诊断的准确性,存在一定的假阴性和假阳性。第三,多块组织的取材、制片和报告耗时较长,从而影响手术进度。术中细胞印片是另一种保乳标本的术中评估方法,其原理为癌细胞比良性细胞更容易黏附于载玻片表面,因此可以对标本切缘表面做细胞印片,来评价切缘情况。术中细胞印片具有快速、经济等优点。但是术中细胞印片也有明显的缺点:容易造成人工假象;对小叶性肿瘤评估效果差;只能评价切缘表面情况,无法提示病变与切缘的距离等,上述缺点限制了术中细胞印片在实际工作中的应用。

图1 垂直切缘放射状取材

图2 切缘离断取材
浸润性癌保乳标本“阳性切缘”是指显微镜下墨染切缘处有导管原位癌或浸润性癌侵犯。如墨染切缘处有肿瘤累犯,IBTR风险增加至少2倍,且复发风险的增加不会因放疗、全身治疗或良好的生物学特征而降低[3]。部分文献有“接近切缘”的定义,近切缘的定义不统一,1~10 mm不等。对于Ⅰ和Ⅱ期浸润性癌保乳后行WBI的患者,美国肿瘤外科和放疗学会建议“墨染切缘处无肿瘤”为“阴性切缘”[4]。“阴性切缘”的患者经WBI后,IBTR风险显著降低,更宽的切缘并不能使复发风险显著降低。对19项(包含13081例患者)回顾性研究的Meta分析显示,切缘1、2、5、>5 mm与局部复发风险的差异无关[4]。对于预后较差的分子亚型(如三阴性乳腺癌),尚无足够的证据显示需要更宽的手术切缘[5]。浸润性小叶癌无需更宽的阴性切缘[6]。经典型小叶原位癌目前被认为是一类癌前病变,保乳手术切缘上出现经典型小叶原位癌不会影响同侧乳腺肿瘤局部复发风险,因此手术切缘存在经典型小叶原位癌并非二次手术的指征。保乳手术切缘上出现多形性小叶原位癌的意义目前尚不明确,有研究显示,多形性小叶原位癌的临床生物学行为更接近于高级别DCIS,手术切缘上存在多形性小叶原位癌可能导致局部复发风险的增加[7]。
DCIS保乳标本“阳性切缘”是指显微镜下墨染切缘处有DCIS侵犯。如墨染切缘处有DCIS,则IBTR风险显著增加,且复发风险的增加不会因WBI而降低[8]。DCIS的导管常被间断性累及,其间经常存在组织学上正常的区域,因此任何阴性切缘都不能完全保证没有残余病灶。对DCIS保乳后行WBI的患者,切缘与肿瘤的距离达到2 mm,IBTR率便显著降低,即使有少量肿瘤的残留,也可通过后续WBI得到控制,更宽的切缘并不能使复发风险进一步降低[9]。美国肿瘤外科、放疗和肿瘤内科学会联合颁布的“接受全乳放疗的DCIS保乳切缘指南”建议墨染切缘距肿瘤2 mm为安全距离[10]。DCIS患者的预后不利因素主要包括粉刺样坏死、高级别、肿瘤较大、年轻患者、雌激素受体(estrogen receptor,ER)阴性或多基因预测系统提示高风险等,这些高风险DCIS患者是否需要更宽的保乳手术切缘仍有待进一步研究。
DCIS伴微浸润(尤其是单灶微浸润)患者的IBTR风险与DCIS相似,因此对于DCIS伴微浸润保乳标本的手术切缘评估更倾向于采用DCIS的标准[11]。浸润性癌伴EIC的保乳标本切缘评估标准目前尚有争议。EIC是局部复发的高危因素。当发现或怀疑存在EIC时,提示乳腺中可能还有较多DCIS残留。浸润性癌伴EIC的生物学行为主要取决于浸润性癌成分,当保乳墨染切缘阴性时,具有EIC的浸润性癌患者IBTR风险并未显著增高[12]。因此浸润性癌伴EIC的患者其保乳切缘的评估标准更倾向参照浸润性癌,即阴性切缘定义为“墨染切缘处无肿瘤”,但如患者有其他预后不良因素(如多处切缘离肿瘤较近、年轻患者等),外科医师可考虑对这些患者行再次扩大切除手术。
目前国际上尚缺乏公认的新辅助治疗后保乳切缘阴性的标准。《中国乳腺癌新辅助治疗专家共识(2019年版)》推荐将切缘无肿瘤区域2 mm以上定义为病理切缘阴性[13]。2019年St.Gallen共识建议将新辅助治疗后保乳切缘阴性定义为墨染切缘处无肿瘤[14]。当新辅助治疗后残余浸润性癌呈散在多灶分布时,“纤维化瘤床出现在阴性切缘”提示切缘可能为假阴性[15]。《乳腺癌新辅助治疗的病理诊断专家共识(2020版)》建议客观报告新辅助治疗后保乳标本切缘状态,不推荐通过冷冻切片检查评估新辅助治疗后保乳标本的切缘状态[16]。
保乳标本切缘的病理学评估报告中应包括以下内容[17](图3):墨染切缘状态(阳性或阴性),各切缘距肿瘤的距离,阳性切缘及距切缘最近处肿瘤的类型(DCIS或浸润性癌)。墨染切缘处无肿瘤累犯的患者,建议报告切缘与肿瘤的距离,应尽量用客观的定量描述,而不建议用主观描述(如距切缘近等)。如肿瘤离切缘较远,镜下无法测量,以大体检查时切缘距肿瘤的肉眼距离为准;如肿瘤距切缘较近,以镜下切缘距肿瘤的距离为准。

图3 保乳手术标本格式化病理报告
5 保乳手术技术
5.1 共识要点
⑴ 外科医师应该在术前对病灶位置、范围、患者乳房大小、下垂度进行全面评估。
证据级别:中等质量;推荐级别:强推荐。
⑵ 应根据肿瘤所在部位、肿瘤整形保乳技术进行合理的切口选择。
证据级别:中等质量;推荐级别:强推荐。
⑶ 术前应合理规划穿刺针道及活检切口位置、方向,尽可能在保乳手术或乳房再造手术时将其切除。
证据级别:中等质量;推荐级别:强推荐。
⑷ 保乳整形手术已成为乳腺癌外科治疗中的重要术式,与常规保乳手术相比,具有相似的肿瘤安全性。
证据级别:中等质量;推荐级别:强推荐。
⑸ 医疗团队应当和患者充分沟通肿瘤整形保乳的利弊,以及可能需要采取的健侧乳房对称性手术。
证据级别:中等质量;推荐级别:强推荐。
⑹ 医疗团队应当规范掌握相关肿瘤外科和整形外科技术,或联合相关学科进行手术设计和实施。
证据级别:中等质量;推荐级别:强推荐。
⑺ 保乳整形手术与较低的切缘阳性率有关,可减少再次手术比例。
证据级别:中等质量;推荐级别:一般推荐。
⑻ 当保乳手术切除组织容量小于20%时,可以采用常规腺体瓣推进技术;当保乳手术切除组织容量为20%~50%时,可以采用适宜的容积移位和容积替代技术;当保乳手术切除组织容量大于50%时,可以采用适宜的乳房再造技术。
证据级别:低质量;推荐级别:一般推荐。
⑼ 容积移位和容积替代是保乳整形手术的主要技术方法,在乳腺癌外科治疗中,应该因人而异地实施保乳整形手术。
证据级别:中等质量;推荐级别:强推荐。
⑽ 常规保乳手术的残腔建议尽可能关闭,根据术中情况决定引流方式;肿瘤整形保乳手术残腔通常建议放置引流。
证据级别:低质量;推荐级别:一般推荐。
⑾ 术中应放置金属夹标记定位,协助精准放疗靶区勾画和瘤床加量。
证据级别:中等质量;推荐级别:强推荐。
⑿ 有必要建立肿瘤整形保乳手术的培训基地,以利于规范该术式的推广、普及。
推荐级别:强推荐。
5.2 文献数据解读
5.2.1 常规保乳技术
5.2.1.1 常规保乳手术切口
乳腺癌保乳手术需通过完整切除肿瘤(肿物切除、象限切除或区段切除术)及周围区域一定量的乳腺组织,根据肿瘤位置和乳腺厚度决定是否行肿瘤表面皮肤、皮下组织及基底部胸大肌筋膜的切除,同时术前活检穿刺针道、开放活检表面皮肤及残腔应尽量给予切除以实现治疗的目的。临床实践过程中,切口的选择应该在保证肿瘤手术安全性(切缘阴性)的同时,兼顾术后美容效果。
手术切口的选择需根据肿瘤的部位、乳房大小及术后美容效果进行合理的术前设计。推荐选择符合皮肤自然纹理(Langer线)的肿物表面切口[1]。肿瘤位于上象限时,可通过采用弧形切口切除肿瘤,并获得较为理想的术后外形。肿瘤位于下象限时,可使用放射状切口切除肿瘤[2]。在少数情况下,保乳手术的切口设计还需兼顾腋窝区域淋巴结的处理。当肿瘤位于外上象限或乳房近腋窝处时,可考虑采取弧形切口以便在切除肿瘤的同时,对腋窝淋巴结进行活检或清扫。
由于双侧乳头位置的对称性及乳房饱满度是术后美学效果评价的重要指标,当肿瘤位于乳头-乳晕复合体附近时,切口设计及手术操作对临床医师提出了更高的要求[2]。环乳晕弧形切口是目前最常用的切口选择,通常情况下可获得较为满意的术后外观[3]。目前肿瘤整形技术发展迅速,其术后美容效果获得广泛认可[4],切口的选择也愈发多样化,例如双环切口、蝙蝠翼切口、J形切口等个体化设计切口[5]。通过合理运用肿瘤整形技术,有望为广大乳腺癌患者提供更为人性化的治疗方案。
5.2.1.2 常规保乳手术残腔的处理
手术残腔止血清洗后,根据移除组织量的多少采取不同缝合措施,切除组织少且乳房相对较大的情况下可直接进行腺体缝合,必要时可沿游离缺损区周围的乳腺组织皮下脂肪层及胸大肌表面腺体,如涉及到乳头乳晕复合体位置的可以潜行游离,通过牵拉缝合利用乳腺腺体瓣充分覆盖缺损残腔区域,可间断全层缝合腺体,切口建议行皮内缝合。另外当肿瘤位于特殊部位或肿瘤与乳房体积比值较大时,常因解剖学特点或切除组织量较大引起外形改变,为确保保乳手术的美容效果可采用OPS,应通过其他部位剩余的临近腺体移位或腺体以外的自体组织来填充手术切除后的残腔以达到美容效果[6-8]。一般认为如切除组织量小于20.0%以下,选用临近腺体推进修复残腔即可,而当组织切除量为20.0%~50.0%时,则需采用肿瘤整形技术予以修复[9],对此本章节后续会进行详细讨论。另有部分学者主张残腔旷置,靠纤维素渗出充填机化,缺点是积液过多需要反复抽吸,并可能造成切口裂开或感染,远期可能局部塌陷而致美容效果不佳,因此不予常规推荐。
5.2.1.3 常规保乳手术后的引流
保乳手术需对肿瘤及周围组织进行完整切除,手术操作将造成一定的组织损伤。引流管的放置与肿瘤位置、切除后残腔大小密切相关。一般情况下,肿瘤切除范围小、周围腺体组织张力小,且修复完好,无需残腔引流,即可直接逐层缝合腺体及皮肤,保持原区域组织结构正常,既可避免创伤,又能减少患者经济和心理负担。当然,如果术中出血较多,可视情况放置引流条1~2 d。如果肿瘤切除范围较大,周围腺体组织张力较大,甚至需要整形手术修复,在彻底止血后,可对残腔周围适当游离,并在残腔内放置持续负压引流管后逐层缝合腺体及皮肤,避免积液过多及肿胀引起外形改变或诱发感染等并发症。术后根据每日引流量,调整负压引流管放置时间,通常可以在术后24~48 h拔除。
5.2.1.4 保乳术区瘤床标记
放疗对于乳腺癌保乳手术有极为重要的意义,既往相关研究均证实保乳手术联合放疗可显著改善患者的生存结局[10],同时各大指南也将放疗作为保乳手术的标准化治疗方案[11-12]。保乳手术的瘤床标记主要是通过术中放置惰性金属夹标记定位,以便于对瘤床进行加量照射或部分乳腺照射区域进行精准勾画。目前最主要的手段是在保乳手术残腔放置钛夹[13],建议在各切缘放置钛夹4~6枚,尽可能在上、下、内、外、基底各放置1枚,上、下、内、外切缘的钛夹应放置在腺体基底与表面之间距离的1/2处[14-15]。
随着新辅助化疗的开展,乳腺癌术前肿瘤瘤床定位对评估疗效、病理取材和指导后续治疗也具有重要意义。乳腺病灶定位标记夹(marker)可以精准置入、定位病灶,并最大限度地减少手术时不必要的乳腺组织或乳房切除[16-17]。对于接受新辅助化疗并有望获得缓解、有保乳意愿的患者,在乳腺病灶定位标记夹的辅助下可实现精准切除,有望进一步降低手术切缘阳性率。推荐术前定位后,在肿瘤瘤床放置金属标记夹,主要采用肿瘤中心点标记夹放置[18]。
5.2.2 OPS技术在保乳手术中的应用
5.2.2.1 定义
乳腺OPS是将肿瘤外科技术和整形外科技术整合,在保证切除足够肿瘤切缘的情况下,修复乳房外形的外科技术。Audretsch[19]在1993年提出肿瘤整形的概念时,指的是利用整形和重建外科技术修复保乳手术造成的乳房缺损。其后有学者认为这一概念不仅可以用于保乳手术,也可以用于部分乳房切除、全乳切除或胸壁手术造成的缺损修复。2019年ASBS将OPS定义为:一种保乳手术,包括切除肿瘤和部分腺体,使用容积移位和容积替代的技术修复同侧乳房缺损,并可能在适当的时候进行对侧乳房对称性的手术[20]。因此,OPS也可以称之为乳腺肿瘤“保乳整形手术”。
5.2.2.2 分类
OPS有过多种分类方法。Clough等[21]通过预估切除腺体体积将保乳整形手术分为两型。Ⅰ型切除体积<20%,通过简单的手术方式(通常是游离腺体),能够修复乳房外观。Ⅱ型切除体积20%~50%,需要较复杂的技术恢复外观,不同象限的手术采取不同的技术。这种分类中,乳腺腺体密度也是重要的考量因素。对于脂肪化的腺体,建议采用Ⅱ型手术技术,避免广泛游离腺体造成的脂肪坏死。Munhoz等[22]综合考虑乳房大小、是否下垂和罩杯尺码将乳房分为Ⅰ、Ⅱ、Ⅲ型,每一型中根据缺损大小,分为A、B、C类,共3型9类。主要整形技术分为6种,包括乳腺组织推进皮瓣、外侧胸背皮瓣、双侧乳房成型术、双侧乳房缩乳成型术、背阔肌肌皮瓣和腹部皮瓣。不同的缺损分类对应相应的整形技术。Hoffmann等[23]则将整形手术按全乳切除和保乳手术分为两型,分别分为6层,共12大类,13个亚分类,39个小类。在第一届保乳整形手术标准国际共识会议上,Clough等[21]提出的两分类法被认为更适合临床应用,而Houssami等[24]的分类法更适用于手术记录和付费系统。
5.2.2.3 适应证
为获得安全切缘需要切除较多腺体组织,导致不能通过简单的腺体和皮肤缝合恢复乳房外观的保乳手术,或肿瘤位置较为特殊,即便切除少量腺体也可能造成乳房畸形,都需要利用整形技术获得满意的外观。中-重度下垂、体积较大的乳房是保乳整形手术的适应证,通常需要同期或分期行健侧乳房对称性手术(根据乳房大小和下垂度的决策流程见图4)。患者此前接受过保乳手术,导致乳房的畸形、不对称、皮肤溃疡及窦道,需要通过延期手术修复乳房外形。

图4 根据乳房大小和下垂度的决策流程
保乳整形手术被认为可以获得更宽的切缘距离。但需要注意的是,一项Meta分析显示,更宽的切缘并不能提高早期乳腺癌保乳手术的局部控制率[25]。2014年美国肿瘤外科协会和美国放射肿瘤协会推荐“墨染切缘无肿瘤累及”作为早期浸润性乳腺癌保乳手术阴性切缘的标准[26]。在临床工作中,没有必要为追求更宽的切缘距离而切除过多的腺体,增加修复的难度。不伴下垂的小乳房、圆锥形乳房、既往接受过乳房整形手术的患者,保留皮肤/乳头乳晕复合体的全乳切除术可能是更好的选择。对外观效果抱有不切实际的要求者、青少年和既往接受过乳腺放疗者是整形手术的相对禁忌证。另外需要注意一些合并症,如未控制的糖尿病、吸烟、老年和胶原病等因素可能增加并发症的机会,影响美学效果。
5.2.2.4 安全性
虽然没有大规模临床试验的支持,但大样本临床观察数据和Meta分析显示,保乳整形手术具有与传统保乳手术相似的肿瘤安全性。美国MD Anderson癌症中心报告了9861例乳腺癌患者的治疗结果,与传统保乳手术相比,保乳整形手术术后血清肿发生率更低(13.4%vs18.0%,P=0.002),而伤口并发症较高(4.8%vs1.4%,P<0.0001),两组的3年无复发生存率和总生存率差异无统计学意义。与全乳切除+乳房成型相比,保乳整形手术的出血、伤口并发症和感染都更低[27]。2016年的1篇系统性综述显示,保乳整形手术的切缘阳性率、再次手术率和转行全乳切除率分别为10.8%、6.0%和6.2%,随访超过5年的研究的总生存率、无病生存率、局部复发率和远处转移率分别为93.4%、85.4%、6.0%和11.9%[28]。在一篇将保乳整形手术和保乳手术进行对比的Meta分析中,发现保乳整形手术的切缘阳性率更低(12%vs21%,P<0.0001),再手术率更低(4.0%vs14.6%,P<0.0001),然而转行全乳切除率更高(6.50%vs3.79%,P<0.0001)。在保乳整形术组随访时间更长的情况下,局部复发率优于单纯保乳术组(4%vs7%)[29]。这些数据说明保乳整形手术可以通过切除更多的组织获得更高比例的阴性切缘,外科并发症不高,且具有较高的肿瘤安全性。
5.2.3 肿瘤整形技术分类
当患者要求行保乳手术时,医师需要在肿瘤切除范围与美学效果之间进行权衡。传统保乳手术后术区的缺损主要使用乳房容积移位,通过乳房腺体位置的调整恢复术后乳房外观。但位于乳房下部的肿瘤,切除范围较大容易产生“鸟嘴样”畸形,当乳房上部乳腺组织较少,肿瘤切除范围较大易产生局部凹陷。OPS与传统肿瘤手术的不同之处在于可利用患处以外的组织修复缺损。在肿瘤整形保乳手术中,腺体切除体积较传统保乳手术可提升约4倍[30],同时不影响术后美学效果。
有研究表明,预计切除乳房体积百分比(estimated percentage of breast volume excised,EPBVE)与保乳术后乳房美容效果密切相关。切除乳房体积10%可作为预测术后美容效果和患者满意度的临界值;但肿瘤所在部位也有一定的影响,当内侧肿瘤的EPBVE大于5%时,美容效果和患者满意度将受到不利影响,但外侧肿瘤的EPBVE超过15%时,美容效果和患者满意度才会受到不利影响[31]。通常认为若切除腺体量低于20%,可采用单纯腺体瓣修复缺损,为一级容积位移手术,不需要整形手术培训。若腺体切除量超过20%[32],甚至部分患者切除量超过15%时,单纯腺体瓣修复已难获得理想的美容效果;对于乳腺组织相对贫乏的乳房内侧,最多允许5%的组织切除量[33],因此肿瘤整形外科应运而生。当切除的腺体小于50%时,也有人认为不超过40%时[33],可采用二级容积移位技术。如果切除超过50%的腺体,其残存组织量不足,需要选择容积替代方案[30,33-34]。若容积替代方案无法获得较佳的美学效果,可考虑保留乳头乳晕或保留皮肤的皮下腺体切除联合乳房再造手术。基于腺体切除量和肿瘤位置的技术方式决策流程见图5。

图5 基于腺体切除量和肿瘤位置的技术方式决策流程
5.2.3.1 容积移位技术
切除腺体量达到一定程度时,直接缝合往往会导致乳房畸形,通常可采用容积移位技术。
⑴ 平行四边形乳房悬吊术:当肿瘤距离乳头乳晕复合体较远时,将传统椭圆形切口或梭行切口设计为平行四边形切口,在切除肿物后可予以对合平行四边形的边缘,从而达到减少乳房形变和乳头乳晕位移的效果。但该术式瘢痕明显,且较大的皮肤切除也会导致乳头乳晕的位移,因此只适用于直径较小的肿瘤[35]。
⑵ 荷包缝合乳房成形术:位于中央区(乳头后或距离乳头2 cm内)的肿瘤,是保留乳头乳晕的禁忌,也是保乳手术的相对禁忌证,但部分患者可接受不保留乳头乳晕的保乳手术。可通过设计环乳晕的圆形切口,切除乳头乳晕复合体及肿瘤至胸肌筋膜层,后逐层荷包缝合闭合切口,达到隐蔽瘢痕的目的。恢复期后可予以乳头再造及乳晕纹刺,获得较佳的术后美容效果[36]。
⑶ 双环法乳房成形术:适合于轻中度下垂的乳房,肿物距离乳头乳晕较近但未浸润至乳头乳晕,对于乳房下垂或乳头乳晕复合体较大的患者尤其适用。设计时内圆切口按照术后需要保留的乳晕直径设计,外圆切口按照肿瘤所在位置设计,非肿瘤区的皮肤去表皮而保留真皮可保证乳头血运。该术式瘢痕隐藏于乳晕外缘,术后美容效果佳。若手术导致双乳不对称,可行对侧乳房对称性手术[35,37]。
⑷ 球拍形切口肿瘤切除乳房成形术:又称为“网球拍法”,是在双环乳晕切口的基础上,向外延伸切除肿瘤所在区域的皮肤和组织。该术式适合各个象限的肿瘤,尤其对于乳房外上象限的肿物,使用该术式可避免乳房上极凹陷,获得较佳的手术效果[38]。同时该术式切除了肿瘤投影表面的皮肤,可适用于需要切除皮肤的肿瘤或术前已行切除活检或穿刺活检的病例。
⑸ “Ω”式肿瘤切除乳房成形术:该术式将切口设计为沿乳晕边缘的半圆与上方半圆平行线加两侧倾斜切口组成,切口形状类似于蝙蝠翼,缝合后形状为“Ω”。该方法适合位于近乳头上方中央区的肿物。其切口隐蔽,且术中若发现乳头后方浸润,该切口设计可方便变更术式为荷包缝合乳房成形术等术式。若上方切除组织过多引起乳头移位,可在乳晕对侧取月牙形切口去表皮后缝合,从而减少乳头的位移;必要时可行对侧乳房对称性手术[39]。
⑹ 下皱襞切口成形术:由Pennisi[40]首先应用,该术式适合距离下皱襞较近的肿瘤,可直接切除下皱襞边缘包含肿瘤的半月形组织后缝合切口重建下皱襞。该方式的优点是手术操作简单,瘢痕可掩盖于下皱襞之中;但该方式不适合较大肿物,因手术有乳头乳晕移位可能,术前需充分设计[36]。
⑺ 内上象限旋转皮瓣法:乳房内上象限肿物切除后常导致内上象限组织凹陷,此时可设计沿乳晕内上的弧形切口及沿乳房上极边缘的弧形切口,此切口可将乳房外上象限腺体转移至乳房内上象限,修复内上象限的缺损,避免乳房内侧凹陷,若患者需行腋窝淋巴结清扫,其切口可暴露术区,利于手术进行[35,39]。但该术式会导致乳房上极的瘢痕,影响着衣美观。
5.2.3.2 容积替代技术
当切除腺体比例较大或切除后采用局部组织修复会形成乳房凹陷等畸形时,需考虑容积替代技术,主要包括邻位皮瓣和远位皮瓣。邻位皮瓣手术操作相对简单,但组织容量有限,仅可修复较小的乳房缺损;相比于邻位皮瓣,远位皮瓣因其选择丰富、可修复较大缺损等优势在临床上适用于多种乳房整形手术。
⑴ 邻位皮瓣:乳房邻位组织瓣是指位于乳房周围的脂肪筋膜瓣、皮肤、皮下组织瓣及带蒂肌皮瓣。脂肪筋膜瓣是深筋膜以及较多、较厚的皮下脂肪组织构成的组织瓣,其解剖深浅平面分别是深筋膜下间隙和皮下疏松组织浅层。肿瘤位于外侧象限(包括外上及外下象限)可采用胸外侧皮瓣[41]、胸侧壁脂肪筋膜瓣[42]等局部组织瓣;肿瘤位于内下象限,可采用乳内动脉穿支瓣[43]、鱼钩样切口旋转瓣[44]。邻位皮瓣还包括腹直肌前鞘筋膜瓣等。邻位皮瓣主要可用于较小的组织及皮肤缺损,根据肿瘤切除的范围设计合适的邻位皮瓣。胸外侧部皮瓣也称腋区皮瓣、腋下皮瓣、侧胸皮瓣、胸背皮瓣。该皮瓣由肋间穿支动脉供血,设计时沿乳房下皱襞横行向外延伸,并根据胸侧壁皮肤冗余度决定皮瓣范围。该皮瓣供区皮肤色泽与乳房接近,瘢痕隐藏于胸侧壁,且不牺牲背阔肌,术后并发症发生率较低,可修复乳房外侧肿瘤切除术后的缺损[41]。对于外上及外下象限的肿物而言,使用胸侧壁脂肪筋膜瓣修复缺损,可获得较佳的美容效果。该筋膜瓣需术前根据缺损范围及胸侧壁组织厚度,预估切取组织范围,条件允许的情况下可予以多普勒定位胸侧壁血管,从而获得最大切取范围。该组织瓣切取范围位于前锯肌与背阔肌之间,术后不影响上肢活动,且规避了经典背阔肌皮瓣的术后血清肿[16]。鉴于亚洲女性乳房较小,切取组织超过50 g时的容积替换修复,该皮瓣可作为较佳选择[42]。乳内动脉穿支瓣一般利用第四或第五肋间的穿支血管,此血管距离胸骨边界为6~11 mm[45-46],沿乳房下皱襞设计皮瓣上缘以确保皮瓣不包含乳腺组织,皮瓣最长可延伸至腋前线,根据乳房切除缺损量决定皮瓣切取范围,皮瓣旋转90°后可转移至乳房内侧缺损区域修复缺损[43]。鱼钩样切口旋转瓣是术前设计沿下皱襞走行向腋窝延伸的弧形切口,利用下皱襞处腹部组织进行去表皮处理后,转移至乳房内侧肿瘤缺损处。考虑到去表皮及皮瓣转移可能导致的下皱襞位移,术前设计的切口通常位于原始下皱襞下方,并利用鱼钩样切口重塑新下皱襞。术后切口可隐藏于新的下皱襞中,可获得较佳的美容效果[44]。
⑵ 远位皮瓣、组织:取自于距离组织较远的皮瓣,通常选用的皮瓣区域需满足血供稳定、供区范围较大、皮瓣缺血坏死率低、存活率高、术后恢复快、供区并发症少等条件。相比于邻位皮瓣,远位皮瓣通常手术难度较大,手术时间较长。采用远位组织、筋膜(皮)瓣进行较大范围乳房缺损的修复,还是在此类患者中直接进行全乳切除手术联合乳房再造,尚存在不同的意见。1977年Schneider等[47]首先开始利用背阔肌皮瓣行乳房缺损修复。背阔肌皮瓣血供丰富,容易存活,代表了可利用皮瓣的最佳属性:①皮瓣旋转后基本可适用于全乳房缺损;② 瘢痕可以横向设计,隐藏于女性文胸;③皮瓣具有血供稳定,缺血并发症的风险低;④ 供体部位的并发症发生率低;⑤ 在血管蒂允许的情况下,可修复内侧乳房缺损[48]。考虑到背阔肌瓣转移术后肌肉萎缩率为32.4%~68.7%[49],术中设计时需适当多切取部分组织。根据不同体积的乳房缺损,可选择不同的背阔肌皮瓣:①背阔肌肌瓣,患者肿瘤切除术后无皮肤缺损,可选择背阔肌肌瓣。目前推荐采用腋窝切口于腔镜下切取,此术式无供区瘢痕,术后美容效果极佳[50];②背阔肌肌皮瓣[48],若患者存在皮肤缺损,可采取背阔肌肌皮瓣,根据背部皮肤冗余度,可携带适量的背部皮肤进行乳房缺损修复;③胸背动脉穿支皮瓣,胸背动脉穿支皮瓣的设计和应用克服了传统背阔肌皮瓣的不足,最大限度的保留了胸背神经和背阔肌的完整,相比背阔肌皮瓣,术后肩关节功能影响更小,尽可能的减少了供区损伤[51];④ 迷你背阔肌瓣[52],其切口隐蔽,可适用于肿瘤切除术后较小的缺损。Scheflan等[53]于1982 年报道横行腹直肌肌皮瓣(transverse rectus abdominis musculocutaneous,TRAM)应用于临床后逐渐变成自体组织乳房重建的首选术式。腹直肌皮瓣的应用主要分为游离皮瓣和带蒂皮瓣两种。游离皮瓣多选用腹壁下深动静脉做吻合的腹直肌肌皮瓣,而带蒂皮瓣常选用对侧腹壁上动、静脉供血的对侧腹直肌肌皮瓣,可携带部分脐平面以下的下腹部皮瓣。腹直肌皮瓣的优点有:①相比背阔肌皮瓣,可提供更多的组织容量;② 不需要更换体位,腹部胸部手术可同时进行;③腹部组织柔软,可使重塑的乳房具有较好的手感;④ 同时获得腹部整形的效果。相比于带蒂皮瓣,游离皮瓣血供及美学效果较佳,且术后腹部切口疝发生率较低,因此目前带蒂皮瓣逐渐被游离皮瓣替代。但显微操作增加了手术难度,且游离皮瓣住院时间较长,因此外科医师应根据自己擅长和患者个人因素选择合适的术式[54]。Allen等[55]为减少TRAM皮瓣导致的并发症,改良术式为腹壁下动脉穿支(deep inferior epigastric artery perforator,DIEP)皮瓣,该术式手术损伤小且术后效果良好。相比于TRAM皮瓣,该皮瓣避免了对腹直肌前鞘的损伤,使切口疝发生率降低,可用于有生育需求或对腹部功能要求较高的患者。但该手术对于术者显微技术要求较高,且目前对于TRAM皮瓣的改良,包括减少上腹部肌肉的切取、部分肌肉和前鞘的保留技术,使得TRAM皮瓣并发症发生率下降[56-57],因此DIEP皮瓣目前临床用较少。因患者自身原因不能选取腹部皮瓣时,臀上游离皮瓣可作为TARM皮瓣的替补皮瓣,皮瓣大小可根据臀上动脉的供血范围决定[58]。其优点主要包括:①软组织量充足,可切取双侧皮瓣用于修复双侧乳房;② 供区位置隐蔽,可着衣遮盖供区瘢痕。但该皮瓣血管短小,解剖难度大,术后臀部畸形,手术操作繁琐,一般不作为首选术式[59]。大网膜具有较强的吸收功能和覆盖填充作用,因此可以应用于乳腺癌保乳术后局部缺损的修复。日本Zaha等[60]是目前全世界报道病例数最多的学者,认为该技术安全、可行且创伤小。且由于腹腔镜手术的兴起使得大网膜在获取方式上更加微创、美观,进一步降低手术并发症[61]。目前大网膜组织瓣的选择以带蒂为主,选择保留的血管多是胃网膜右血管,但在实际应用中还可以根据解剖的便捷度而定。目前游离大网膜的应用较少,该技术要求将胃网膜右动静脉和胸背或内乳血管的分支进行吻合,对手术者的显微外科技术要求较高。在临床实践中,带蒂/游离大网膜组织瓣各有优劣,可根据实际情况和手术经验选择。
5.2.3.3 乳房缩小术联合乳房提升术的手术方式需去除乳腺表皮并切除大量腺体
有研究表明,在欧洲约有40%乳腺癌患者中乳房体积较大[62],对于较大体积的乳房,若肿瘤位置位于缩乳手术切除范围内,则可采用乳房缩小的术式行“保乳术”。该手术方式不仅可以切除肿瘤,还以缓解巨乳引起的各种不适症状,术后患者生活质量得到提高,但此手术通常需联合对侧对称性手术[63]。
⑴ 垂直切口缩乳术(包括J和L切口):该手术方式设计的切口类似于网球拍法,其环乳晕切口可达到提升乳房的效果,因此适用于乳房下垂的患者。但该术式因切除范围局限,更适用于乳头正下方的肿瘤。J形及L形切口可扩大该术式的手术范围,适用于外下或内下的肿物切除[64]。
⑵ 倒T缩乳术:该术式可选择乳腺上蒂法或乳腺下蒂法,在设计合理的情况下,适用于除乳头下所有位置的肿瘤。该术式需切除较大范围的腺体组织后行乳房塑形,适用于乳房较大且中重度下垂的患者[64]。
⑶ 双环法缩乳术:适合于任何象限的肿瘤;乳房无重度下垂,肿瘤较靠近乳头乳晕但仍有安全距离时,可设计双环法[64]。切除肿物后行腺体重塑,将外圆切口与内圆切口对合缝合。术后需注意乳头乳晕的血供。必要时行对侧对称性乳房手术。
5.2.3.4 乳头乳晕复合体重建
一般认为乳腺癌手术需尽量切除乳头内和乳头后的大导管。当残留乳头皮肤厚度为3 mm时,有87%的导管可被切除;当残留乳头皮肤厚度为2 mm时,有96%的导管可被切除,同时约有50%的乳头血管被保留[65],因此保留乳头乳晕与完全切除乳头内及乳头后的大导管并不冲突。有整形手术要求的患者,宜尽可能保留乳头乳晕。受肿瘤位置及大小的影响,部分保留的乳头乳晕复合体在术后存在不对称可能,可通过皮瓣法微调达到美观的目的。但仍有部分患者因为肿瘤学安全因素,并不适合保留乳头乳晕。因此手术后乳头乳晕相关整形也是乳房整形中关键的一步。
乳头再造主要在乳房整形术后4~6个月进行,此时乳房形态趋于稳定,可寻找合适的乳头再造位置。初期,乳头再造使用游离组织移植法,包括对侧乳头、小阴唇、耳廓、足趾等。目前主要使用的再造方法是皮瓣法,相比于游离组织移植法,皮瓣法无供区损伤,常用的有箭形皮瓣、星形皮瓣、C-V皮瓣、S形皮瓣等。还可借助人工材料支撑皮瓣,使再造乳头达到足够的凸度,常见的皮瓣支撑物包括脱细胞异体真皮、羟基磷灰石、硅胶支架、人工骨或自体软骨和脂肪等。乳晕再造既往通过皮肤移植进行,通常寻找色泽相近的皮肤如对侧乳晕、大腿内侧皮肤、腹股沟皮肤、会阴部皮肤等,由于供区损伤,现较少采用。目前主要使用纹刺法重塑乳晕,Sisti等[66]尝试使用三维纹刺重塑乳晕的同时重塑了乳头的效果。目前常用的乳头乳晕再造方法分别为皮瓣法及纹刺法,但临床应用中需根据乳房的情况综合考虑,为患者制定个性化的手术方案[66]。
6 保乳术后的放疗
6.1 共识要点
⑴ 乳腺癌患者(浸润性癌或DCIS)保乳术后原则上均需要接受术后辅助放疗。
证据级别:高质量;推荐级别:强推荐。
⑵ 全乳常规分割和大分割放疗是术后辅助放疗的两种可选方式。
证据级别:高质量;推荐级别:强推荐。
⑶ 瘤床加量放疗可以降低保乳术后局部复发风险。
证据级别:高质量;推荐级别:强推荐。
⑷ 低危复发患者可以考虑瘤床的部分乳腺放疗(partial breast irradiation,PBI),而满足特定低危复发条件的患者可以考虑豁免放疗。
证据级别:高质量;推荐级别:强推荐。
⑸ 淋巴结阳性患者区域淋巴结照射可以提高患者的无病生存率。
证据级别:高质量;推荐级别:强推荐。
⑹ 保乳术后腋窝前哨淋巴结1~2枚阳性、符合免除腋窝清扫指征的患者,是否补充腋窝淋巴结放疗需根据非前哨淋巴结累及风险决定。
证据级别:中等质量;推荐级别:一般推荐。
6.2 文献数据解读
6.2.1 WBI的必要性
放疗是乳腺癌患者保乳治疗的重要组成部分。2005年针对浸润性乳腺癌的前瞻性研究的Meta分析显示,Ⅰ/Ⅱ期的早期乳腺癌患者,无论局部扩大切除,还是象限切除,单纯手术患者的局部复发率均明显高于WBI组[1]。放疗后5年局部复发率可从26%下降到7%。2011年的Meta分析进一步显示,放疗降低了10年任意首次复发15.7%,最终在15年后乳腺癌特异死亡率下降3.8%,总死亡率下降3%[2]。从统计学数据分析,可知保乳术后放疗在随访5年时每降低4例复发,即可在15年的生存分析中减少1例患者的死亡。
放疗在DCIS的保乳治疗中同样意义重大。四项前瞻性随机对照临床研究共3729例患者,Meta分析显示,放疗降低了50%的术后复发风险,10年绝对降低了15.2%的IBTR发生率[3]。而且,放疗本身并没有降低DCIS患者的乳腺癌特异生存率和总生存率。即使对于低复发风险患者,放疗仍然有获益。RTOG 9804研究[4]对部分乳腺DCIS复发低危患者进行了保乳术后放疗的对比观察,入组患者为钼靶片显示单病灶,术后DCIS病理学分级为低/中级别,肿瘤小于2.5 cm,术后切缘离墨染至少3 mm,放疗组推荐50 Gy/25次的WBI,无瘤床加量。共随机入组636例患者,经过7年的中位随访,放疗组局部复发率仅为0.9%,而观察组为6.7%,差异有统计学意义。
6.2.2 WBI剂量分割方式
WBI的常规剂量分割模式通常为45.0~50.4 cGy/25次,单次1.8~2.0 Gy/次,每周5次,至少需要5周时间完成WBI。由于治疗时间长,近20年以来,随着英国START A/B研究以及加拿大OCOG研究10年结果的发表[5-8],采用3周左右的大分割方案,40.0~42.6 Gy/15~16次已经证明与常规分割放疗局部复发率和总生存率相当,同时在保乳术后美容效果或后期皮肤变化方面相似。因此,全乳常规分割放疗和大分割放疗均是可选方案,同等推荐。大分割方案的优势在于缩短治疗时间,降低治疗费用。最近英国FAST研究组报道的FAST-forward研究[9]结果显示,1周方案,总剂量26 Gy/5次不劣于40 Gy/15次的方案。当然,这一方案需要更长时间的随访和更多研究以证明其长期疗效和不良反应。
区域淋巴结照射是否可以采用大分割方案仍然需要更多前瞻性研究的证据。在英国START研究中,只有约14%的患者照射了区域淋巴结包括腋窝及锁骨上。中国医学科学院肿瘤医院单中心随机对照的临床研究[10]显示,改良根治术后患者采用43.5 Gy/15次的方案与常规分割50 Gy/25次的方案5年的局部区域复发相似。但由于随访时间较短,后期反应如臂丛神经损伤、肩关节活动能力以及僵硬程度等还需要进一步随访。
6.2.3 瘤床加量
浸润性乳腺癌WBI后的序贯瘤床加量可以进一步降低局部复发率[11-12]。常见的加量模式为10~16 Gy/5~8次或10.0~12.5 Gy/4~5次。然而,并非所有患者都能从瘤床加量中获益。一般来说,年龄<50岁,组织学分级3级,或切缘阳性的患者更需要瘤床加量。瘤床加量可以考虑电子线或光子线加量,有条件的单位也可以采用近距离放射治疗技术。
6.2.4 PBI
针对PBI与WBI的八项随机对照研究均发表了5~10年研究结果[13-20],总共超过13000例患者入组。在这些研究中,患者入组条件有所不同,放疗的技术差别很大,分割方案和治疗时间迥异。其中五项研究显示达到了非劣效性结果,PBI组和WBI组IBTR率相似,而三项研究显示PBI组的局部复发率高于WBI组。如ELIOT研究结果为5年局部复发率4.4%vs0.4%(P<0.0001),TARGIT研究结果为5年局部复发率3.3%vs1.3%(P=0.042)。NSABP B39/RTOG 0431研究结果为10年局部复发率4.6%vs3.9%,风险比(hazard ratio,HR)为1.22(90% CI:0.94~1.58),由于该研究没有达到预设的统计学要求,所以认为WBI优于PBI组。但是,如果将这些研究中患者入组条件限定在美国放射肿瘤学会(American Society for Radiation Oncology,ASTRO)定义[21-22]的相对低复发风险的患者(适合PBI组),则5年IBTR发生率为0.5%~1.5%。这些条件包括:年龄≥50岁;阴性切缘≥2 mm;Tis或T1;无BRCA1/2基因突变;淋巴脉管侵犯阴性;ER+;单中心病灶或多灶病灶,但是临床检查是单中心;可以伴有小叶原位癌;淋巴结阴性;非新辅助化疗患者。
其中,对于DCIS患者,基于RTOG 9804研究[4]结果,ASTRO建议满足该研究低危入组条件的患者,也可以进行PBI。
PBI治疗对于保乳术后美容效果及后期皮肤反应的影响目前存在不同的结论。加拿大RAPID研究和NSABP B39/RTOG 0431外照射治疗组都是采用38.5 Gy/10次/5 d,每天2次的治疗模式。RAPID研究[20]显示,PBI组后期不良反应(皮肤纤维化、硬结形成及毛细血管扩张等)和美容效果均不及WBI组,这与NSABP B39/RTOG0431结论不一致。总体来说,后期不良反应和美容效果是一种相对主观的评价。
PBI技术和分割模式多种多样。目前报道的外照射方式有:38.5 Gy/10次/5 d,每天2次;40 Gy/15次/3周,每天1次;组织间插植技术:4 Gy×8次;4.3 Gy×7次,每天2次;术中电子线21 Gy/1次;术中X线:20 Gy/1次(术腔表面剂量)等。
6.2.5 特定低危复发患者的豁免放疗
尽管辅助放疗已经成为保乳术后的标准治疗,但在一些老年且接受内分泌治疗的患者中,由于复发风险低危,豁免放疗成为一种选择。CALGB9343研究[23]患者入组条件:年龄≥70岁,T1N0M0,ER+,切缘阴性,淋巴结阴性。患者随机分为放疗组和观察组,10年无局部复发率和总生存率分别为98%vs90%(P<0.001)和67%vs66%(P=0.64)。PRIME Ⅱ期研究[24]患者入组条件为:年龄≥65岁;T1-T2,最大直径3 cm;ER和(或)孕激素受体(progesterone receptor,PR)阳性;切缘阴性;组织学分级3级及淋巴脉管浸润不能同时出现。患者随机分为放疗组和观察组,5年IBTR和总生存率分别为1.3%vs4.1%(P=0.0002)和93.9%vs93.9%(P=0.34)。这两个研究及其他加拿大的研究结果证实在特定的老年患者人群,免除放疗后局部复发率仍然较低,总生存率也不受影响。因此,在与患者充分沟通之后,可以考虑豁免放疗,只需定期随访及内分泌治疗。当然,这一部分特定条件的低危患者也同样适合进行PBI照射。
6.2.6 区域淋巴结放疗
MA20研究[25]和EORTC 22922研究[26]均表明腋窝淋巴结1~3枚(N1)阳性的乳腺癌保乳术后患者,在乳腺放疗的基础之上增加包括锁骨上内侧组、腋窝第3组及内乳区淋巴结照射,可以进一步降低复发率。两项研究结果均显示,接受区域淋巴结放疗患者可提高3%~5%的10年无病生存率。
6.2.7 前哨淋巴结阳性避免腋窝清扫
根据美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)的前哨淋巴结活检实施指南,术前临床腋窝评估阴性,接受乳腺癌保乳术且腋窝前哨淋巴结1~2枚阳性的患者,如患者后续接受术后辅助放疗,腋下淋巴结可以不做清扫。然而,对于腋窝及锁骨上淋巴结是否接受放疗仍然存在分歧,有3个多中心随机对照研究[27-29]对这个问题进行了探讨。IBCSG 23-01研究入组的患者为T1-2伴淋巴结微转移(1个微转移),随机分为腋窝清扫组和单纯前哨淋巴结活检组,两组10年无病生存率分别为74.9%和76.8%(P=0.24),腋下淋巴结复发率分别为<1%和2%,差异无统计学意义。Z0011研究入组T1-2伴1~2枚转移(微转移或宏转移),随机分为腋窝清扫组和单纯前哨淋巴结活检组,其中50%的患者接受了乳腺高切线野放疗的治疗方式(上界位于肱骨头下2 cm以内),另有15%的患者接受了同侧锁骨上淋巴结引流区的预防性放疗。两组10年无病生存率分别为78.2%和80.2%(P=0.32),腋下淋巴结复发率分别为0.5%和1.5%(P=0.28)。AMAROS研究入组T1-2伴前哨淋巴结1~2枚阳性患者(微转移或宏转移),随机分为腋窝清扫组和腋窝放疗组(范围包括腋窝Ⅰ/Ⅱ/Ⅲ组+锁骨上内侧组),结果显示,两组5和10年无病生存率相似,10年腋下淋巴结复发率分别为0.93%和1.82%(P=0.365)。
保留腋窝可降低手术并发症和患侧上肢水肿率,AMAROS研究[28]的腋窝清扫组和腋窝放疗组5年上肢水肿率分别为23%和11%(P<0.0001)。IBCSG 23-01研究[27]腋窝清扫组和对照组5年上肢水肿率分别为13%和4%(P<0.0001),同时腋窝清扫组感觉神经和运动神经病变也明显增加。Z0011研究[29]也同样显示,腋窝清扫组手术并发症和上肢水肿率高于单纯前哨淋巴结活检组。三项研究均证明前哨淋巴结1~2枚阳性患者可以避免腋窝清扫。
比较上述及现有的前瞻性研究结果,目前有关前哨淋巴结阳性患者后续管理的研究还不能肯定回答什么情况下需要增加区域淋巴结照射以及怎样照射。临床实践中,当我们面对有限个数的前哨淋巴结转移患者时,需要综合分析患者的临床病理学特征,包括原发病灶的大小、前哨淋巴结活检的淋巴结总数、阳性个数及转移灶大小等,从而估计腋窝非前哨淋巴结累及的概率,进而判断多大程度上需要给予区域照射,并确定合适的照射野(图6)。
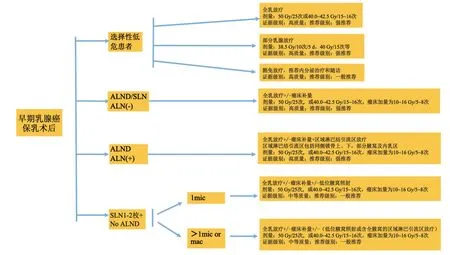
图6 早期乳腺癌保乳术后放疗决策示意图
Standardisation of Breast Radiotherapy (START) trials of radiotherapy hypofractionation for treatment of early breast cancer:10-year follow-up results of two randomised controlled trials[J].Lancet Oncol,2013,14(11):1086-1094.
7 乳腺癌保乳术后局部复发及其处理
7.1 共识要点
⑴ 保乳术后复发病灶应进行空芯针活检,明确其组织病理学诊断,并再次确认分子分型。
证据级别:中等质量;推荐级别:强推荐。
⑵ 保乳手术局部复发方式包括真性复发和第二原发癌两种类型。
证据级别:中等质量;推荐级别:强推荐。
⑶ 在手术、辅助治疗符合规范的前提下,真性复发距首次手术时间越近,患者预后越差。证据级别:中等质量;推荐级别:一般推荐。
⑷ 保乳术后局部复发的治疗目的是获得满意的局部控制率,尽可能减少或延迟再次复发及远处转移的发生,提高生存率。
证据级别:高质量;推荐级别:强推荐。
⑸ 保乳术后局部复发的乳房病灶可采取全乳切除+/-乳房再造。
证据级别:高质量;推荐级别:强推荐。
⑹ 保乳术后IBTR的再次保乳应考虑病灶大小、位置、类型,及后续再次放疗的可行性和耐受性。
证据级别:低质量;推荐级别:一般推荐。
⑺ 保乳术后腋窝淋巴结复发建议行腋窝根治性手术。
证据级别:高质量;推荐级别:强推荐。
⑻ 保乳术后IBTR的系统治疗仍应基于肿瘤分子分型,根据至局部复发时间、复发的肿瘤负荷,同时参考原发灶分子分型、起始的辅助治疗方案等确定治疗策略。
证据级别:中等质量;推荐级别:强推荐。
⑼ 分子分型应该以复发灶类型为主,兼顾原发灶类型设定方案。只要激素受体或HER2出现过阳性,整体辅助治疗中都不应轻易放弃内分泌治疗或靶向治疗的机会。
证据级别:中等质量;推荐级别:强推荐。
7.2 文献数据解读
7.2.1 保乳术后局部复发的危险因素
保乳手术对象包括两类人群,一是未经新辅助治疗并符合保乳手术适应证者,二是通过新辅助治疗降期后满足保乳条件者,影响这两类保乳治疗患者局部复发的危险因素不尽相同。未经新辅助治疗的保乳手术患者局部复发的危险因素包括年龄、分子分型、淋巴结状况、切缘状态以及系统治疗的规范性等。分子分型不是乳腺癌保乳治疗的禁忌证,但非Luminal A型可能会增加保乳术后的局部复发风险,规范的系统性治疗会降低这种风险[1]。2016年的一项回顾性研究分析了1998—2007年接受保乳手术的2233例乳腺癌患者,按年龄、生物学亚型(受体状态和组织学分级)和淋巴结状态进行分层,中位随访106个月,局部复发69例(3%)。在单变量分析中,局部复发与非Luminal A型、年龄、区域性淋巴结受累、阳性切缘、高组织学分级等因素相关;多变量COX回归分析表明,局部复发与非Luminal A型、年龄小于50岁、淋巴结转移数目显著相关;不同的分子亚型局部复发的HR是不同的:Luminal B型为2.64,HER2+型为5.42,三阴性乳腺癌为4.32;淋巴结阴性患者的8年局部复发率为2.8%,淋巴结阳性者为5.2%[2]。2018年的回顾性研究纳入了16个癌症中心接受保乳手术的15570例患者,随访60.3个月局部复发率为3.1%,多变量分析证实肿瘤亚型是局部复发的独立危险因素[3]。2013年荷兰的一项对于年轻乳腺癌保乳手术后患者局部复发的回顾性研究,纳入1988—2010年接受保乳手术治疗的<40岁早期乳腺癌(pT1-2/cT1-2,N0-2,M0)患者1143例;中位随访8.5年,176例患者出现孤立的局部复发,在1988—1998年、1999—2005年和2006—2010年不同亚组的5年局部复发率分别为9.8%(95%CI:7.1~12.5)、5.9%(95% CI:3.2~8.6)和3.3%(95% CI:0.6~6.0),差异有统计学意义(P=0.006);在多变量分析中,全身系统性治疗可显著降低局部复发风险达60%(HR=0.42,P<0.0001);与没有早期局部复发的患者相比,经历早期孤立局部复发(保乳手术后<5年)患者的无远处复发生存较差(HR=1.83,P=0.001);晚期局部复发对远处无复发生存无明显影响(HR=1.24,P=0.407)[4]。2019年日本的一项临床研究中位随访9.3年,显示<40岁者IBTR发生率为15.7%,41~50岁为3.8%,>50岁为2.0%;年龄是保乳手术后IBTR的独立风险因素[5]。结合影响保乳手术各种局部复发的危险因素,可将乳腺癌保乳术后局部复发风险划分为3级:①低度危险(淋巴结阴性,同时具备以下所有特点),年龄≥35岁、病理学检查肿瘤浸润直径≤2 cm、组织学分级或核分级Ⅰ级、无肿瘤周围脉管浸润、HER2-、ER+/PR+;② 中度危险(淋巴结阴性,并具备以下至少一项特点),年龄<35岁、病理学检查肿瘤浸润直径≥2 cm、组织学分级或核分级Ⅱ~Ⅲ级、肿瘤周围脉管浸润、HER2+、N+(1~3个)且HER2-、HER2+且ER+/PR+;③高度危险,N+(1~3个)且HER2+、N+(1~3个)且ER-/PR-,N+≥4个。新辅助治疗后的保乳手术局部复发风险显著高于未经新辅助治疗的保乳手术,影响新辅助治疗后降期保乳治疗的局部复发因素除了上述提到的,还与新辅助治疗后肿瘤退缩的模式相关。2019年有一项研究回顾性分析了2009年11月—2017年6月新辅助治疗后行保乳手术的346例患者,按照肿瘤退缩模式分为病理学完全缓解(pathologic complete response,pCR),单灶性(以单一性肿块形式存在),局限性多灶性(单细胞或簇状细胞集中在一部分纤维化区域)及弥漫性多灶性(细胞分布在整个纤维化区域);结果表明,总体人群的多灶性发生率为25.7%,其中单纯HER2+为12.2%,三阴性乳腺癌为17.5%,ER+/PR+/HER2-为36.9%,三阳性乳腺癌为38.5%(P<0.001);中位随访时间为41.1个月,pCR或单灶性退缩与多灶性退缩的4年无IBTR生存率分别为94.1%和90.9%(P=0.411)。与pCR相比不同退缩模式的局部复发HR:弥漫多灶性退缩为11.2,局限多灶性退缩为1.65,单灶性退缩为1.81;与ER+/PR+/HER2-相比不同分子分型局部复发HR:单纯HER2+为30.67,三阴性乳腺癌为25.30,三阳性乳腺癌为1.60[6]。因此,新辅助化疗后准确地评估肿瘤的退缩模式是降低局部复发率的关键因素,对于多灶或弥漫退缩模式,不建议行保乳手术或需要更宽的阴性切缘来降低局部复发率。现代保乳手术的局部复发风险较低,与可测量的危险因素相关,规范化的治疗对降低局部复发是有益的。
7.2.2 保乳术后局部复发的类型
乳腺癌保乳手术后的局部复发包括乳房内复发、皮肤及胸壁的复发;复发的方式有两种:一种是癌前病变或亚临床病灶的癌细胞未被手术或放疗清除所导致的真性复发;另一种是出现了组织学类型或肿瘤部位不同于第一原发癌的新病灶,即第二原发癌;这两种复发方式对预后的影响是不同的,真性复发会缩短患者的生存时间,真性复发距第1次手术时间越近预后越差。2011年美国MD Anderson癌症中心对1970—2005年5660例接受保乳手术的患者进行回顾性分析,447例(7.9%)发生了局部复发,新病灶的患者发生对侧乳腺癌的频率更高,但10年总生存率和无病生存率高于真性复发患者[7]。真性复发患者在局部复发后更有可能发展成转移性疾病。现在还没有一套完全可靠及标准的方法来区分这两类完全不同的复发模式,目前循证医学证据表明真性复发与第二原发癌的区别主要体现在以下3点:①局部复发位置及病理学特征,真性复发大多位于原保乳手术切口周围,常位于放疗加量照射(Boost)区域或其周围边缘遗漏区,通常和原发灶位于同一象限,并且病理学分型与原发灶大致相同;而第二原发癌多位于不同象限或远离原发灶,病理学分型多不相同,通常伴有原位癌成分。有研究提出距离原发灶瘤床3 cm以内且与原发灶病理学分型相似的为真性复发[8]。② 复发间期(距离第1次手术的时间),真性复发一般距离第1次手术4~5年,时间越久,真性复发的概率越小;而第二原发癌距离第1次手术的时间为7~8年,发生率随着时间推移而缓慢增加,累积发生率呈线性上升。③基因组学指导的精准诊断,近年来随着分子生物学和基因组学技术的快速发展,一些小样本临床研究开始采用DNA拷贝数及PAM-50区分这两种不同的复发类型,或可将这些分子指标与肿瘤位置等传统指标结合以指导后续治疗。
目前乳腺癌的综合治疗往往根据病灶的分子分型实施个体化的分型治疗策略,所以分子分型的确认尤其重要[9]。对于保乳术后复发的病灶首先应该明确是浸润成分还是原位癌成分,尽可能甄别是真性复发抑或第二原发癌。如果复发灶与原发灶分型不一,出现激素受体或HER2基因改变的情况,应该以复发灶类型为主,兼顾原发灶类型来设定治疗方案。只要激素受体或HER2状态出现过1次阳性,整体辅助治疗过程中就不应轻易放弃内分泌治疗或靶向治疗的机会[10]。
7.2.3 保乳术后IBTR的手术治疗
保乳术后局部复发的治疗原则是获得满意的局部控制率,尽可能减少或延迟再次复发及远处转移,提高生存获益。要根据复发方式及复发间期采取不同的治疗方式,除局部手术外,还需结合病理学分型给予全身系统性治疗。IBTR有3种手术处理方式:补救性全乳房切除联合或不联合放疗、二次保乳联合或不联合放疗、乳房整形及重建手术。
⑴ 补救性全乳切除联合或不联合放疗:目前对于保乳手术后乳房复发的处理,还是以补救性全乳切除术为主。除了患者对于二次保乳的恐惧等心理因素,还包括外科医师考虑到首次保乳术对乳房结构的破坏,增加评估难度并影响二次保乳术之后的乳房外形。补救性乳房切除术后患者仍可获得90%的局部控制率以及70%、65%的5年、10年总生存率,与未出现局部复发的保乳患者的预后相当。大多数回顾性研究并没有支持补救性全切术优于二次保乳术。由于保乳手术后常规行WBI,进行乳房全切术后再行放疗与进行乳房切除术的总死亡率没有显着差异,因此再行胸壁放疗的可行性值得探讨。
⑵ 二次保乳术联合或不联合放疗:二次保乳患者的选择应该非常慎重,需要在保证其有良好的局部控制和长期生存的前提下进行。二次保乳后的局部复发率报道在10%~30%,5年及10年的生存率分别约80%和60%。总体来看,大部分研究推荐选择单灶、复发灶小(<2 cm)、无复发间期长(≥4年)且复发灶为激素受体阳性的患者进行二次保乳,同时必须取更宽的切缘,以保证更好的局部控制。尽管部分患者在首次保乳术后已行放疗,但有些研究认为,在可耐受及保证乳房美观的前提下,仍需二次放疗以提高局部控制率;对于初次未行放疗的患者来说,术后的放疗更为必要。总体来说,二次保乳联合术后放疗可以使复发患者获得76%~100%的局部控制率,而相应的无疾病生存率和总生存率也能达到与全乳切除术相同的水平,患者耐受性以及治疗后的美观效果也在可接受的范围。与补救性全乳切除术相比,二次保乳术在总生存率上的差异并没有显著差异。尽管如此,仍有个别研究表明,二次保乳术生存率劣于全乳切除术,这可能与不同研究纳入不同基线状态的研究对象有关。
⑶ 乳房整形及重建手术:对于那些必须行补救性乳房全切术而又有美观要求的复发患者,同样在严格控制手术适应证的前提下,也能通过乳房重建的方法来达到目的。有研究就通过自体皮瓣重建的方法作为乳房复发补救性全切后的外科处理方式。Lindford等[11]研究表明,采用保留皮肤的乳房全切术联合自体皮瓣重建术可达到与补救性乳房切除术相近的10%左右的累计局部区域复发率,扩张器及假体植入也可以作为补救性手术的重建选择之一。但因为保乳术患者大部分都接受过全乳房放疗,重建手术后出现包膜挛缩的概率非常高,宜慎重选择。
⑷ 腋窝淋巴结:2020年版NCCN指南推荐对于第1次手术后腋窝淋巴结复发要尽可能地行腋窝淋巴结手术切除,未做过放疗的必须补充放疗。如果第1次手术为SLNB阴性未行清扫,局部复发灶为浸润性癌,理论上第2次手术时有再次评估腋窝状态的必要性。但保乳术后局部复发患者可能因为初次SLNB或术后放化疗的原因,破坏了淋巴管道,从而导致再次SLNB的假阴性率升高或检出率下降,因此一些研究者对再次SLNB的准确性持谨慎态度。与再次SLNB的成功率相关的因素主要包括初次淋巴结的处理方式、取出的数目、示踪剂的使用等,但是患者是否能够从再次前哨淋巴结活检实现生存上的远期获益,目前并没有高级别循证医学证据。
7.2.4 保乳术后局部复发的系统性治疗
7.2.4.1 可切除浸润性病灶的根治性局部手术后系统治疗
不管是再次保乳还是挽救性全乳切除,复发病灶进行完整R0切除后,给予“二次”辅助治疗可以减少再次复发或远处转移风险[9,12-13]。保乳术后的系统治疗基于复发灶的分子分型,可以借鉴转移性乳腺癌的晚期一线解救治疗方案,根据至局部复发时间、复发的肿瘤负荷所代表的复发风险,并参考起始的辅助治疗方案进行策略制定,治疗过程中化学治疗、抗HER2靶向治疗以及内分泌治疗需要有序选择[14-15]。
7.2.4.2 根据不同分子分型的系统治疗具体原则
保乳术后复发后,根治性局部手术是重要的,其后如何根据分子分型进行系统性治疗,一直缺乏较好的前瞻性研究。CALOR研究[9]是最大也是最新的关于激素受体状态和化学治疗相关性的前瞻性研究,报告指出,激素受体状态是需要接受化学治疗与否的重要预测因素。此项研究入组了162例保乳术后同侧肿瘤复发的患者,其中58例为ER-,104例为ER+。通过9年中位随访,ER-的接受局部治疗后患者接受化疗后明显提高了10年无病生存率,达到70%,而未接受化疗的患者10年无病生存率仅34%,化疗使乳腺癌相关复发风险下降71%,死亡风险下降52%。由此可见,对于激素受体阴性的乳腺癌,接受化疗可以明显改善无病生存率和总生存率。在CALOR研究中激素受体阳性的乳腺癌不管接受化疗与否,生存率相似,表明ER+患者并未从化学治疗中获益,仅需要进行内分泌治疗的调整。
建议对于ER-的患者,尤其三阴性乳腺癌,应在进行有效局部控制下,给予化学治疗,化疗方案可借鉴晚期一线治疗方案,根据既往用药选择无交叉耐药的药物,治疗结束一年以上适合再使用的药物,可谨慎使用。
对于激素受体阳性的HER2-乳腺癌,根据有限的文献中包含的极少入组的乳房复发患者数据,参考绝经状态、复发前所用药物,根据肿瘤负荷以及远处复发风险进行选择和调整。瑞士临床癌症研究组进行的SAKK 23/82研究[13],针对全乳切除术后同侧肿瘤复发接受局部切除联合放疗后的复发灶ER+的患者,一组给予他莫昔芬,一组观察,经过11.6年随访,发现他莫昔芬明显提高复发后的无病生存率,从观察组的2.7年提高到6.5年,获益优势在绝经后患者中尤其明显,说明复发后的内分泌治疗依然十分重要。在目前临床实践中,绝经前使用他莫昔芬±卵巢功能抑制,绝经后患者使用芳香化酶抑制剂已经作为标准治疗选择,一旦出现保乳术后复发,该如何调整“二次”内分泌治疗策略?
参考既往对于晚期乳腺癌内分泌解救治疗的研究[13],建议绝经前患者,可由他莫昔芬等雌激素拮抗剂改为卵巢去势联合芳香化酶抑制剂或氟维司群,绝经后患者由芳香化酶抑制剂-氟维司群依序逐级选择,或直接过渡为氟维司群;部分患者复发风险较高的,谨慎建议给予含CDK4/6抑制剂的药物方案[16-18]。CDK4/6抑制剂在ER+/HER2-的晚期乳腺癌一线治疗中,经过诸多临床试验证实,明显比单纯芳香化酶抑制剂获得更好的无进展生存率,随之已成为目前治疗的标准推荐,但对于保乳术后复发的患者,由于纳入的研究人群极为有限,比如MONALEESA-2研究[16]中,乳腺复发的病例试验组和对照组分别占总体人群的2.4%和3.3%,PALOMA-2研究[17]中局部+区域复发的人群分别仅占1.9%和2.3%,MONARCH 3研究[18]中也仅仅分别为3.4%和3.3%;所以对于这样的少数人群的数据,应用全组人群的研究结果需要谨慎。属于内分泌原发耐药,或ER表达低<10%的患者,可参考ER-给予化学治疗[14]。对于原发灶激素受体阴性,复发灶阳性的,可按绝经前卵巢功能去势+AI或氟维司群,绝经后予以AI或氟维司群建议使用,不建议使用ER调变剂(他莫昔芬或托瑞米芬)。
对于HER2+乳腺癌,根据有限的文献中极少入组的乳房复发患者数据,在有效局部控制下,给予系统治疗,系统治疗方案可借鉴晚期一线治疗方案。因为抗HER2治疗与多种化疗药物具有协同增效作用,因此推荐化疗联合抗HER2治疗。
参考既往晚期解救治疗的研究,对于(新)辅助未经过抗HER2治疗的患者,复发后优选的一线治疗方案为化疗联合曲妥珠单抗和帕妥珠单抗,OS获益已在CLEOPATRA研究中被证实[19]。对于(新)辅助抗HER2经治的患者,如DFI≥12个月,化疗联合曲妥珠单抗和帕妥珠单抗亦是优选[20];如DFI<12个月,可参考使用二线治疗方案。如果原发灶为HER2阴性,复发灶为HER2阳性,应遵循上述抗HER2治疗的原则。
7.2.4.3 新辅助治疗后保乳术后复发的处理
基本同起始保乳术后的复发处理,由于循证医学资料有限,建议根据初始肿瘤负荷、体内药物敏感性信息及新辅助治疗后是否达到pCR状态,积极进行后续系统治疗。
7.2.4.4 不可切除的复发病灶或尝试进行复发病灶的术前系统治疗
鉴于再次保乳需求,并考虑腋窝淋巴结等区域复发或期望获得体内药物敏感性信息的需要,对复发的患者谨慎进行术前系统治疗是可行的;治疗方案必须充分依靠空芯针活检所知的组织病理学分型,在个体化实施过程中,疗效需要密切评估,如2~4个周期效果不佳,应及时中转手术,根据患者意愿,可采用肿瘤整形技术[14]。由于证据极其有限[21],复发后的术前治疗和局部治疗后“二次”辅助化疗,两者间预后是否存在差异并不明确,谨慎推荐。
7.2.4.5 可切除原位癌病灶的系统治疗
如果是原位癌成分,应该在局部治疗后,遵循原发病灶的系统治疗原则进行后续系统性治疗,内分泌治疗可进行适当调整。
7.2.5 乳腺癌保乳术后局部复发的预后
7.2.5.1 保乳术后复发属于潜在可治愈,预后明显高于转移性乳腺癌
保乳术后复发可分为IBTR及其他区域复发。既往针对保乳复发后的多项研究对复发后的远期预后进行了总结。2001年,Doyle等[22]对112例保乳术后同侧肿瘤复发的病例进行了分析,其中包括100例局部复发,12例局部与区域复发,93例为浸润性复发,19例为原位癌复发,经过中位44个月随访,总体人群复发后的10年总生存率达到69%,无远处转移生存率达到47%,而以浸润性癌复发的人群,10年总生存率可达到64%,无远处转移生存率达到44%。即使对于起始腋窝淋巴结阳性的保乳术后IBTR,复发后的5年无病生存率为51.4%,总生存率为59.9%,而其他区域复发后的5年总生存率为24.1%。由此可见,保乳术后复发后,通过根治性局部治疗和系统治疗有机结合,则大部分患者仍然可获得治愈,其远期预后远高于Ⅳ期乳腺癌[13,22-25]。
7.2.5.2 预测远处复发的预后因素
保乳复发后的远期预后因素包括复发位置及范围、自初次诊断到确认复发的无病间隔时间、检测发现复发的方式、复发灶的性质、初始腋窝淋巴结状态以及可否局部控制等[13,22]。对于由钼靶X线检查或钼靶联合专科体检发现的术后复发,其5年总生存率可达到91%~93%,明显高于单一体检发现的73%。2~5年或5年以上出现复发的患者,5年总生存率为84%~89%,明显高于2年内出现复发的患者(65%)[13]。基于以上预后因素的判断及综合评估,可以作为实施系统治疗的一个重要参考。
目前未见Oncotype DX 21基因、MammaPrint 70基因以及成熟的列线图预测模型预测远处复发风险以及治疗有效性预测的相关研究报道。对于HER2+乳腺癌进行PAM-50分析获得复发风险评分,以及三阴性乳腺癌和HER2+乳腺癌中检测肿瘤浸润淋巴细胞等指标来评估风险,目前尚不建议用于保乳术后复发的系统治疗决策。
8 DCIS的保乳治疗
8.1 共识要点
⑴ 穿刺活检已成为DCIS术前诊断的首选方式。
证据级别:低质量;推荐级别:一般推荐。
⑵ 推荐在局限性小病灶穿刺活检后放置金属夹标记,以利于后续手术定位。
证据级别:低质量;推荐级别:一般推荐。
⑶ 推荐DCIS 的手术安全切缘距离为2 mm,暂无证据提示扩大切缘可降低复发风险。
证据级别: 高质量;推荐级别:强推荐。
⑷ DCIS的复发与术后放疗、手术切缘、患者特征和肿瘤特性相关,可以通过Van Nuys预后指数(Van Nuys predictive index,VNPI)和基于21基因的Oncotype DX DCIS评分推荐系统进行预测。
证据级别:中等质量;推荐级别:一般推荐。
⑸ DCIS患者保乳术后放疗需要照射全乳腺50 Gy/25次,在复发风险较高的患者中,建议对瘤床推量照射。
证据级别:高质量;推荐级别:强推荐。
8.2 文献数据解读
DCIS又称导管内癌,指乳腺导管内上皮细胞异常增生,但未超出周围基底膜的病变,是一种最常见的非浸润性导管癌[1]。Gillis等[2]于1960年首次发现,1992年Harris等[3]第1次准确描述了DCIS其特征是细胞异型明显,上皮显著增生,有发展为乳腺浸润性癌的倾向[4]。2003年世界卫生组织将其定义为癌前病变[5],认为其是属于不典型增生与浸润性癌之间的中间状态。据统计约35%的DCIS患者术后10年常发展为乳腺浸润癌[6]。DCIS发生远处转移的可能性较小,但是局部复发率高,具有侵袭性的占局部复发病例的50%,其中8年内15%~20%的病例发展为转移性癌[7],所以应在临床工作中给予足够的重视。
近年来,随着超声、钼靶X线、乳管镜等影像学检查的广泛应用,以及人们对自身健康的日益关注,DCIS的诊断率不断提高,在欧美国家已经占到所有新诊断乳腺癌的20%~40%[8],并显示出发病年轻化的趋势。而在中国,由于乳腺癌普查尚未广泛开展,临床上DCIS的比例较欧美发达国家低,但是随着对肿瘤预防意识的提高,近年来就诊时DCIS的患者比例逐渐上升。DCIS异质性较强,其生物学行为在不同类型的DCIS相差较大,部分可以长期处于静止状态,而部分可以较快地发展为浸润癌,因此手术是DCIS的首选治疗方法。
目前保乳手术广泛用于浸润性癌的局部治疗,数个临床研究发现保乳手术和乳房切除术在浸润性癌中有着相同的生存率,因此,随着人们对生活质量的要求不断提高,越来越多的DCIS患者接受保乳手术。相比于乳房切除术,保乳手术切除范围缩小,但术后肿瘤的局部复发风险亦同时增加。尽管部分复发患者再次行手术治疗仍可获得较好的治疗效果,但复发患者再次手术难度较前增大,且势必影响患者的生活质量。因此,提高DCIS术前诊断的准确性、明确手术中切缘的评估、对复发风险的充分预测以及规范术后放疗等,对于减少DCIS保乳手术后再次复发具有重要的临床意义。
8.2.1 DCIS术前活检方式
新诊断的DCIS患者中,大部分是在钼靶X线普查中被发现,通常表现为簇状微钙化。尽管钼靶X线检查可提高DCIS的检出率,但是对于致密型腺体的病灶检出效能不高,并且可能低估病灶的范围,而乳腺MRI检查的敏感性远高于钼靶X线检查,乳腺MRI检查联合钼靶X线检查可以提高DCIS的检出率及正确诊断率。因此,在DCIS的术前活检中,除了常规的超声引导下粗针穿刺活检,X线立体定位及MRI引导下的活检也有其特殊意义。对于局限性的簇状钙化,行钼靶X线定位下的钙化灶切除活检,同时标记切缘,也是DCIS高效且极具特异性的开放性活检方式。
8.2.1.1 超声引导粗针穿刺活检
超声引导下乳腺空芯针活检乳腺肿物是一种准确的活检技术。目前,空芯针活检针的尺寸通常为18、16及14 G,Schoonjans等[9]报道173个可触及乳腺病灶中,空芯针活检乳腺癌的准确性为99.2%。Crystal等[10]研究表明14 G活检针比16和18 G活检针在乳腺实性肿块活检时具有更高的准确率,分别为94.1%、95.7%及96.3%。同时有研究表明,14 G活检对诊断DCIS也有较大价值[11]。但是既往资料显示,超声引导下穿刺活检可能使原位癌被低估,低估率在29%~66%之间[12]。也有研究显示,穿刺后病理学诊断为DCIS的患者中,16.0%~55.5%在术后升级为乳腺浸润癌。Brennan等[13]的Meta分析表明,穿刺活检中存在低估与多种因素有关,如14 G活检针的使用、存在高级别病变、病变最长径≥20 mm、乳腺影像报告和数据系统分类为4或5类、钼靶X线检查显示肿块及可触及肿块等。因此在穿刺活检后病灶的病理学诊断与影像学诊断不一致时,应重新回顾穿刺过程,考虑是否存在穿刺漏诊情况,并可再次活检或开放手术切除确诊。
1994年,真空辅助乳腺活检(vacuumassisted biopsy,VAB)技术问世。该系统由真空抽吸泵和旋切刀头等构成,刀头与空芯活检针相似,但加上真空泵及传送系统,仅需1次穿刺即可进行连续切割,避免了空芯针的多次穿刺,减少上皮移位的可能。文献报道,VAB的灵敏度和特异度分别可达95.8%和100.0%,漏诊率4.2%,低估率3.1%[14]。VAB在超声引导下能够准确切取乳腺病灶组织,切除标本的直径更大,可获得更多的组织进行各项免疫组织化学的检测,了解激素受体、HER2、淋巴脉管浸润(lymphovascular invasion,LVI)及EIC等,指导保留乳房手术的选择和开展新辅助化疗。但是,组织学低估同样也是VAB诊断DCIS存在的问题。Kettritz等[15]进行的2874例大样本研究,VAB诊断的24%ADH手术后证实为DCIS或浸润性癌。Jackman等[16]认为Mammotome对DCIS可能存在的浸润成分有20.4%的低估。
司婧等[17]单中心研究发现穿刺活检已逐渐成为大多数DCIS患者确诊的首选方式,其灵敏度不亚于术中快速冰冻切片病理学检查。对于临床查体可触及乳房肿块的患者,超声引导下的穿刺活检是首选。
8.2.1.2 X线引导粗针活检
乳腺X线普查的广泛应用使得DCIS的检出率明显增加。典型的DCIS在钼靶上表现为不伴肿块的簇状微小钙化灶,它是DCIS最常见的钼靶表现,微钙化的形成可能是由于DCIS中央发生不规则坏死引起钙盐在导管内沉积,或可能由肿瘤细胞分泌而形成的。细小点样、线状、分枝状钙化常提示恶性病变。有报道约73%的DCIS会出现钙化灶影像[18],因此钼靶X线检查对于DCIS的检出非常重要。X线立体定位活检在DCIS的诊断中具有重要意义,常用于乳腺X线检查下发现的以微小钙化灶为特征的不可触及病灶,或乳腺X线发现超声下显像不明显无法准确定位的其他类型的病灶(如肿块、结构扭曲等)。
8.2.1.3 开放性活检
对于临床触及肿块或钼靶下X线检查显示广泛恶性钙化灶的患者,可通过影像学引导进行病灶穿刺活检或定位下的真空辅助乳腺活检,而对于无阳性体征的患者或钼靶X线片上的簇状微小钙化灶则倾向于选择开放切除活检。在临床实践中,对于以钼靶X线片上的局限性簇状钙化为主要特征的DCIS,如符合保乳指征,可以在开放性活检的同时标记切缘,术中送石蜡切片病理学检查充分评估病灶,完成保乳手术,从而避免再次手术,提高乳腺癌外科治疗的效果。
8.2.2 DCIS手术切缘
8.2.2.1 安全手术切缘
保乳手术已广泛用于DCIS的治疗,最佳的无瘤切缘宽度需要形成共识。鉴于大约每3例行保乳治疗的DCIS患者中就有1例需要再次手术,肿瘤外科学会(Society of Surgical Oncology,SSO)、ASTRO和ASCO通过一项涵盖20项研究的系统评价(纳入7883例患者)和其他已发表的数据,制定了新版DCIS保乳手术+全乳放射切缘共识指南(SSO-ASTROASCO Guideline:BCS Margins in DCIS),并于2016年8月15日在线发表[19]。多学科专家组通过Meta分析达成共识:DCIS保乳术后接受WBI,2 mm的阴性切缘可降低IBTR发生率,改善美容效果,降低医疗成本。与2 mm的边缘相比,更广泛的边缘并不会显著降低IBTR发生率。对于单纯接受切除术而未接受WBI的DCIS患者,无论边距如何,IBTR的发生率要比切除联合WBI组的患者高得多,即便在低风险的患者中辅助放疗也极为重要。导管内原位癌伴微浸润(DCIS-MI),定义为浸润性病灶的大小≤1 mm;当考虑最佳切缘边距时,应参照DCIS切缘的定义(>2 mm)。DCIS-MI是以DCIS为主的,该病灶的全身治疗模式应更接近于DCIS,而非参照浸润性癌的治疗模式。
Tadros等[20]探讨DCIS患者切缘阴性宽度与局部复发的关系,采用前瞻性登记的癌症中心数据库,对1996—2010年接受保乳手术的1191例DCIS患者进行分析,采用单变量和多变量COX比例风险模型,评估加或不加辅助放疗情况下切缘阴性宽度与局部复发的关系,发现切缘阴性宽度<2 mm(n=120,P=0.005)与局部复发相关。切缘宽度与局部复发的相关性因辅助放疗状态的不同而异(相互作用P=0.02)。在接受放疗的<2 mm和≥2 mm阴性边缘患者之间,局部复发差异无统计学意义(10年局部复发率分别为4.8%和3.3%,HR=0.8,95% CI:0.2~3.2,P=0.72)。对于未进行放疗的患者,边缘<2 mm的患者比边缘≥2 mm的患者更易局部复发(10年局部复发率分别为30.9%和5.4%;HR=5.5;95% CI:1.8~16.8,P=0.003)。对于切缘阴性<2 mm行放疗的患者,可以不常规考虑再次手术,但在放弃放疗的患者中应进行再次扩大切除。
8.2.2.2 切缘评估
基于切缘阴性被认为可降低IBTR风险,已提出多种术中评估标本边缘的方法,以提高初始手术时的无边缘累及切除率,从而避免再次手术。这些技术通常包括术中冰冻切片检查(frozen section,FS)、印片细胞学、术中超声、标本X线摄影和其他尚未广泛研究或应用的新技术。
⑴ FS:FS分析是一种广泛应用的边缘评估技术,通常在切除组织的边缘进行多个FS。在这项技术中,切除的标本被冷冻,切片,显微镜下观察。然而,FS分析有很多局限性,包括较为费时,对于小肿瘤,太少的组织可能不能充分评估标本和检出生物标志物,该技术容易出现采样误差[21]。在接受新辅助治疗的患者中使用FS与假阴性率高相关[22]。FS分析检测残留疾病的灵敏度为65%~78%,而特异度为98%~100%,FS也可降低保乳手术的再切除率(17%~34%)[23-24]。
⑵ 标本X线摄影:传统的标本X线摄影被广泛用于确认目标病灶的切除,其在降低边缘阳性方面的作用也已被证实,一些研究表明它对含有微钙化的病变有潜在的好处[25-26]。这种术中评估的方法假设在X线摄影上的微钙化的位置可以准确地替代病理标本边缘的DCIS。然而,DCIS的钙化程度与组织学肿瘤大小存在差异,乳房X线检查经常低估肿瘤大小[27]。此外,并非所有DCIS都有钙化,低级别病变不太可能包含微钙化[28]。没有微钙化的DCIS可能出现在X线标本边缘以外[29]。乳腺X线摄影术在边缘评估方面有很大的局限性,这在很大程度上是由于灵敏度差(22%~68%)[30]。1篇系统文献综述中纳入了235项研究,术中标本X线照相术灵敏度为22%~77%,特异度为51%~100%,阳性预测值为53%~100%,阴性预测值为32%~95%,目前的研究结果提示,对于DCIS或浸润性癌中的DCIS成分行保乳手术的患者,常规使用术中标本X线摄片并不能降低其切缘阳性率[31]。
⑶ 显微计算机断层扫描技术:FS和印片细胞学检查具有不同的灵敏度和特异度,具体取决于病理科医师的经验,两种技术都很耗时,而且FS具有取样错失的风险,因为仅有少量的组织可供分析。印片细胞学检查无法明确边缘宽度。术中超声检查和乳房X线摄影术由于其固有的二维(2D)性质而具有较低的灵敏度和特异度,无法准确地反映三维(3D)样本的状况。为了克服现有技术的局限性,已经开发了几种新颖的工具,包括显微计算机断层扫描技术(micro-CT),用于术中切缘评估,可用于扫描最大直径达14 cm的乳腺组织样本,并获取空间分辨率小于1 μm的高质量图像[32]。它提供了样品的3D图像,可以全方位评估边距状态。Micro-CT的一个优势是出色的钙化检测能力,肿瘤组织的质地和硬度通常不同于正常的乳腺组织,但用肉眼或触诊鉴别钙化阳性切缘的难度很大,因此micro-CT是一种非常有用的技术,有助于术前乳房X线照片上显示钙化的肿瘤的术中边缘评估。micro-CT边缘状态预测的灵敏度为56%~83%,特异度为94%~100%[33-34]。
8.2.3 影响DCIS保乳术后复发的因素
8.2.3.1 术后放疗
由于术后WBI可以降低DCIS患者约50%的同侧复发风险,目前保乳手术联合WBI仍是DCIS患者的Ⅰ级推荐[35]。早在2001年,美国乳腺与肠道外科辅助治疗研究组(NSABP)针对DCIS患者的B-17随机对照临床试验结果便显示,单纯进行肿块切除的患者术后IBTR率为30.8%,而联合术后放疗后可将IBTR降低至14.9%[36],而其更长期的随访结果同样提示了放疗对于患者的获益[37]。欧洲癌症研究和治疗组织(European Organzation for Research and Treatment of Cancer,EORTC)10853试验同样发现了保乳术后序贯放疗降低局部复发率的效果(15年无复发生存率:单纯手术69%vs手术+放疗82%)[38]。早期乳腺癌试验协作组(Early Breast Cancer Trialists’Collaborative Group,EBCTCG)针对多项临床试验的分析也显示,无论是切缘阴性还是阳性的患者,单纯手术切除组患者10年的IBTR率较手术切除+WBI的患者明显升高[39]。而SweDCIS临床试验最新20年的随访结果同样表明了DCIS患者行保乳手术后进行辅助放疗的必要性[40]。
那么是否存在部分DCIS患者在接受保乳术后可豁免放疗?目前NCCN指南2B类证据提示对于临床评估DCIS复发风险低的患者,可考虑仅接受保乳手术治疗[37]。美国南加利福尼亚大学VNPI结合肿瘤大小、肿瘤组织学分级和有无坏死、切缘宽度和年龄因素,用于预测DCIS患者接受保乳手术后的局部复发风险(表1)。Di Saverio等[41]和Gilleard等[42]的回顾性研究采用USC/VNPI评分将患者分为低(4~6分)、中(7~9分)、高度(10~12分)复发风险,发现在低复发风险组,无论是否接受放疗对患者的无病生存率或局部复发率均无明显影响。但美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)研究的长期随访结果显示,按危险度分层仅能筛选出部分复发时间点延迟的患者,而非低复发风险患者[43]。同时RTOG 9804临床试验发现部分中危或低危患者放疗后,局部复发率显著低于未经放疗患者[44]。这些研究结果的不一致性使得USC/VNPI的应用受到一定限制,在临床上迄今尚未达成共识。
8.2.3.2 手术切缘
研究认为切缘阳性会显著增加同侧乳腺肿瘤复发风险,并且这种风险的增加不能被WBI抵消[19]。EBCTCG的研究发现即使接受了WBI,切缘阳性患者的10年IBTR发生率仍高达24.2%,是切缘阴性患者的2倍(10年IBTR率为12.0%),并且近50%患者为浸润性复发[39]。EORTC 10853试验的长期随访也同样证实阳性切缘与术后局部复发密切相关,多因素分析结果显示,切缘阳性或相近的患者较切缘阴性患者局部复发的HR(95% CI)为1.69(1.23~2.31)[38]。而Marinovich等[45]经贝叶斯分析发现,切缘阴性的患者发生局部复发的可能性较阳性患者明显降低(OR=0.53,95% CI:0.45~0.62)。

表1 南加利福尼亚大学Van Nuys预后指数评价标准
关于DCIS安全切缘距离的推荐,NCCN指南指出保乳术后接受WBI的患者,与更窄的阴性切缘相比,至少2 mm的切缘可降低IBTR风险[37]。Marinovich等[45]基于7883例DCIS患者的分析对特殊切缘(2、3或5、10 mm)和阴性切缘(0或1 mm)进行了对比,发现与0或1 mm切缘相比,2 mm及以上组IBTR率都明显降低[45]。
8.2.3.3 患者特征和肿瘤特性
患者年龄较小(≤40岁)一致被认为是DCIS患者保乳术后IBTR的危险因素[19]。最近的一项研究对比了不同年龄组DCIS患者接受保乳手术(包括进行或未行放疗的患者)术后的复发风险,结果发现,50~59、60~69及70~79岁年龄组的患者较<40岁的患者,其复发风险均显著降低,无复发生存期明显延长[19]。此外,肿瘤相关特性如核分级、有无粉刺样坏死以及肿瘤大小等也被认为影响着DCIS患者IBTR的风险[19]。Lagios等[46]最早报道了肿瘤分级与坏死与复发风险相关,其长期随访结果显示,高级别并伴有粉刺样坏死的患者在平均随访间期26个月内有19%复发,高于中级别及低级别患者。而2011年发表的一项Meta分析也显示,肿瘤高级别与伴有粉刺样坏死与患者IBTR风险升高明显相关[47]。Wai等[48]的研究同样证实了核分级高、肿瘤体积较大(>4 cm)及伴有坏死的DCIS患者复发风险增高的情况。
8.2.4 DCIS局部复发风险的预测
8.2.4.1 Van Nuys预后指数(USC/VNPI)
USC/VNPI主要纳入了肿瘤大小、肿瘤核分级和有无坏死、切缘宽度和年龄这几个因素,用于预测DCIS患者接受保乳手术后的局部复发风险。2015年一项基于USC/VNPI评分系统针对DCIS患者进行治疗选择的随访研究,对于低复发风险患者随访12年的结果显示,在单纯手术肿块切除后再行序贯放疗并不能显著降低局部复发率(单纯切除组局部复发率为7.5%,联合放疗组局部复发为率6.3%,P=0.33),不过对于中危患者,放疗能够降低局部复发率,另外对于高复发风险患者,若采取全乳切除术也有助于降低复发风险[49]。不过正如前文所述,目前关于VNPI的研究大多属于回顾性研究,并且现有试验的研究结果存在不一致性,因此VNPI并未被众多学者认可。由于中国部分医院尚不能对肿瘤切缘进行精准判断,因此USC/VNPI的应用仍受到一定限制[50]。
8.2.4.2 基于21基因的Oncotype DX DCIS评分系统
Solin等[51]在2013年提出了基于基因检测水平预测DCIS局部复发风险的概念,建立了基于21基因检测的Oncotype DX DCIS评分系统,通过测定21个基因的表达水平将患者分为低、中、高复发风险组。而进一步针对571例保乳手术切缘阴性的DCIS患者肿瘤进行基于21基因的评分系统,取相应复发风险评分为<39分为低危,39~54分为中危,≥55分为高危,随访结果发现低危、中危和高危患者10年局部复发风险分别为12.7%、33.0%和27.8%。不过该研究同样显示,此评分系统与患者年龄及肿瘤特性(肿瘤大小、核分级和坏死)相关性较差[52]。而2017年针对该模型应用于DCIS患者保乳术后放疗和局部复发风险的评估显示,对于低复发风险的患者仅接受保乳手术时局部复发率约为10.6%,经放疗后可有较小的获益,而对于高复发风险患者联合放疗后较单纯进行保乳手术可有更加显著的获益[53]。该系统对复发风险和放疗效果的预测仍需更多研究加以证实。
8.2.4.3 其他预后预测系统
另外,不同于USC/VNPI,Sagara等[54]研究者基于SEER数据库,尝试去除切缘因素,仅依据年龄、肿瘤体积以及组织学级别3个因素构建了一个预后评分标准,基于该评分系统,研究发现放疗所带来的生存差异与预后评分显著相关,提示该评分系统或许可以试用,但仍需进一步的前瞻性试验加以验证
8.2.5 DCIS保乳术后放疗
8.2.5.1 术后WBI
针对四项临床随机研究(NAABP-17[36]、EORTC-10853[38,55]、SweDCIS[56]、UKCCCR[57-58])中3729例患者所进行的Meta分析显示,DCIS患者保乳术后进行WBI可以降低约50%的同侧复发风险,两组10年IBTR率分别是12.9%和28.1%(P<0.001)。在不同亚组中,无论年龄<50岁或≥50岁、初诊为钼靶X线检出或临床症状发现、肿瘤单灶或多灶、不同肿瘤分级、手术行局部切除或区段切除、切缘阴性或阳性、使用三苯氧胺与否,保乳术后放疗均能显著降低IBTR率(30.1%和12.1%,P=0.002)。
RTOG 9804研究[59],符合低风险DCIS定义(包括入组单发、钼靶X片发现的DCIS患者,筛查发现的DCIS,低至中等核分级,肿瘤大小<2.5 cm、手术切缘阴性且距瘤床≥3 mm)的636例患者,随机纳入单纯保乳组和保乳+术后放疗组,中位随访7年,放疗可显著降低7年局部复发率(0.9%和6.7%,P<0.001)。
DCIS的致死率很低,NSABP B-17和B-24研究[60]显示,15年乳腺癌死亡率2.3%~4.7%。同侧乳腺浸润癌的发生在手术15年后持续增加,浸润癌复发可增加患者的乳腺癌死亡风险(HR=7.06)和总死亡风险(HR=1.75)。放疗可显著降低同侧乳腺浸润癌复发风险,单纯保乳组和术后放疗组的15年同侧浸润癌复发率分别为19.4%和8.9%。该研究发现年龄<65岁、切缘阳性/不详(vs切缘阴性)、临床检出(vs仅钼靶X线检出)是浸润性癌复发的高危因素,但DCIS复发不影响患者生存。
近年来,技术进步使精准医学时代成为可能,Shee等[61]研究可以通过DNA和RNA测序等工具进行分子水平分析,以识别用于风险分层的分子生物标志物,能够成功预测DCIS复发的风险。Solin等[51]报道E5194研究中的DCIS保乳术后未放疗患者,21基因评分可以区分复发低、中和高危患者,10年局部复发率分别为10.6%、26.7%和25.9%,10年局部浸润癌复发率为3.7%、12.3%和19.2%(P≤0.006)。
8.2.5.2 术后放疗时机及放疗计划
Shurell等[62]探讨了DCIS保乳手术患者IBTR与放疗时机的关系,共1323例患者符合入选标准,中位随访6.6年,最终共126例发生了IBTR事件。根据放疗开始时间可分为:≤8周组(806例,占61%)、8~12周组(386例,占29%)和>12周组(131例,占10%)。3组的5年IBTR发生率分别为5.8%、3.8%和8.8%,10年IBTR发生率分别为13.0%、7.6%和23.0%(P=0.004)。多因素分析结果显示,绝经(HR=0.54,P=0.0009)和内分泌治疗(HR=0.45,P=0.002)对IBTR有保护作用,而与保乳术后≤8周相比,放疗延迟超过12周与IBTR的高风险相关(HR=1.92,P=0.014),同时≤8周组和8~12周组的IBTR差异无统计学意义(P=0.3)。由此可见,在接受保乳手术治疗的DCIS患者中,放疗延迟超过12周与IBTR的风险增高显著相关。在临床实践中,应避免保乳术后放疗的延迟,以减少疾病复发的风险。
DCIS患者保乳术后放疗需要照射全乳腺50 Gy/25次,无需预防照射区域淋巴结。全乳照射靶区界定为整个乳房组织。放疗剂量:全乳应接受45.0~50.4 Gy/25~28次或40.0~42.5 Gy/15~16次。所有剂量安排都是每周照射5 d。De Rose等[63]纳入137例DCIS患者进行全乳总剂量为40.5 Gy/15次的大分割放疗,未加瘤床推量,经过22个月(6~45个月)的中位随访,对临床疗效和放疗导致的不良反应进行早期评估,发现40.5 Gy/15次大分割放疗是DCIS的可行选择。
在复发风险较高的患者中,建议对瘤床进行推量照射,追加剂量通常是10~16 Gy/4~8次。Moran等[64]纳入了1980年1月1日—2010年12月31日来自美国、加拿大和法国的10家中心的4131例DCIS患者,均接受了保乳手术、WBI伴或不伴瘤床推量照射(RT-boost),中位随访时间为9年。WBI分为接受中位剂量14 Gy的推量照射(n=2661)和不接受推量照射(n=1470)两组。这项分析表明,RT-boost显著降低了所有DCIS的IBTR风险(HR=0.73,95%CI:0.57~0.91,P=0.01),无IBTR率分别为5年97.1%vs96.3%,10年94.1%vs92.5%,15年91.6%vs88.0%。因此,建议DCIS患者在全乳照射基础上常规接受瘤床推量照射,以降低IBTR风险。
研究发现,复发风险较低的患者仍能从推量照射中显著获益。在一项回顾性研究[64]中,纳入了同侧复发风险较低(包括组织学分级低分级、ER+、辅助他莫昔芬治疗、切缘阴性等因素)的DCIS患者,发现患者能够从推量照射中显著获益(HR=0.69,95% CI:0.53~0.91,P<0.01)。同时,在切缘阴性(按照NSABP定义的“肿瘤无墨染”或SSO/ASTRO/ASCO定义的切缘<2 mm)的复发风险非常低的患者中,推量照射仍能显著降低局部复发率。年龄相关的分层分析显示,各年龄层患者均能从推量照射中获益,其中年轻患者的绝对获益最为显著。
8.2.5.3 加速部分乳腺照射(accelerated partial breast irradiation,APBI)的研究
关于APBI的临床效果,GEC-ESTRO研究[65]的5年随访结果显示保乳术后WBI和APBI两组疗效无差别,但该研究中DCIS患者仅占5%,其结论仍有待商榷。
对于一些选择性的早期低危乳腺癌患者来说,APBI的局部控制率与标准的WBI相当。然而,与标准的WBI相比,近期的几项研究表明使用APBI所造成的外观影响不佳,但研究尚在进行中,随访数据有限。NCCN专家组采纳ASTRO 2016年更新版APBI指南的建议,定义“适合”APBI的DCIS患者应符合:低/中度核分级,筛查发现的DCIS病灶大小≤2.5 cm,且阴性切缘边距≥3 mm。
APBI 剂量可采用瘤床近距离放疗剂量34 Gy,10次分割,每天2次给予;或光子外照射剂量38.5 Gy,10次分割,每天2次给予。
目前其他分割方案尚在研究中。
9 新辅助治疗后的保乳手术
9.1 共识要点
⑴ 新辅助治疗的目的之一是降期保乳,新辅助治疗后的患者有更高的保乳率,但可能面临更高的局部复发率,而远处复发率和死亡率无差异。
证据级别:高等质量;推荐级别:强推荐。
⑵ 对于治疗目的为降期保乳的新辅助治疗患者,推荐在治疗前进行原发灶范围的标记,可采用超声引导下放置金属标记物或表皮纹身。
证据级别:中等质量;推荐级别:强推荐。
⑶ 在保证切缘充足且阴性的情况下,新辅助治疗后保乳的切除范围可根据治疗后病灶的大小来确定。
证据级别:中等质量;推荐级别:强推荐。
⑷ 对于新辅助治疗后保乳标本切缘的界定,可参考浸润性癌切缘评估方法及标准。
证据级别:中等质量;推荐级别:强推荐。
9.2 文献数据解读
9.2.1 新辅助治疗后保乳手术的安全性
NCCN指南[1]、《中国抗癌协会乳腺癌诊治指南与规范(2019年版)》[2]等都明确新辅助化疗的目的之一是降期获得保乳机会。新辅助治疗具有以下的优势:①通过对肿瘤降期,使不可手术的乳腺癌转变为可手术的乳腺癌;② 提高可手术乳腺癌的保乳成功率;③化疗后是否达到pCR是患者重要的预后预测指标;④ 提供良好的体内药敏试验模型。NSABP B-18及B-27两项新辅助治疗研究随访结果表明,新辅助化疗组无病生存率和总生存率与术后化疗组一样,并且达到pCR的患者无病生存期明显长于其他患者,新辅助化疗和辅助化疗的患者在无病生存期和总生存期方面差异无统计学意义,因此新辅助治疗在乳腺癌治疗中是安全可行的,可以显著提高患者的保乳手术率[3-6]。EBCTCG的Meta分析纳入了1983—2002年的10项研究,共4756例乳腺癌患者,新辅助化疗后的患者保乳率显著提高(65%vs49%),但15年局部复发率也较未行新辅助治疗组增高(21.4%vs15.9%,P=0.0001),而远处复发率和死亡率并无差异[7]。该研究结果有一定争议,纳入的早期研究患者多数未接受靶向治疗,缺乏具体完整的放疗、淋巴结状态、腋窝手术数据,相关影像学评估也欠完善。2012年Derks等[8]对新辅助化疗后局部复发的相关因素进行了分析,结果显示,新辅助化疗后保乳的患者局部复发与年龄、腋窝淋巴结有无转移及是否获得pCR相关。CALGB40603研究首次前瞻性设计了新辅助治疗与保乳手术相关的外科研究子项目。新辅助治疗可使42%不适合保乳手术的患者转化为适合保乳手术,在显著提升pCR比例的同时可进一步提高保乳手术转化比例;新辅助治疗后保乳手术的成功率达93%,且初始即适合保乳手术的患者和新辅助治疗降期转化为适合保乳手术的患者,其保乳手术成功率并无差异[4]。最新的一项回顾性研究通过纽约纪念斯隆-凯特林癌症中心前瞻数据库(新辅助化疗前后预先确定是否适合保乳手术),对2013年11月—2019年3月连续1353例进行新辅助化疗的Ⅰ~Ⅲ期乳腺癌患者进行回顾分析,结论是对于肿瘤体积较大不适合保乳手术的患者,尤其是HER2+或三阴性乳腺癌患者,新辅助化疗的保乳转化成功率较高[9]。对于行新辅助治疗后肿瘤降期而计划保乳的患者,应注意降低术后局部复发率,如采用更仔细的肿瘤定位、更详细的病理学评估和适当的术后放疗等[10-11]。国内外指南均指出,新辅助治疗降期后保乳手术的指征与未经新辅助治疗的早期乳腺癌保乳手术指征一致[1-2]。
9.2.2 新辅助治疗后保乳手术的影响因素
以降期保乳为目的的新辅助治疗,即使未达到pCR的乳腺癌患者,在进行新辅助治疗后保乳比例也显著提高。影响新辅助治疗后肿瘤降期保乳的因素包括临床肿瘤大小、淋巴结状况、有无钙化、分子分型、组织学类型、病理学缓解情况等。HER2+或三阴性乳腺癌患者的降期成功率较高,而肿瘤较大、临床淋巴结阳性、有钙化患者的降期成功率较低,考虑以降期保乳为目的行新辅助化疗时应该考虑这些因素[9]。
对于临床Ⅱ~Ⅲ期三阴性乳腺癌和HER2+乳腺癌患者,选择新辅助治疗的原因主要是其高危的生物学特性和良好的治疗效果,对于HR+/HER2-乳腺癌患者来说,在新辅助治疗还是直接手术之间作出选择会更加复杂。Devane等[12]发现新辅助治疗后保乳手术的二次切除率高于初诊保乳患者,且浸润性小叶癌或ER+患者二次手术率较HER2+及三阴性乳腺癌患者高。2017年St.Gallen共识[13]认为pT1aN0的三阴性乳腺癌患者可不进行辅助化疗。对于预后较好的小肿瘤患者无需新辅助治疗。国内外指南、共识在新辅助治疗适应证的推荐中,均认为需要综合考虑分子分型、临床分期等因素。三阴性乳腺癌及HER2+乳腺癌选择新辅助治疗时,需满足一定的肿瘤负荷,比如《中国乳腺癌新辅助治疗专家共识(2019年版)》[14]为>3 cm,CSCO-BC指南[15]为>2 cm,NCCN指南[1]为≥2 cm。
恶性钙化是DCIS的特征性钼靶表现,是由于DCIS中央发生不规则坏死引起钙盐沉积,或由肿瘤细胞分泌而形成。有研究显示,新辅助化疗前钼靶X线检查示恶性钙化的患者通常伴随DCIS,预示新辅助治疗后肿瘤退缩不足,难以达到降期保乳的标准[16-18]。
国内外指南、共识对于基因突变是否为保乳手术相对禁忌的表述不尽一致。双侧、年轻乳腺癌的BRCA突变率问题只是个例,在考虑一侧乳腺癌患者保乳决策时,尤其是新辅助治疗过程中,患者有充足的时间去进行基因检测和遗传咨询。外科决策前建议临床医师对这部分患者进行充分沟通和告知。
9.2.3 新辅助化疗后保乳手术的实施
新辅助治疗后行保乳手术应关注和做好以下3个关键点的评估,即新辅助治疗前肿瘤范围、新辅助治疗效果(残留肿瘤范围及肿瘤退缩模式)和术中切缘评价。
对于计划在新辅助治疗后实施保乳手术的患者,建议在新辅助治疗前进行完整的影像学评估,包括乳腺超声、钼靶、乳腺MRI以评估乳腺和腋窝病灶的大小和范围,并每2个周期进行1次乳腺超声和MRI检查,判定病灶的缓解情况。
推荐对所有接受新辅助治疗的患者在治疗前于乳腺原发灶中心放置金属标记物,相关临床试验提示金属标记物有助于保乳术前评估并使5年局部控制率提高6.9%[19]。同时体表进行纹身标注肿块范围。
新辅助治疗导致的原发肿瘤退缩模式多种多样,从形态学上可分为孤立状、团块状伴散在状、结节状或弥散状模式,也可分为向心性退缩和非向心性退缩模式,尤其是非向心性退缩提示可能仍有肿瘤病灶残留于退缩的组织中,将给手术中判断切除范围带来困难[16]。不同分子亚型的乳腺癌接受新辅助化疗后的退缩方式有所不同,HER2+和三阴性乳腺癌多为向心性退缩且pCR率较高。Colleoni等[20]回顾性分析485例局部晚期乳腺癌患者,结果显示,ER+和PR+细胞<10%的患者获得的pCR率(13.1%)为ER+和PR+细胞≥10%的患者(1.5%)的8倍(P<0.001),提示新辅助化疗前激素受体阴性的患者,新辅助化疗后原发肿瘤退缩明显,倾向于呈向心性退缩,与杨涛等[16]的研究结果一致。
相关的研究表明,新辅助治疗后的残余肿瘤呈多中心且不连续时,可增加保乳手术后的IBTR率[21]。因此,了解新辅助治疗后肿瘤的临床病理学退缩模式,准确界定新辅助治疗后的肿瘤边界,既可以保证无癌细胞残留,又可以缩小切除范围,降低局部复发率。新辅助治疗前后对原发灶的临床和影像学评估至关重要,体格检查、钼靶X线检查及超声检查是标准的检查手段,MRI是优选的检查方法,但是其预测病理残余肿瘤范围的准确性差异仍较大[22-23]。
杨涛等[16,24]进行MRI和病理学三维重建新辅助治疗后残余肿瘤形态研究,基于三维测量技术分析MRI评价乳腺癌新辅助化疗后的残余肿瘤范围,结果显示,病理学分析与MRI对残余肿瘤的最大径、最大截面积和体积测量结果呈正相关(r分别为0.942、0.941和0.903,P均<0.01),提示新辅助化疗后MRI三维重建图像能准确地评价残余肿瘤的立体空间范围,有助于更好地选择新辅助化疗后降期保乳的患者。
外科医师关注的重点是明确保乳手术切除的范围以及安全切缘的界定。无论新辅助治疗前患者是否临床可保乳,在具备完善的影像学评估的基础上,只要新辅助治疗后临床可保乳,在可以保证安全切缘的情况下,保乳手术切除的范围可以根据治疗后病灶的大小来确定。临床可扪及病灶的患者,术中依据手指触感,推荐切除肿瘤以外≥1 cm的乳腺组织。临床不可扪及病灶的患者,应根据术前皮肤标记及标记夹等肿瘤定位信息确定切除范围,进行切除。文献报道,术中超声检查可以提高保留乳房手术切除的准确性[25]。Smith等[26]发现乳腺肿瘤切除术中实时成像系统能通过检测残余肿瘤显著降低二次手术率,但其推广意义仍需验证。Gentilini等[27]对195例新辅助治疗后保乳治疗的患者进行了中位41个月的随访,发现切缘阳性患者的局部复发率是切缘阴性患者的2.8倍(13.3%vs4.7%,P=0.05)。2017年St.Gallen共识[13]指出对于行新辅助化疗肿瘤降期后手术的患者,如果肿瘤呈向心性回缩或为单一残留病灶,只要切缘无肿瘤即可,而对于多病灶残留或散在性退缩的,要求肿瘤阴性切缘距离为2 mm。对于新辅助化疗后保留乳房手术的安全切缘问题,目前的数据提示切缘距离与局部区域复发、无病生存率无明显相关性[28]。
2019年St.Gallen专家共识[29]认为在大多数浸润性乳腺癌中,无论单个还是多个残存病灶,可接受的安全切缘为“no ink on tumor”(染色区无肿瘤)。切缘评估方法推荐采用墨汁染色法并对垂直切缘放射状取材[28]。另外,中国国情是多数医院采取术中冰冻切缘,切缘取材方式也有不同(如瘤周或残腔切缘),所以临床实践中可能需要扩大切缘范围。《中国乳腺癌新辅助治疗专家共识(2019年版)》[14]对于新辅助治疗后保乳标本切缘的界定,推荐将切缘无肿瘤区域2 mm以上定义为病理学切缘阴性,这部分患者相较于无肿瘤区域2 mm以下的患者5年局灶复发率更低,切缘评估方法推荐采用墨汁染色法并对垂直切缘放射状取材。
9.2.4 新辅助治疗后手术时间选择
目前,新辅助治疗完成至乳腺手术之间的时间间隔尚无明确界定。大型随机临床试验和来自单个机构的评估新辅助化疗在乳腺癌中作用的研究报告并没有说明从治疗到手术的间隔时间与患者预后之间的关系。有文献指出,接受新辅助治疗的患者手术延迟时间过长可能会影响患者的预后,尤其是那些具有高风险肿瘤生物学特征的患者和那些没有达到pCR的患者[30]。Omarini等[31]进行了一项关于乳腺癌新辅助治疗结束至手术的时间对预后影响的研究,研究并未发现新辅助治疗结束到进行手术的时间与临床分期、核分级、化疗方案、手术方式有关,多因素分析证实,手术时间是总生存率(P=0.03)和无复发生存率(P=0.01)的独立预后因素,即使在达到pCR的患者亚群,手术时间仍是总生存率(P=0.05)和无复发生存率(P=0.03)的独立预后因素,该研究认为,新辅助治疗后至手术时间会影响患者的生存预后,新辅助治疗结束后的21 d内接受手术的患者从之前的治疗中获益最大。
9.2.5 pCR与非手术时代
鉴于一些亚组新辅助治疗后乳房pCR率高,尤其是保乳术后还要接受辅助WBI,这部分患者是否可以免除乳房手术呢?2019年SABCS报道的德国RESPONDER研究、荷兰MICRA研究、美国NRG BR 005研究以及英国皇家马斯登基金会和美国MD Anderson癌症中心的数据汇总分析研究,虽然有较高的假阴性率,但是从中可以看到,利用影像学方法引导的微创活检(minimally invasive biopsy,MIB)技术有准确预测新辅助化疗后乳房pCR的潜力,使乳腺癌非手术治疗成为可期待的选择[32]。
10 妊娠期乳腺癌的保乳治疗
10.1 共识要点
⑴ 妊娠期各阶段均可实施保乳手术,但保乳后放疗需推迟到分娩后进行。
证据级别:低质量;推荐级别:一般推荐。
⑵ 妊娠期乳腺癌行保乳手术前的评估首选乳房超声检查,审慎选择乳房X线检查,一般不推荐增强MRI。
证据级别:低质量;推荐级别:一般推荐。
⑶ 处于妊娠中晚期的乳腺癌患者保乳手术后可行辅助化疗,但抗HER2靶向治疗和内分泌治疗为禁忌。
证据级别:低质量;推荐级别:一般推荐。
10.2 文献数据解读:
随着女性平均生育年龄的推迟,妊娠相关乳腺癌(pregnancy associated breast cancer,PABC)的发病率也在逐渐升高[1]。妊娠期乳腺癌(或PABC)通常定义为:在妊娠期间、产后1年内或哺乳期被诊断的乳腺癌[2]。由于需要兼顾孕妇和胎儿的健康,所以妊娠期乳腺癌临床决策的制定比较复杂。目前关于妊娠期乳腺癌的临床研究资料十分有限,并且大多为回顾性临床病例分析,关于妊娠期乳腺癌的前瞻性研究目前仍比较少。妊娠期乳腺癌的临床诊治在遵循非妊娠患者诊治指南的同时,应当作出相应调整,从而将对胎儿的不良影响降到最低,原则上仍以治愈为主要目标,因此妊娠期乳腺癌的诊治不能因为妊娠而被不必要的推迟。
在针对妊娠期乳腺癌实施保乳治疗之前,临床医师应该首先告知患者目前尚无证据表明终止妊娠可改善妊娠期乳腺癌的预后[3]。同时必须重视以下一些问题:准确评估妊娠期乳腺癌组织的组织学亚型及分子分型;乳腺外科医师、肿瘤内科医师、肿瘤放疗科医师、病理科医师、影像科医师及产科医师需要进行多学科合作;通过系统的术前检查评估保乳手术能否获得阴性切缘;妊娠期乳腺癌行保乳治疗前的评估需要谨慎进行。
10.2.1 妊娠期乳腺癌的影像学检查的选择
在乳房的专科检查中,X线检查并非妊娠期的绝对禁忌,双视图乳腺X线摄影经腹部屏蔽后给胎儿带来的辐射剂量几乎可以忽略不计[4]。但中国青年女性的乳腺多为致密型乳腺,故不推荐妊娠期乳腺癌患者术前行乳腺X线检查评估[5]。乳腺超声检查对妊娠期乳腺癌患者的胎儿无辐射暴露风险。目前尚无妊娠期使用非增强MRI带来不良事件的报道,但美国国家辐射防护委员会建议尽量不要在早期妊娠中使用MRI,因为其对胎儿器官发生期的影响仍不明确[6]。但如果需要在早期妊娠之后进一步通过影像学来确定能否行保乳治疗,那也可以考虑MRI[7]。
胸部评估应当在腹部适当的屏蔽下,通过胸部X线评估是否存在肺转移。CT和PET/CT通常禁止用于妊娠期乳腺癌,如果需要进一步评估胸部,优选胸部MRI[8]。此外,妊娠期要避免使用造影剂。肝的评估通常推荐腹部超声检查。当获益超过理论风险时,颅脑的评估可以使用MRI。妊娠期应用放射性核素骨扫描进行骨的评估是相对安全的[9],但若无骨异常症状和体征,不推荐用骨扫描评估骨病。心功能评估推荐超声心动图。
10.2.2 妊娠期乳腺癌保乳手术
与非妊娠期女性患者一样,手术是妊娠期女性患者的根治性局部治疗方法。现有研究表明,在妊娠的任何阶段都可以行乳房和淋巴结手术,并且影响胎儿的风险似乎都很小[10-11]。如果选择进行乳房重建,则推荐分娩后进行重建可能更好,取决于所选择的重建术式。
有研究表明,对于Ⅰ和Ⅱ期的妊娠期乳腺癌患者来说,乳房切除手术和保乳手术的生存率差异无统计学意义[12]。保乳手术对妊娠期乳腺癌的局部复发和并发症发生率的影响很小[13-14]。妊娠期乳腺癌保乳治疗的选择标准与非妊娠期选择标准一致,外观、切缘和腋窝评估的原则也可以参考非妊娠期乳腺癌的保乳治疗原则。因为妊娠期乳房会产生外形改变,故需要注意的是保乳手术后可能会有一定程度上的外观改变。妊娠期乳腺癌行SLNB目前仍存在一定争议,但越来越多的临床研究表明,SLNB对妊娠期乳腺癌患者是安全有效的[15]。
10.2.3 妊娠期乳腺癌保乳术后的辅助治疗
研究表明,放疗会对胎儿产生多种影响,包括自然流产、死胎、发育障碍、畸形及致癌作用[16-17]。通常乳腺癌的放疗剂量为46~60 Gy,有研究表明,如果放射剂量为50 Gy,早期妊娠胎儿接受的辐射剂量为0.04~0.15 Gy,而晚期的妊娠胎儿则可高达2 Gy[18-19]。目前尚无证据明确可以引起胎儿异常的辐射阈值,孕周不足14周的胎儿,可能的致畸阈值为0.10~0.50 Gy(10~50 rad),大于14周的胎儿的阈值最低值约为0.50 Gy(50 rad)[20]。所以妊娠期接受保乳手术的乳腺癌患者,鉴于放疗对胎儿的不良影响,妊娠期间应避免任何治疗性的放疗,建议推迟到分娩之后进行。
妊娠期乳腺癌患者使用化疗药物的时机非常重要[21]。有研究表明,化疗药物用于妊娠早期乳腺癌患者时,预估胎儿致畸的风险为15%~20%[22]。乳腺癌化疗相关药物在妊娠中晚期使用是相对安全的,并发症发生率较低[23-25]。以蒽环类药物为基础的每3周1次的化疗方案与剂量密集型方案(每2周1次)相比,母亲与胎儿的并发症发生风险差异并无统计学意义[26]。妊娠期乳腺癌患者基于体表面积的化疗药物剂量计算方法与非妊娠患者相同,但要随着孕妇体质量的增加进行相应的调整[27]。妊娠中晚期使用紫杉类药物对母亲和胎儿的不良反应均很小[28]。非妊娠期乳腺癌患者化疗推迟3~6个月会显著影响预后,故妊娠期乳腺癌患者面临是选择立即开始化疗,还是等到分娩后再开始化疗的艰难抉择。此时需要临床医师进行多学科的个体化讨论,兼顾孕周和乳腺癌的生物学特性。对于需要化疗的保乳术后患者若平稳过渡至妊娠中晚期,临床医师应建议其不要推迟系统化疗的开始时间。但无论在妊娠的早期还是晚期,美国FDA均不推荐使用抗HER2靶向治疗药物(如曲妥珠单抗),因为会引起胎儿发育不良[29]。妊娠期乳腺癌通常不推荐内分泌治疗,选择ER调节剂会增加死胎率[30],而芳香化酶抑制剂一般不用于绝经前女性。
11 保乳手术后的随访
11.1 共识要点
⑴ 应重视保乳治疗后的随访,推荐专科体检、乳腺超声、乳房X线摄片±MRI检查。
证据级别:中等质量;推荐级别:强推荐。
⑵ 不同分子分型乳腺癌患者保乳术后复发风险存在差异。
证据级别:中等质量;推荐级别:强推荐。
⑶ 保乳术后主要复发模式是IBTR,术后3~5年达到高峰。
证据级别:中等质量;推荐级别:强推荐。
⑷ 认知行为治疗、心理教育可以缓解保乳术后患者的心理压力,舒缓情绪,提高患者的生活质量。
证据级别:低等质量;推荐级别:一般推荐。
⑸ 推荐使用BREAST-Q的保乳模块和期望模块对患者进行外形满意度测评。
证据级别:中等质量;推荐级别:一般推荐。
11.2 文献数据解读
在过去的10年中,乳腺癌的主要治疗方法已明显改变,并且可能改变了局部区域复发的发病率、临床表现和治疗。保乳术后复发的时间及模式与全乳切除术后存在差异,保乳手术后可能会出现局部、区域复发及远处转移,其中主要风险在于术后的局部复发,局部复发是指在同侧被保留的乳房内再次出现病灶。而区域复发是指肿瘤累及同侧区域淋巴结,通常见于同侧腋窝或锁骨上淋巴结,少数位于锁骨下和(或)内乳淋巴结。因此,局部区域复发是指同侧乳房或局部引流淋巴结的复发,主要复发形式是IBTR。
保乳手术后患者的康复包括生理功能的康复以及心理社会状态的调整,目的是希望在患者手术结束后帮助患者尽快恢复机体生理功能、调整心理状态,按时完成既定的治疗方案,回归正常的家庭和社会活动,重建被疾病破坏了的生活。心理治疗干预,例如认知行为治疗、心理教育可以舒缓保乳术后患者的身心状态,舒缓保乳术后对局部区域复发风险的担忧情绪,提高患者的生活质量。
评估乳腺癌患者保乳术后满意度,不仅可以间接反映患者的生活质量,还可以指导临床医师对手术的选择和实施。因此,乳腺癌患者保乳术后满意度的不同评估方法,对手术的实施和乳腺癌患者保乳术后满意度及生活质量的提高都是很有帮助的。
11.2.1 保乳术后IBTR的时间
保乳治疗的主要风险在于术后的局部复发,每年为0.6%~1.5%,并且与剩余乳腺中残留肿瘤的存在直接相关,因为孤立的局部复发,即无全身转移,主要在保乳手术后的2~3年被发现[1-2]。保乳术后到第1次复发的间隔是重要的预后指标,研究数据表明,保乳术后4年内发生IBTR的患者中,有50%发生远处转移,而在术后4年以上发生IBTR的患者中只有17%发生远处转移[3]。Kurtz等[4]的研究表明,尽管保乳术后5年内的复发会严重影响患者生存,但晚期复发患者的15年生存率与从未发生局部复发的其他5年生存者相同。乳腺癌保乳术后局部复发的患者有更高的远处转移和死亡风险,术后5年内的早期局部复发比晚期局部复发发生远处转移的风险更高。
近年来,保乳治疗的5年局部区域复发率呈现下降趋势,Van Laar等[5]发表的一项回顾性研究纳入1988—2010年1143例女性≤40岁的接受保乳治疗的早期乳腺癌患者,其中保乳治疗包括保乳手术治疗和术后放疗,保乳治疗后中位随访时间为8.5年,与1988—1998年接受治疗的患者相比,1999—2005年及2006—2010年接受治疗的患者复发率更低,分别为9.8%、5.9%和3.3%。2011年的一项回顾性分析纳入了1998—2008年在单中心接受手术的6135例单侧乳腺癌患者,其中包括847例接受保乳手术的患者和5288例全乳切除术患者,结果显示,保乳术后的患者中50.9%的复发发生在3年内,30.2%的复发发生在3~5年内,而接受全乳切除术的患者中64.9%的复发发生在3年内,20.4%的复发发生在3~5年内[6]。
近年来,乳腺癌治疗趋向于更精准、更有效的个体化治疗,但复发方面研究数据十分匮乏,因为研究者随时间推移获得可靠的复发数据比较困难。美国学者Neuman等[1]的一项研究纳入了1997—2011年间9项临床试验超过6927例保乳手术患者资料;与历史数据比较发现,现代多学科保乳手术治疗可明显降低原发部位乳腺癌复发的概率,尽管研究数据表明保乳治疗可达到与全乳切除术相似的生存率,但传统保乳术还是较全乳切除术有较高的局部复发风险,许多患者在作出治疗决定时仍然会有担心局部复发的顾虑。该研究的数据表明,在保乳手术和现代全身治疗以及放疗后,总的局部复发率为4.2%。以往的治疗方案保乳术后复发率为5.0%~10.0%。乳腺癌分子分型也与保乳术后局部区域复发有关。研究数据表明,ER+/PR+/HER2+患者的复发率最低为3.0%,其次是ER-/PR-/HER2+患者(4.7%),复发率最高的分型是三阴性乳腺癌(6.9%)。由于相关研究数据的缺乏,该研究是迄今为止最大的一项乳腺癌复发与分子亚型关系的临床研究报道。目前的研究数据提示,现代保乳治疗时代复发率总体上呈显著降低趋势,通过多学科协作精准化、个体化治疗,根据不同亚型进行复发风险分层,可以帮助患者和医师更好地综合考虑决策。一项纳入17项随机试验的Meta分析表明,在超过40岁的患者中,保乳术后局部复发患者不到3%[7]。
虽然仅行保乳手术而不放疗的方案除临床试验外仅用于特殊情况,研究数据显示,该类患者的局部复发率通常高于联合放疗的患者[8]。现有研究数据显示,新的原发性肿瘤与真正复发相比,前者手术至IBTR的时间间隔明显更长,分别为7.3和3.7年[9]。保乳术后复发的时间间隔往往比全乳切除术更长,中位时间分别为3~4年和2~3年[10-14],特别是在接受辅助他莫昔芬和(或)化疗的患者中,保乳术后复发时间甚至会达到5~7年[15-16]。
11.2.2 保乳术后IBTR的模式
保乳术后局部区域的主要复发形式是IBTR。一项回顾性研究的数据显示,接受全乳切除术的女性复发风险呈现两个峰值,在术后第2年出现一个主要高峰,在术后第5年出现一个中等高峰;然而,在接受保乳手术的患者中第2年没有高峰,并且复发风险在5年内持续增加,术后第5年达到高峰[6]。2006年有一项纳入1901例患者的多中心研究也得出了相似的结果[17],保乳术后IBTR的风险在术后3~5年达到高峰,此后年复发率逐渐降低。在病理学类型方面,保乳治疗后局部发生局部复发的病理学类型既可以是浸润性癌,也可以是原位癌。在因浸润性癌而接受保乳手术治疗的患者中,超过80%的局部区域复发的病理学类型是浸润性的,其余则是非浸润性癌。一系列研究数据显示,约75%的术后复发为乳房内的临床孤立性复发,5%~15%的保乳术后复发同时伴有区域淋巴结转移,另外5%~15%则在诊断时便发现远处转移[12,14,18-20]。在术后复发的位置方面,绝大多数(50%~90%)保乳术后同侧复发位于原发性肿瘤的同一象限内,这代表真正复发或边缘遗漏,然而随着复发与最初诊断时间间隔的延长,复发更有可能出现在乳房的其他象限,很可能这时出现的复发主要是新的原发性肿瘤[19,21-23]。
11.2.3 保乳术后与全乳切除术后局部复发的差异
乳房切除的复发高峰出现在最初的两年中,而保乳术后的复发率每年都在增加,在5年内达到最高。全乳切除术和接受保乳手术的患者之间的复发模式不同[6]。全乳切除后复发通常可通过体格检查诊断,而保乳治疗后的许多IBTR则大多是依靠乳腺X线钼靶摄影检出的。全乳切除术后胸壁复发通常反映的是复发疾病,而在同侧保留的乳房中出现的复发病灶,既可能是初始癌局部复发,也可能是第二原发肿瘤。随访中出现同侧新发原发性乳腺癌的时间往往晚于真正的局部复发,且预后更好。相关文献在报道局部复发时很多是将新发原发性癌与真正的复发合并起来。虽然有研究显示,全乳切除术与保乳治疗后局部区域复发的总体预后相似[10],但值得注意的是全乳切除术后复发更有可能累及区域淋巴结,并且这些病例同时出现远处转移的风险更高,并且疾病特异性生存率更低。
1997年,ASCO首次发布了乳腺癌监测指南,其中专家小组建议所有女性乳腺癌患者在术后的前3年每3~6个月要有仔细的病史和体格检查,接下来的2年每6~12个月1次,然后每年1次。采用这种方法的理论基础是,60%~80%的乳腺癌术后复发发生在术后3年以内,因此在此期间应更频繁地监测[24]。值得注意的是,该指南所基于的复发数据来自早期临床研究,在这些研究中大多数患者都接受全乳切除术,而不是保乳手术。ASCO随后多次更新了这些指南,尽管目标人群可能接受了全乳切除术或保乳手术,但上述推荐的监测时间从未改变[25-26]。迄今为止,很少有前瞻性研究调查乳腺癌复发病灶的早期发现是否会改善预后,研究数据显示,旨在尽早发现“远处转移”的监测并不能提高生存率[27],然而早期发现“乳腺癌复发”对生存的影响仍然存在争议[28-29]。研究表明保乳术后进行更好的监测随访能促进发现更多早期复发的迹象,而在无症状期早期发现复发乳腺癌(包括同侧或对侧复发)可以使相对生存率提高27%~47%[30]。Perrone等[31]也报告了早期发现局部复发可能对乳腺癌初次治疗后患者的预后产生有利影响。
经专家组讨论并结合文献数据,认为接受保乳术后与乳房全切除术后的患者的复发风险模式存在差异,因此术后复发监测和随访策略应该根据患者的手术类型综合考量来确定。在保乳术后复发的高峰期内进行更频繁的监测随访可能有助于早期发现术后复发。早期发现乳腺癌的复发也可使少数在保乳术后拒绝进行挽救性全乳切除术的患者中有更高的保乳机会。进一步的前瞻性研究有助于解决制定科学的保乳术后复发监测及随访策略。
11.2.4 利用前瞻性数据登记项目开展真实世界研究
现有研究结果显示,真实世界数据在一些难以进行随机对照研究的研究问题中可能具有重要的应用价值,近年来,越来越多的中国学者开始关注真实世界研究在临床问题研究中的应用。例如由国家癌症中心领衔的中国癌症统计数据研究在2016年发表在世界顶级学术期刊CA Cancer J Clin[32],在乳腺癌研究领域,中国学者成立了西部乳腺癌临床协作组,囊括中国西部各省的23个乳腺癌诊治中心,2010—2012年收录了超过12000例患者数据;由解放军总医院第五医学中心江泽飞教授牵头的“CSCO BC数据库”截至2019年9月已纳入全国11家中心54000例真实世界病例,开展了多项真实世界研究。
对于保乳手术以后的长期安全性的真实世界研究也取得了很大进展,荷兰国家癌症登记项目中的乳腺癌人群保乳手术后10年的随访结果为我们揭开了真实世界中保乳手术的真实长期安全性[33]。该项目2000年1月—2004年12月共登记了37207例T1-2N0-1M0初治乳腺癌患者,其中21734例(58%)患者接受了保乳手术,经过10年的随访,结果发现保乳加上放疗的长期安全性甚至优于全乳切除(HR=0.51,95% CI:0.49~0.53,P<0.001;Adjusted HR=0.81,95%CI:0.78~0.85,P<0.001),而且这种优势在不同TNM分期亚组都有。在2003年一项区分不同亚组的研究中,4647例(62%)接受了保乳手术,与全乳切除对比没有发现明显优势(adjusted HR=0.88,95% CI:0.77~1.01,P=0.07),但在更早期的T1N0亚组保乳手术加放疗优于全乳切除。该真实世界的研究结果提示对于符合保乳条件的患者来说,保乳手术的长期安全性并不比全乳切除差,并可能改变临床实践的决策。
目前中国的真实世界研究仍然处于初级阶段,与国外比较,在文献发表数量、研究质量等各方面都存在一定差距。更重要的是,国外开展的真实世界研究大多为纳入较大样本、覆盖广泛人群的前瞻性队列研究或实效性临床研究,主要用于药物的有效性和安全性评价,这样的研究意义更为重大,更多的是改变临床实践的研究。反观中国目前的真实世界研究则主要是基于疾病登记系统及回顾性数据库,缺少实效性临床研究,除流行病学研究以外,往往样本量较小,因而大型专科数据库的建立具有重要意义。到目前为止,仍然没有出现根据真实世界证据改变中国临床决策制定的案例。为此,我们倡议国内学者充分利用前瞻性数据登记项目开展真实世界研究,以提高中国乳腺癌外科研究水平。乳腺外科医师正身处临床实践与研究改变之中,真实世界数据登记,需要多方的持续投入,挑战和机遇共存,需要搭建更好的平台,建立更多的联盟,开展更多的高水平研究,通过研究获得更多的中国数据,提出乳腺癌诊疗的中国方案。
11.2.5 保乳术后患者满意度评估
目前用于保乳术后满意度的患者报告结局测量工具有乳腺癌治疗结局测评(breast cancer treatment outcome scale,BCTOS)量表[34-35]和BREAST-Q量表[36-37](表2)。BCTOS量表是针对接受保乳术后患者进行乳房外观美学及功能的评估。该量表最初包含22个条目,后经研究者简化后分为2个分量表(功能状态和美观状态),共12个条目,其Cronbach’sα:0.81~0.91[34-35]。BREAST-Q量表是目前应用最为广泛、评估最为全面的患者报告结局测评量表,其报告结果不仅可以反映患者满意度及生活质量,还可以直接反映患者对治疗、护理及决策辅助等方面的需求[36-37]。BREAST-Q量表的保乳模块和期望模块可以对保乳术后患者进行满意度和生活质量测评。BREAST-Q量表兼有术前与术后2个版本,可实现同一患者术前术后满意度及生活质量的纵向比较,量表中有特定的乳房保乳模块,包含多种满意度维度的评估,如乳房满意度、护理满意度、手术的总体满意度等,并且,不同维度的评估可独立进行,因此,患者及临床医师可根据需求选择特定的维度,减少了不必要的信息采集。医师既可根据患者采取的手术方式选择评价问卷,也可整体评价所有接受乳房手术患者的满意度(如期望模块)。患者完成问卷后使用计算软件计算评分(可在官方网站获得),称为Q-SCORE,患者报告的分数越高意味着其满意度越高。BREAST-Q量表具有良好的灵敏度、特异度及反应性,多数条目简单易懂,一个模块的填写时间为10 min以内,可显著提高患者随访过程中的配合度。目前,BREAST-Q量表已被翻译成十几种语言,在全球范围内获得广泛的应用,其汉化工作已经部分完成。保乳、期望模块已完成患者验证,即将可以使用。

表2 常用的乳房重建术后患者满意度评估方法
11.2.6 保乳术后患者生活质量评估
目前没有专门针对保乳手术以后患者的生活质量评估的量表,更多的是参考全体乳腺癌患者的常用的乳腺癌患者生活质量评估量表,主要有欧洲癌症研究和治疗组织的乳腺癌生活质量问卷(European Organization for Research and Treatment of Cancer quality of life questionnaire breast cancer module 23,EORTC QLQ-BR23)、乳腺癌治疗功能评估问卷(functional assessment of cancer therapybreast cancer,FACT-B)、乳腺癌患者生活质量测定量表(quality of life instrument for patients with breast cancer,QLICP-BR)。
11.2.6.1 EORTC QLQ-C30和QLQ-BR23
欧洲癌症治疗研究组织(European Organization for Research and Treatment of Cancer,EORTC)研制了专门测量癌症患者生活质量的量表QLQ-C30[38-39]。QLQ-C30是EORTC研制的一套量表中的共性量表(core questionnaire),包含癌症患者生活质量的共性部分,如乏力、疼痛等。由于肿瘤部位、治疗方法的不同,各种癌症分别有各自特异的量表测量癌症患者QOL的特异部分。QLQ-BR23是乳腺癌患者生活质量特异问卷。QLQ-C30共30个条目,为自我报告形式,包括5个功能量表:躯体功能(physical function,PF)、角色功能(role function,RF)、认知功能(cognitive function,CF)、情绪功能(emotional function,EF)、社会功能(social function,SF);3个症状量表:疲乏(fatigue,FA)、疼痛(pain,PA)、恶心呕吐(nausea/vomiting,NV);6个单项测量条目(呼吸困难、失眠、食欲丧失、便秘、腹泻、经济条件)和1个整体生活质量量表(global quality of life,GOL)。功能、症状领域条目评定分为4级(1级:完全没有;2级:有一点;3级:相当;4级:非常),总生存质量领域条目评定分为7级(l~7代表很差~很好)。各功能领域得分越低说明症状越少,而总生活质量领域得分越高说明生活质量越好。QLQ-C30应用于不同国家和不同文化地区,都有较好的信度和效度。中国科学院心理研究所已对该套量表进行了汉化[40]。QLQ-BR23是乳腺癌患者生活质量特异问卷,适用于所有类型和接受各种治疗的乳腺癌患者[41-43]。该问卷共23个条目,被分为4个功能领域:体象(BRBI)、性功能(BRSEF)、性欲(BRSEE)、对未来的憧憬(BRFU),4个症状领域:系统治疗不良反应(BRST)、乳腺症状(BRBS)、上肢症状(BRAS)、对脱发的担忧(BRHL)。条目评定均分为4级(1级:完全没有;2级:有一点;3级:相当;4级:非常)。根据评分手册将每个维度的粗分进行变换转化为0~100分的标准得分,各功能领域得分越低,说明症状越少、生活质量越高。
11.2.6.2 FACT-B
FACT是由美国结局研究与教育中心的Cella等[44]研制出的癌症治疗功能评价系统。FACT-B由5个部分构成:生理状况GP(7条)、社会/家庭状况GS(7条)、情感状况GE(6条)、功能状况GF(7条)和附加关注B(9条),总分为144分,得分越高,生活质量越高。该量表的中文版[45]被证实具有良好的信度、效度和反应度,是乳腺癌患者生理、情感和社会功能等方面评价灵敏度很高的调查问卷。
11.2.6.3 乳腺癌患者生活质量测定量表(QLICPBR)
张冬梅等[46]参考QLQ-BR23和FACT-B,结合中国的文化特征和乳腺癌患者的一些特殊情况形成了QLICP-BR量表,主要包括躯体功能维度(6个条目)、心理功能维度(12个条目)、症状及不良反应维度(8个条目)、社会功能维度(10个条目)、总体健康状况(1个条目),共计37个条目。每个条目按根本没有(1分)、有一点(2分)、有些(3分)、相当(4分)、非常(5分)计分,其中条目5~10、27~32为正向计分条目,其余为逆向计分条目。总分为36~180分,总分越高表示其生活质量越好。该量表4个维度Cronbach’s α系数分别为0.74、0.80、0.75和0.62。
