棉铃虫Ⅰ型和Ⅶ型几丁质酶基因表达规律的比较分析
2021-01-18罗生慧麦麦提艾力阿卜杜纳斯尔白雪莹吕国会刘小宁
罗生慧,随 慧,包 静,麦麦提艾力·阿卜杜纳斯尔, 白雪莹,吕国会,刘小宁
(新疆大学生命科学与技术学院,新疆生物资源基因工程重点实验室,乌鲁木齐 830046)
棉铃虫是主要的农业害虫之一,是棉花蕾铃期的主要害虫,对其它农作物也具有巨大的危害性。因其具有广泛寄主范围以及转移危害的习性,对农业经济造成巨大的损失。化学杀虫剂因为使用方便、作用快速而被作为主要控制害虫的方法,但长期使用化学药物导致抗药性增加(Aktaretal., 2009)。因此,需要寻找一种环境友好型的害虫防治方法。研究发现,几丁质是构成昆虫角质层、表皮、肠道及围食膜的主要成分,而高等动植物体内不存在几丁质,因此,可以通过几丁质降解酶来破坏棉铃虫中几丁质的代谢平衡,从而可以达到绿色防治棉铃虫的目的。
几丁质(Chitin)是昆虫外骨骼角质层、围食膜、头壳、体壁等部位的主要成分,用以保护昆虫并维持昆虫的体型,还可以限制昆虫的生长。几丁质是在昆虫内表皮和外表皮或在新分泌的、非硬化的前表皮中发现的,且在昆虫的整个生命过程中几丁质的降解与合成是一直存在的(Lehane, 1997; 张严峻等,2000;相静波,2004;张八生,2007;Hegedusetal., 2009)。在昆虫的整个生命周期中,昆虫必须降解旧的角质层同时合成新角质(Hataetal., 1996; Merzendorfer and Zimoch, 2003; Muthukrishnanetal., 2012),即蜕皮现象(Nijhoutetal., 1981)。而昆虫的蜕皮过程是由几丁质酶(chitinase)和β-N-乙酰葡糖胺糖苷酶(β-N-acetyglucosaminidase)协同完成的(Fukamizoetal., 1985)。
几丁质酶(chitinase, CHT)是昆虫生长发育的各个阶段起着至关重要的作用,在蜕皮、围食膜的降解以及消化等重要生理过程(Shietal., 2004; Zhuetal., 2008; Arakaneetal., 2010; Jasrapuriaetal., 2010; Quetal., 2014)均与几丁质酶息息相关。几丁质酶是一类具生物催化活性的水解酶,能特异性水解成形的几丁质。随着生物技术及生物信息学的不断发展,通过对昆虫几丁质酶及其类似蛋白的催化域进行系统发育分析,可将昆虫几丁质酶划分为十个(Ⅰ-Ⅹ)类型(group)(Arakaneetal., 2003; Zhangetal., 2011; 夏梦,2015;Liuetal., 2018),每个类型几丁质酶在昆虫发育过程中执行不同的生理功能,其中II型几丁质酶包括4~5个催化域和4~7个CBD区主要与蜕皮发育相关(李大琪等,2011);III型几丁质酶包含2个催化域和一个CBD区,在N端含有一个跨膜结构域,属于膜结合蛋白,参与昆虫蛹化后腹部的收缩和翅的伸展(范晓军等,2013);IV型几丁质酶主要由一个信号肽和一个催化域组成,大部分缺失CBD区,参与围食膜的降解与更新,抵抗含有几丁质的有害病原菌,对昆虫起免疫保护作用(Khajuriaetal., 2010);V型几丁质酶包含一个信号肽和一个催化域,但缺乏CBD区,可作为生长因子,来增强细胞的增值能力(Zhuetal., 2008);VI型几丁质酶分子量较大,在C端有一个较长的富含Ser/Thr的高度糖基化无规则卷曲,可用来保护相似结构的几丁质酶不被降解(Yasuyuki and Subbaratnam, 2010)。本文主要对I型几丁质酶和VII型几丁质酶的结构和不同时空表达规律进行了研究。Ⅰ型几丁质酶(通常CHT5属于I型几丁质酶)主要参与昆虫蜕皮过程中旧表皮的消化,目前已经在鳞翅目、双翅目、鞘翅目、半翅目和直翅目昆虫中进行研究。Ⅰ型几丁质酶基因在昆虫表皮中的表达量最大(仙笑笑等,2012),该类酶的结构域含有N-末端信号肽、催化域(catalic domain, CAD)、连接区(linker)以及C-末端的几丁质结合结构域(chitinase binding domain, CBD)(张常,2014),CBD会增强酶对几丁质的亲和能力(夏梦,2015)。研究发现,当I型几丁质酶被RNAi沉默时,会导致蜕皮失败,甚至使昆虫死亡,这表明I型几丁质酶在蜕皮过程中参与新旧角质层的更新(Nohetal., 2018)。对于昆虫赤拟谷盗Triboliumcastaneum而言,Ⅰ型几丁质酶不正常的表达将导致其不能成功的从幼虫变为蛹,表明Ⅰ型几丁质酶对外骨骼或围食膜几丁质的降解有重要作用(Zhangetal., 2012;张常,2014;Nohetal., 2018)。Ⅶ型几丁质酶包含一个信号肽和单一的CAD,没有CBD,该类几丁质酶的功能尚不明确,有待进一步研究(Liuetal., 2018)。
昆虫几丁质酶作为分解昆虫体壁、中肠、围食膜等组织中几丁质的重要水解酶,在昆虫的消化、变态等生理活动中发挥着至关重要的作用,几丁质酶的过量或缺失都可影响到昆虫的正常发育。在本课题组前期的研究中发现HaCHT I可以降解胶体几丁质,而HaCHT VII对胶体几丁质则没有降解活性,但其可将寡聚糖降解成单糖,本研究以此为基础对棉铃虫I型和Ⅶ型几丁质酶的结构域及其基因表达规律进行了比较分析。为其功能的进一步探究奠定基础,也为棉铃虫生物防治提供有利信息。
1 材料与方法
1.1 材料实验昆虫
棉铃虫是由新疆生物资源基因工程重点实验室饲养,饲养条件:温度26±2℃,RH65%±5%,光周期16 h ∶8 h。
1.2 实验材料与试剂
RNA提取试剂盒(Trans Zol Up Plus RNA Kit)购于北京全式金公司;Real master mix SYBR green PCR试剂盒购买于invitrogen公司;Taq DNA聚合酶购自大连TaKaRa公司;其余化学试剂均为国产分析纯试剂;引物合成及测序均由上海生工完成。
1.3 结构域分析
通过利用在线工具SMART(http://smart.embl-heidelberg.de/)预测对本课题组前期克隆获得的棉铃虫的I型和VII型几丁质酶HaCHTⅠ、HaCHTⅦ的蛋白结构域,并标注信号肽、催化结构域、几丁质酶保守区以及几丁质结合结构域。
1.4 棉铃虫总RNA的提取及cDNA第一链的合成
为研究HaCHTI和HaCHTVII在棉铃虫生长发育过程的蜕皮阶段的表达规律,本研究收集了棉铃虫不同发育阶段蜕皮前后的中肠组织,同时收集了棉铃虫6龄幼虫的头壳、前肠、中肠、后肠、脂肪体、体壁,收集的所有组织均在-80℃冰箱保存备用。按照制造商的说明提取总RNA,将1 μg的总RNA合成为cDNA:首先,将Oligo d(T)18引物加入到总RNA中,并在70℃下温育10 min,后在冰上快速冷却5 min。然后加入MLV逆转录酶,在42℃孵育1 h,72℃孵育15 min。最后将反转录cDNA产物在冰上冷却并储存在-80℃以进行qRT-PCR。
1.5 棉铃虫HaCHT I和HaCHT VII 在不同发育阶段蜕皮前后和不同组织中的表达量
根据引物设计原则,运用DNAMAN 6.0软件和 primer 5.0软件设计了引物,HaCHTI(GenBank accession number:AAQ91786.1)的正向引物:5′-ATGA GAGTGATACTAGCGACGTTGGC-3′;反向引物:5′-CTAAGGCGTCCTGTTCATGAGC CGG-3′。HaCHTVII(GenBank accession number:XP_021180780.1)正向引物:5′-ATGAAAGTTTTA AGTTTATTCTTTGTT-3′;反向引物:5′-CTACAA ATTCAACACAAAAGCTACAGAC-3′。
2 结果与分析
2.1 HaCHTⅠ和HaCHTⅦ结构域的比较
本研究通过利用在线工具SMART(http://smart.embl-heidelberg.de/)预测HaCHTⅠ和HaCHT Ⅶ的信号肽序列、催化区域、连接区域和几丁质结合结构域(图1)。分析表明,HaCHTⅠ包括4个区域:N-末端信号肽、一个催化域、连接区以及C-末端几丁质结合结构域,而HaCHTⅦ仅含有一个N-末端信号肽、一个催化域和一个连接区。

图1 HaCHTⅠ和HaCHTⅦ结构域的比较Fig.1 Domain comparison between HaCHTⅠ and HaCHTⅦ
2.2 HaCHT I和HaCHT VII 在棉铃虫不同组织的表达分析
运用qRT-PCR检测HaCHTI在棉铃虫不同组织的表达量,如图2-A结果显示HaCHTI在棉铃虫的所有组织部位均有表达,但在统计学上没有显著差异(P>0.05)。图2-B结果显示的是HaCHTVII在棉铃虫不同组织的表达量,HaCHTVII在棉铃虫所有组织部位也均有表达,其中在头壳和体壁中的表达量显著高于前肠、中肠、后肠和脂肪体(P<0.05);脂肪体中表达量显著高于前肠、中肠、后肠(P<0.05);前肠、中肠、后肠中没有显著性差异(P>0.05)。
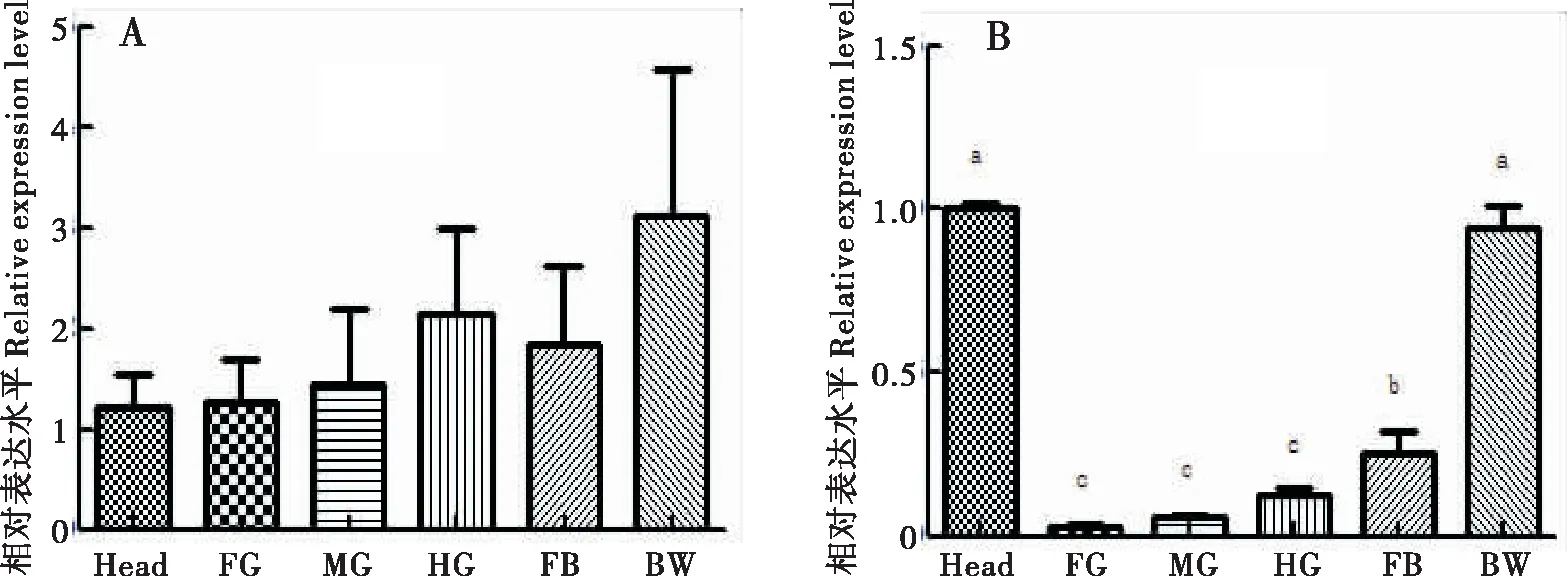
图2 HaCHT I和HaCHT VII 在棉铃虫不同组织的表达量Fig.2 Relative expression level of HaCHT I and HaCHT VII in different tissue of Helicoverpa armigera注:Head, 头壳; FG, 前肠; MG, 中肠; HG, 后肠; FB, 脂肪体; BW, 体壁。 A,HaCHTI在不同组织中的表达量;B,HaCHT VII 在不同组织中的表达量,qRT-PCR进行3个生物学重复,2个技术重复,数据使用单因素方差分析。Note: Head; FG, Foregut; MG, Midgut; HG, Hindgut; FB, Fat Bady; BW, Bady Wall. A, Expression amount of HaCHT I in different tissue; B, Expression amount of HaCHT VII in different tissue. Three biological replications and two technical replications were performed by qRT-PCR, and the data were analyzed by one-way ANOVA.
2.3 HaCHT I和HaCHT VII在棉铃虫幼虫蜕皮前后中肠中的表达分析
运用qRT-PCR检测HaCHTI和HaCHTVII基因在棉铃虫幼虫不同组织的表达量,结果表明HaCHTI和HaCHTVII基因在棉铃虫幼虫3龄末至预蛹阶段在中肠中均有表达。3龄末期HaCHTI表达量显著高于4龄末期(P<0.05),4龄末期HaCHTI表达量显著高于5龄、6龄末期及蛹期(P<0.05),5龄、6龄末期及蛹期没有显著性差异(P>0.05),总体分析HaCHTI在3龄、4龄、5龄、6龄末期及蛹期时的表达量呈递减的趋势(图3-A);4龄、6龄初期HaCHTI基因的表达量均显著高于5龄初期(P<0.05),总体分析HaCHTI基因的表达量在4龄、5龄、6龄初期时呈先减后增的趋势(图3-B)。而同一时期HaCHTVII和HaCHTI基因的表达量几乎成相反关系。在3龄、4龄末期时HaCHTⅦ的表达量没有显著性差异,但均显著低于5龄末期(P<0.05),5龄末期HaCHTVII表达量又显著低于6龄末期与蛹期(P<0.05),6龄末期与蛹期没有显著性差异,总体分析HaCHTVII在3龄、4龄、5龄、6龄末期及蛹期时的表达量呈递增的趋势(图3-C)。4龄、5龄初期HaCHTVII的表达量无显著差异(P>0.05),但显著高于6龄初期(P<0.05),总体分析HaCHTVII的表达量呈递减的趋势,与HaCHTI在不同龄期的初期表达量模式不同(图3-D)。

图3 HaCHT I和HaCHT VII 在棉铃虫幼虫发育阶段的表达量Fig.3 Expression of HaCHT I and HaCHT VII in the developmental stage of Helicoverpa armigera larvae注:3rdM,3龄末期;4thM,4龄末期;5thM,5龄末期;6thM,6龄末期;Pupa,蛹期;4thC,4龄初期;5thC,5龄初期;6thC,6龄初期。A,HaCHT I在幼虫3龄、4龄、5龄、6龄末期以及蛹期的表达量;B,HaCHT I在幼虫4龄、5龄、6龄初期表达量;C,HaCHT VII 在幼虫3龄、4龄、5龄、6龄末期以及蛹期的表达量;D,HaCHT VII 在幼虫4龄、5龄、6龄初期的表达量。qRT-PCR进行3个生物学重复,2个技术重复,数据使用单因素方差分析。Note: 3rdM, 3 inster telephase; 4thM, 4 inster telephase; 5thM, 5 inster telephase; 6thM, 6 inster telephase; Pupa, Pupa stage; 3rdC, 3 inster initial; 4thC, 4 inster initial; 5thC, 5 inster initial; 6thC, 6 inster initial. A,Expression amount of HaCHT I at the end of the 3rd, 4th, 5th and 6th instar and the pupal stage of H. armigera; B,Expression amount of HaCHT I at the beginning of the 4th, 5th and 6th instar of H. armigera; C,Expression amount of HaCHT VII at the end of the 3rd, 4th, 5th and 6th instar and the pupal stage of H. armigera; D,Expression amount of HaCHT VII at the beginning of the 4th, 5th and 6th instar of H. armigera. Three biological replications and two technical replications were performed by qRT-PCR, and the data were analyzed by one-way ANOVA.
3 结论与讨论
在昆虫的生长发育过程中,由几丁质组成的外骨骼及中肠的围食膜限制了体内器官的生长,因此,昆虫在生长发育过程中会出现蜕皮现象(Riddifordetal., 2016)。在昆虫蜕皮过程中,几丁质酶负责消化围食膜和外骨骼中的几丁质。昆虫几丁质酶是数量庞大且结构多样化的酶家族(Merzendorfer and Zimoch, 2003)。近年来,由于其在几丁质代谢中的重要生化功能而倍受关注。几丁质酶是一种内切酶,可降解几丁质为几丁寡糖。随着生物信息学的不断发展,通过对昆虫几丁质酶及其类似蛋白的催化域进行系统发育分析,可将昆虫几丁质酶至少划分为10种类型(Arakaneetal., 2003; Zhangetal., 2011; 夏梦,2015;Liuetal., 2018),每种类型具有各自的结构,其中有些几丁质酶具有一个共同的结构域,即几丁质结合结构域(CBD区)。CBD是昆虫几丁质酶的一个重要结构,具有6个保守的半胱氨酸,可能形成了3个二硫键(Sinuetal., 2010)。其中CBD结构域可增强几丁质酶与不溶性底物之间的亲和性,所以含有CBD结构域的几丁质酶可能对降解多聚几丁质比降解几丁寡糖更加有效(Yasuyukietal., 2003)。
本研究对棉铃虫几丁质酶HaCHTⅠ和HaCHTⅦ以及前期所获得的HaCHTⅣ的结构域进行比较,发现HaCHTⅠ和HaCHTⅣ在结构上都具有CBD区,而HaCHTⅦ则没有CBD区。本课题组前期对HaCHTⅠ和HaCHTⅣ的底物探索发现,两者均具有降解胶体几丁质的作用(古新蓉等,2019;麦麦提艾力等,2019)。在几丁质酶降解几丁质的过程中,几丁质酶的CBD就会锚定胶体几丁质,增加对底物的亲和能力(Zhuetal., 2008)。当几丁质酶没有CBD结构域时,也可降解几丁质,但是其活性很低(Gentaetal., 2009)。赤拟谷盗体内,异常表达的Ⅰ型几丁质酶则会导致昆虫无法顺利的从幼虫蜕变为蛹,说明Ⅰ型几丁质酶在参与角质层几丁质降解或围食膜的更换中起重要作用。大多数Ⅳ型几丁质酶在中肠或脂肪体中表达,还有少数Ⅳ型几丁质酶具有特异的表达时期(Zhuetal., 2008),Ⅳ型几丁质酶的结构域组成以及表达方式的特殊,说明其对昆虫具有十分重要的生理功能。有相关研究报道,当沉默欧洲玉米螟Ostrinianubilalis体内的Ⅳ型几丁质酶(OnCHT)时,其中肠围食膜的孔径变小而且对食物的消化速率有明显的下降,最终会影响昆虫的生长发育,甚至会抑制昆虫的生长(Khajuriaetal., 2010)。本文推测HaCHTⅠ和HaCHTⅣ可能对围食膜均有影响,这可能与它们有相同的CBD有关。HaCHTⅦ对胶体几丁质就没有几丁质降解活性,却能将壳二糖降解成单糖(麦麦提艾力等,2019),分析可能与其没有CBD有关,这就为HaCHTⅦ在棉铃虫体内起到将寡聚糖降解为单糖(N-乙酰基葡糖糖)提供了有力的证据,并为新几丁质的合成提供起始底物,参与昆虫的生长发育过程。为此本研究采用qRT-PCR方法对棉铃虫几丁质酶基因HaCHTI在棉铃虫不同组织及幼虫中的时空表达特性进行分析,发现HaCHTI在棉铃虫的各个组织中均高表达,在整个发育过程中均有一个基础水平的表达,表明HaCHTⅠ在棉铃虫的生长发育阶段的蜕皮过程中起着至关重要的作用,在蜕皮前后的表达量变化很大,尤其是4龄和6龄蜕皮后的表达量很高,有可能此期发挥着更重的作用。据相关报道显示赤拟谷盗的Ⅰ型几丁质酶基因TcCHT5在幼虫-成虫蜕皮过程中高表达(Zhuetal., 2008),但桔小实蝇Bactroceradorsalis中Ⅰ型几丁质酶基因BdCHT5在幼虫-蛹和蛹-成虫阶段均有高表达,推测BdCHT5在幼虫-蛹和蛹-成虫变态过程中调控几丁质的降解(Liuetal., 2018);家蚕Bombyxmori的I型几丁质酶BmCHT5在3龄幼虫蜕皮前开始高表达,并且在蜕皮过程以及蜕皮后也高表达,蜕皮12 h后开始消失(Kimetal., 1998),后期研究发现,BmCHT5在5龄幼虫蜕皮前后以及化蛹期间表达较高,推测BmCHT5主要在该阶段参与昆虫的蜕皮(Zhangetal., 2016);美国白蛾Hyphantriacunea的I型几丁质酶基因HcCHT5在4龄幼虫蜕皮前(60 h)开始高表达,并在蜕皮过程以及蜕皮后也高表达,蜕皮12 h后开始降低(Kimetal., 1998)。棉铃虫、赤拟谷盗、家蚕、美国白蛾均是全变态昆虫,综合分析可以得出,HaCHTI可能在棉铃虫蜕皮过程中发挥着降解表皮几丁质成分的作用,以满足棉铃虫幼虫的不断生长发育,这与前期对Ⅰ型几丁质酶功能的研究与报道是一致的,对棉铃虫几丁质酶基因HaCHTVII在棉铃虫不同组织及幼虫中的时空表达特性进行分析,HaCHTVII在头壳和体壁中表达显著高于其他组织,蜕皮前后表达量的变化较大,尤其是6龄末期和预蛹期的表达量相对很高,且本研究在饲养棉铃虫的过程中发现,由6龄末期到预蛹的过程中棉铃虫的表皮和头壳的变化较大,因此推测从幼虫到预蛹阶段HaCHTⅦ可能对头壳和体壁的变化发挥重要作用。
本研究通过对棉铃虫I型和Ⅶ型几丁质酶HaCHTⅠ、HaCHTⅦ的结构域进行比较分析后,发现两者具有相似的结构域,唯一不同点在于I型比Ⅶ型多了一个CBD。两种几丁质酶基因的时空表达也存在明显的差异,其中HaCHTI在4龄初期和6龄末期的表达量显著高于其他龄期,在各个组织中均有表达且没有显著性差异,因此推测HaCHTI参与其角质层几丁质降解的更换过程,从而促进旧表皮的降解及新表皮的生长,以满足棉铃虫发育和变态需求;HaCHTVII在6末及预蛹时高表达,在头壳和体壁中高表达,说明HaCHTVII可能对棉铃虫外骨骼系统中几丁质的形成具有重要作用。
在本研究中对几丁质酶基因HaCHTI和HaCHTVII只进行了初步的比较分析,结合本课题组前期对这些酶底物研究的结果,发现HaCHTⅠ可以降解胶体几丁质,而HaCHTⅦ对降解胶体几丁质没有降解活性,但其可将寡聚糖降解成单糖,可能为新的几丁质的合成提供起始底物,推测这可能与其没有结构域CBD有关。若对HaCHTⅠ和HaCHTⅦ进行RNA干扰、抑制、突变等手段破坏酶活性,检测其对围食膜的形态结构、昆虫的生长发育过程的影响,最终探明两种几丁质酶的功能差异,为其进一步的开发利用奠定基础。
