小檗碱抑制H2O2诱导的大鼠髓核细胞凋亡及ECM降解
2021-01-18郭亚萍王秀菊胡亚平李勇莉
郭亚萍,王秀菊,胡亚平,张 金,李勇莉
腰椎退行性病变常见于临床,是引起下腰痛的重要因素之一[1]。目前,腰椎退行性病变的发病机制尚不明确,但多数学者认为髓核细胞(nucleus pulposus cells,NPCs)病理学改变是主要原因[2]。NPCs的减少引起细胞外基质(extracellular matrix,ECM)降解是椎间盘退行性改变的病理基础,而NPCs大量凋亡是导致椎间盘细胞减少的直接原因[3]。因此寻找能抑制NPCs凋亡及ECM降解的药物对于防治椎间盘退行性病变意义重大。小檗碱(berberine,BBR)为季胺类化合物,具有抗感染、改善糖脂代谢及预防退行性改变等作用[4]。但是,目前鲜见有关BBR用于治疗腰椎退行性病变的研究。该研究探究BBR对NPCs凋亡及ECM降解的影响及其作用机制,为开发对NPCs具有保护作用的治疗药物以及BBR的临床应用提供理论参考。
1 材料与方法
1.1 实验动物5只SDF级SD雄性大鼠,体质量160~180 g,4周龄,由北京维通利华实验动物技术有限公司提供,动物许可证号SCXK(京)2017-0022。
1.2 主要试剂及仪器BBR(云南明镜亨利制药有限公司),bFGF(珠海亿胜生物制药有限公司),DEME细胞培养基(美国Life Technology公司),胰酶(美国ScienCell公司),胎牛血清(美国ScienCell公司),TRIzol 试剂盒(美国 Invitrogen 公司),恒温细胞培养箱(美国Thermo公司),酶标仪(上海赛默飞世尔公司),离心机(意大利A. L. C 公司),流式细胞仪(美国FCMXBD公司),光学显微镜(日本Olympus公司),冰冻切片机(美国Sigma公司),电泳仪及电泳槽(北京六一仪器厂),PCR扩增仪(美国Eppendorf公司),光学显微镜(日本Olympus公司)。
1.3 实验方法
1.3.1NPCs细胞分离与培养 断颈处死大鼠后,依据文献[5]所述方式采用序贯酶消法分离NPCs,接种于含有10%胎牛血清的细胞培养基中,经反复吹打后制成细胞悬浮液,置于恒温细胞培养箱(37 ℃、5%CO2)中进行传代培养,取第4代细胞进行后续细胞实验。
1.3.2细胞分组及干预方式 取对数期生长的NPCs,经胰酶消化后制成细胞悬浮液,接种于96孔板,200 μl/孔,2×105个/孔,随机分为6组。对照组(Control组):实验中不加任何物质干预;H2O2组:向培养基中加入H2O2[6]至终浓度为600 μmol/L;bFGF组:向培养基中加入碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)至终浓度为10 ng/ml;BBR25组:向培养基中加入BBR至终浓度为25 μmol/L;BBR50组:向培养基中加入BBR至终浓度为50 μmol/L;BBR100组:向培养基中加入BBR至终浓度为100 μmol/L。
1.4 检测指标
1.4.1CCK8法检测细胞增殖 取对数期生长NPCs,接种于96孔板,按照分组方式进行相应处理后置于恒温细胞培养箱中(37 ℃、5%CO2),分别在孵育0、24、48 h后向各组细胞中加入CCK8溶液,10 μl/孔,置于细胞培养箱中继续孵育2 h后采用酶标仪检测各孔在450 nm处的吸光度,每组细胞共包含3个复孔,计算不同时间点各组细胞增殖率。细胞增殖率=(A实验孔-A空白孔)/(A对照组-A空白孔)。
1.4.2流式细胞术检测凋亡率 取对数期生长NPCs,按照1×106个/孔的密度接种于6孔板中,按照分组方式进行相应处理后置于恒温细胞培养箱中(37 ℃、5%CO2),每组细胞含3个复孔,孵育24 h,经胰酶消化后收集各组细胞,PBS清洗3次,然后按照试剂盒说明书操作:用缓冲液重悬细胞,加入5 μl Annexin V-FITC 染色,并于暗处室温孵育15 min,再加入5 μl PI染色,静置5 min后用流式细胞仪检测其凋亡情况。
1.4.3Western blot检测蛋白表达 取对数期生长NPCs,按照1×106个/孔的密度接种于6孔板中,按照分组方式进行相应处理后置于恒温细胞培养箱中(37 ℃、5%CO2),每组细胞含3个复孔,孵育24 h后收集细胞。用10%SDS-聚丙烯酰胺凝胶电泳提取总蛋白,半干法将蛋白转移到PVDF膜,置于5%脱脂奶粉室温封闭2 h后加入Bcl-2、Bax、Caspase-3、Notch1、Hes1、Hes5、MMP-13、COL2A1及ACAN蛋白一抗,在4 ℃摇床中孵育24 h后再次用TBST缓冲液洗涤3次,并于相应二抗中在室温下孵育1 h,以β-actin为内参蛋白。随后,再次采用TBST缓冲液洗涤3次,滴加ECL显影剂显影。采用Image J软件进行灰度分析,计算各组细胞Bcl-2、Bax、Caspase-3、Notch1、Hes1、Hes5、MMP-13、COL2A1及ACAN蛋白相对表达量。
1.4.4RT-PCR检测mRNA表达 取对数期生长NPCs,按照1×106个/孔的密度接种于6孔板中,按照分组方式进行相应处理后置于恒温细胞培养箱中(37 ℃、5%CO2),每组细胞含3个复孔,孵育24 h后收集细胞。采用TRIzol试剂提取总RNA,然后用两步法RNA提取试剂盒将RNA转录成cDNA。选择MMP-13、COL2A1及ACAN基因的合适上下游引物,以cDNA为模板,采用PCR方法扩增待检测基因。基因产物通过2%琼脂糖凝胶检测,应用2-△△CT法分析数据,以其中β-actin为内参照。MMP-13、COL2A1及ACAN mRNA的相对含量为同一泳道目的片段积分吸光度值/内参积分吸光度值。

2 结果
2.1 BBR对H2O2诱导的大鼠髓核细胞增殖的影响细胞孵育24 h及48 h后,H2O2组细胞增殖率低于Control组(t=6.682、3.056,P<0.05)。细胞孵育48 h后,bFGF组、BBR25组、BBR50组及BBR100组细胞增殖率高于H2O2组(t=21.251、6.792、9.181、18.417,P<0.05)。见图1。

图1 不同时时间点各组细胞增殖情况比较
2.2 BBR对H2O2诱导的大鼠髓核细胞凋亡的影响相较于Control组,H2O2组细胞凋亡率增加(t=6.681,P<0.05);相较于H2O2组,bFGF组、BBR25组、BBR50组及BBR100组细胞凋亡率降低(t=8.859、4.124、5.354、8.174,P<0.05)。见图2。
2.3 BBR对H2O2诱导的大鼠髓核细胞凋亡相关蛋白表达的影响相较于Control组,H2O2组细胞Bcl-2蛋白相对表达量降低,而Bax及Caspase-3蛋白相对表达量升高(t=11.390、3.525、10.613,P均<0.05)。相较于H2O2组,bFGF组、BBR25组、BBR50组及BBR100组细胞Bcl-2蛋白相对表达量升高,而Bax及Caspase-3蛋白相对表达量降低(P均<0.05)。见图3。
2.4 BBR对H2O2诱导的大鼠髓核细胞MMP-13、COL2A1及ACAN mRNA和蛋白表达水平的影响与Control组相比,H2O2组细胞MMP-13、ACAN mRNA和蛋白表达水平均升高,而COL2A1 mRNA和蛋白表达水平降低(t=10.392、6.543、14.626,P均<0.05)。与H2O2组相比,bFGF组、BBR25组、BBR50组及BBR100组细胞MMP-13、ACAN mRNA和蛋白表达水平均降低,而COL2A1 mRNA和蛋白表达水平升高(P均<0.05)。见图4。
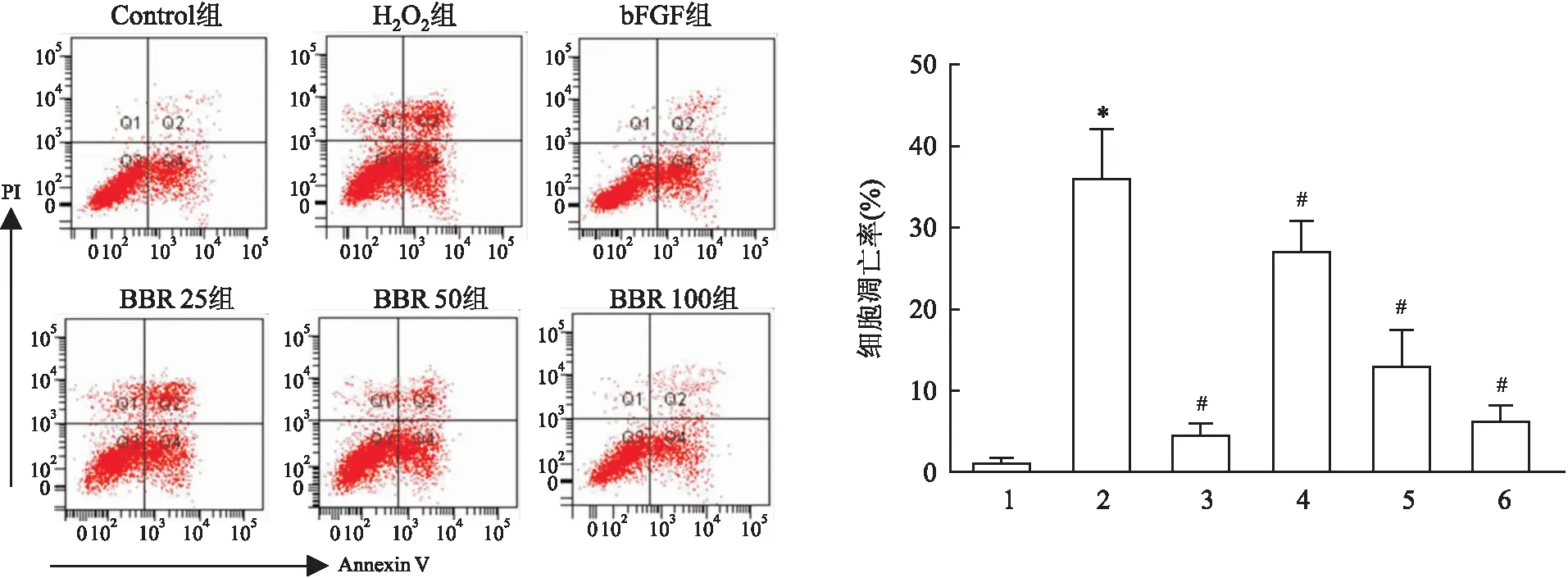
图2 各组细胞凋亡情况比较

图3 各组细胞Bcl-2、Bax、Caspase-3蛋白表达水平比较
2.5 BBR对H2O2诱导的大鼠髓核细胞Notch1、Hes1、Hes5蛋白表达水平的影响相较于Control组,H2O2组细胞Notch1、Hes1、Hes5蛋白表达水平均升高(t=7.645、10.036、7.746,P均<0.05)。相较于H2O2组,bFGF组、BBR25组、BBR50组及BBR100组细胞Notch1、Hes1、Hes5蛋白表达水平均降低(P均<0.05)。见图5。
3 讨论
腰椎间盘的退变始于中央的NPCs,伴随着NPCs的减少、表型的缺失,进而引起外层纤维环的破裂[7]。过度的细胞凋亡引起的NPCs减少是引发椎间盘退变的关键因素。而线粒体信号通路在细胞凋亡中发挥着至关重要的作用,H2O2激活的氧化应激可导致NPCs凋亡,从而诱导椎间盘退行性改变的发生。Leila et al[8]研究显示,H2O2介导的线粒体膜电位下降参与氧化应激诱导的NPCs凋亡,进而导致椎间盘退行性改变的发生。本研究采用H2O2处理NPCs,相较于Control组,其凋亡率得到显著提升,认为凋亡模型建立成功。

图4 各组细胞MMP-13、COL2A1及ACAN mRNA和蛋白表达水平比较
bFGF是一种肝素结合多肽,在椎间盘退行性病变中也起着重要的作用,能发挥分解代谢功能,而且能抑制髓核细胞凋亡。近年来随着中医的不断发展,中药治疗得到广泛应用,疗效佳且不良反应少。BBR亦称黄连素,具有很好的抗氧化活性,清除超氧阴离子及羟基自由基是其发挥抗氧化作用的主要机制。对于有氧化应激途径参与介导的NPCs凋亡,抗氧化干预十分重要。本研究中BBR干预可提升细胞增殖率并降低凋亡率,且随着BBR浓度升高这一作用更为明显,提示BBR可促进NPCs细胞增殖并抑制其发生凋亡。Chen et al[9]研究显示,对于H2O2诱导的大鼠NPCs,BBR干预可促进细胞增殖,并显著抑制细胞凋亡的发生,本研究结果与之相符。机体内的促凋亡基因和抑凋亡基因共同参与细胞凋亡的调控过程。Bcl-2是一种癌基因,能增强细胞对大多数DNA损伤因子的抵抗性,可抑制细胞凋亡;Bax基因是人体最主要的凋亡基因,可诱导细胞凋亡发生[10]。Caspase-3是特异的凋亡信号转导分子,激活后的Caspase-3是凋亡的执行者[11]。本研究中经BBR干预后,大鼠NPCs Bcl-2蛋白表达量得到提升,而Bax及Caspase-3蛋白表达受到抑制,提示BBR是通过提升抑凋亡蛋白表达及抑制促凋亡蛋白表达发挥对NPCs的保护作用,与bFGF疗效相当。

图5 各组细胞Notch1、Hes1、Hes5蛋白表达水平比较
除了NPCs的过度凋亡外,NPCs中ECM降解亦是椎间盘退变的重要诱发因素[12]。髓核组织中ECM主要是由COL2A1及ACAN组成,其降解主要是由基质金属蛋白酶(matrix metalloproteinase,MMP)及带有血小板凝血酶敏感蛋白样模体的解整链蛋白酶家族参与完成,其中MMP-13对ECM降解发挥着至关重要的作用[13]。本研究结果显示,BBR处理不仅可显著抑制MMP-13、ACAN蛋白表达水平,而且能提升COL2A1 mRNA和蛋白表达水平,提示BBR可通过调节COL2A1、ACAN蛋白的表达,并抑ECM制降解中间蛋白MMP-13的表达,实现对髓核细胞ECM降解的抑制作用。
Notch信号通路是一条相邻细胞间相互作用调控的高度保守的信号转导途径,其被证实在骨骼发育活动中起着至关重要的作用,并参与调节多种骨性疾病的发生及发展过程[14]。Notch信号通路由Notch受体(Notch1、Notch2、Notch3、Notch4)、Notch配体(DSL蛋白)和CSL DNA结合蛋白组成。在椎间盘退行性病变中,Notch受体蛋白的表达量增加,随即抑制其下游靶向基因Hes1及Hes5的活性,导致NPCs发生凋亡及ECM降解。本研究结果显示,H2O2可提升Notch1蛋白表达量,并抑制Hes1及Hes5蛋白表达,进一步证实Notch信号通路介导NPCs凋亡及ECM降解过程。在予以NPCs不同浓度BBR干预后,其Notch1蛋白表达受到抑制,而Hes1及Hes5蛋白表达提升,提示BBR可通过抑制Notch信号通路抑制NPCs发生凋亡及ECM降解,发挥对NPCs的保护作用,而这一结果在刘刚 等[15]研究中也得到证实。
综上所述,BBR可抑制H2O2诱导的大鼠NPCs凋亡及细胞外基质的降解,其作用机制可能与激活Notch信号通路有关。
