葛根素对匹罗卡品致痫大鼠海马神经元的保护性研究
2021-01-18胡擎鹏
彭 芳,胡擎鹏
许多研究[1]表明,氧化应激参与了癫痫的病理生理过程,其中活性氧(reactive oxygen species,ROS)水平的升高是癫痫诱发神经元损伤的主要原因。最近研究[2]表明,线粒体通透性转变孔(mitochondrial permeability transition pores,MPTP)开放后线粒体膜电位发生改变,促凋亡蛋白、抗凋亡蛋白和细胞色素C(Cytc)等蛋白释放进入细胞质,并启动caspase级联反应,最终导致神经元凋亡,提示线粒体可能在癫痫损伤中起重要作用;葛根素是从草药葛根中提取的一种黄酮类化合物,具有抗感染、抗氧化、抗凋亡等多种药理作用[3]。据研究[4]报道,葛根素对体外缺氧缺糖细胞和体内缺血性脑损伤具有神经保护作用。然而,葛根素对癫痫大鼠海马神经元损伤的影响尚不清楚,该研究旨在探讨葛根素能否减轻匹罗卡品诱发癫痫发作后海马神经元的凋亡以及可能的作用机制。
1 材料与方法
1.1 材料匹罗卡品购自美国 Sigma 公司;ROS测定试剂盒购自南京建成生物工程研究所; 罗丹明123购自美国 Sigma公司;细胞凋亡检测试剂盒购自武汉博士德生物工程有限公司;组织线粒体分离试剂盒购自北京普利莱基因技术有限公司;Bax(1 ∶500)、Bcl-2(1 ∶500)、Mito-CytC(1 ∶1 000)、Cyto-CytC(1 ∶1 000)、Cl-caspase3(1 ∶500)抗体购自英国Abcam公司。
1.2 动物及模型建立30只成年雄性Wistar大鼠,体质量250~300 g,购自南华大学实验动物中心[SCXK(湘)2016-0023]。所有大鼠均饲养在室温下并自由获取水和食物。实验经南华大学动物实验伦理委员会批准(编号:2019-105)。
给予Wistar大鼠腹腔注射氯化锂(127 mg/kg),18~24 h后腹腔注射硫酸阿托品(1 mg/kg),30 min后腹腔注射匹罗卡品(30 mg/kg)致癫痫。参考Racine规定标准,4~5级癫痫发作,被纳入实验组。癫痫持续60 min,然后注射安定(10 mg/kg,静脉注射)以降低死亡率。对照组大鼠接受相同体积的0.9%生理盐水。大鼠在癫痫发作消失后第2、8、24、72 h被处死。
1.3 动物分组将大鼠随机均分为5组:① 对照组;② 匹罗卡品组;③ 溶剂组:匹罗卡品给药前10 min给予溶剂(2.5 ml生理盐水);④ 50 mg/kg葛根素组;⑤ 25 mg/kg葛根素组。葛根素溶于生理盐水中,浓度为5 mg/ml,腹腔注射。
1.4 海马CA3区锥体神经元Nissl染色[5]72 h后,将大鼠麻醉处死,取出脑组织置于4%多聚甲醛中,石蜡包埋,切片,脱蜡至水,采用甲苯胺蓝Nissl染色法,对大鼠海马CA3区锥体细胞(0.5 mm长)进行盲法计数。
1.5 海马CA3锥体神经元TUNEL染色[6]参照试剂盒说明书,进行TUNEL染色测定凋亡神经元数量。在高倍显微镜下计数双侧大脑半球海马CA3锥体细胞数(0.5 mm长)。
1.6 线粒体分离分离海马组织,迅速放入预冷分离介质,彻底清洗组织,用玻璃匀浆器制成匀浆液,650 r/min离心10 min沉淀细胞核及细胞碎片,收集上清液,以10 000 r/min离心10 min,沉淀的线粒体用3%Ficoll溶解后铺于6%Ficoll界面上,并在6 500×g离心10 min,将最终的线粒体颗粒悬浮在分离培养基中并在-80 ℃下保存。所有步骤在0~4 ℃下预冷离心机中进行,蛋白质浓度由双辛酸(bicinchoninic acid,BCA)分析。
1.7 线粒体膜电位测定将线粒体蛋白悬浮液(10 μg)加入2.5 ml反应缓冲液中,再加入40 μl Rh-123使其终浓度为26 μmol/L,37 ℃下孵育5 min,然后10 ℃下10 000×g离心10 min,在503 nm激发波长和527 nm发射波长下测定上清液荧光强度。
1.8 线粒体中ROS水平检测线粒体(0.4 mg/ml)与荧光探针 2′,7′-二氯二氢荧光素二乙酸酯(2′,7′-Dichlorodihydrofluorescein diacetate,DCFH-DA)(2 μmol/L)在25 ℃孵育30 min,在485 nm激发波长和530 nm发射波长条件下测量DCF荧光,具体操作按照试剂盒说明书进行。ROS水平以荧光强度单位表示。
1.9 Western blot检测Bax、Bcl-2、Mito-CytC、Cyto-CytC、Cl-caspase3表达取海马组织50 mg,加入裂解液,BCA法测定总蛋白浓度,将等量蛋白(30 μg)上样,通过SDS-PAGE 凝胶电泳,然后转移到硝化纤维素膜上,5%脱脂牛奶中封闭2 h,加入一抗4 ℃孵育过夜,洗涤后,二抗孵育2 h,ECL显色、曝光、洗片,采用Image Lab 4.0软件测定各条带灰度值,以目的蛋白灰度值/GAPDH 灰度值表示蛋白相对表达量。

2 结果
2.1 海马神经元形态学观察对照组CA3区锥体神经元正常呈圆形,而匹罗卡品组神经元凋亡呈核固缩状。匹罗卡品组存活神经元数量较对照组降低(P<0.01,F=1.787)。25、50 mg/kg葛根素组能减轻癫痫诱发的神经元凋亡(P<0.05),见图1。
2.2 TUNEL法观察葛根素对癫痫诱导的神经元凋亡的影响对照组脑切片中未检测到TUNEL阳性细胞,匹罗卡品组和溶剂组切片中观察到大量TUNEL阳性细胞。与匹罗卡品组相比,25、50 mg/kg葛根素组癫痫诱导的神经元凋亡数下降(P<0.05,F=2.487),见图2。
2.3 葛根素对癫痫发作后线粒体膜电位的影响与对照组相比,2 h时匹罗卡品组线粒体膜电位无明显差异(P>0.05,F=3.112),而癫痫发作后8 h线粒体膜电位下降,并持续下降至72 h(P<0.05,F=2.459);与匹罗卡品组或溶剂组相比,25、50 mg/kg葛根素组线粒体膜电位上升(P<0.05,F=1.490),见图3。
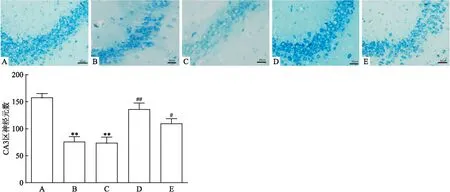
图1 Nissl染色观察海马CA3区锥体神经元 ×200

图2 TUNEL染色观察海马CA3区锥体神经元凋亡 ×200

图3 葛根素对癫痫大鼠线粒体膜电位影响
2.4 葛根素对癫痫大鼠线粒体ROS产生的影响与对照组相比,匹罗卡品组线粒体ROS水平在癫痫发作后8 h开始增加,并在72 h达到最大水平(P<0.001,F=3.585)。而与溶剂组或匹罗卡品组相比,25、50 mg/kg葛根素组线粒体ROS水平下降(P<0.05,F=2.335),见图4。

图4 葛根素对癫痫大鼠线粒体ROS生成影响
2.5 葛根素对Bax、Bcl-2、Mito-CytC、Cyto-CytC、Cl-caspase3表达的影响与对照组比较,溶剂组或匹罗卡品组Bax、Cyto-CytC、Cl-caspase3表达升高,而Bcl-2、Mito-CytC表达降低;而与溶剂组或匹罗卡品组相比,25、50 mg/kg葛根素组Bcl-2、Mito-CytC表达升高,Bax、Cyto-CytC、Cl-caspase3表达降低,见图5。

图5 Bax、Bcl-2、Mito-CytC、Cyto-CytC、Cl-caspase3蛋白表达
1:对照组; 2:匹罗卡品组; 3:溶剂组: 4:50 mg/kg葛根素组;5:25 mg/kg葛根素组;与对照组比较:**P<0.01,***P<0.001;与溶剂组或匹罗卡品组比较:#P<0.05,##P<0.01
3 讨论
癫痫是一种阵发性脑功能障碍疾病,持续性发作可导致脑神经元变性,虽然在癫痫发作后致神经元损伤方面的研究已取得很大进展,但其机制仍不清楚,且防治损伤发生发展的方法有限。本研究显示葛根素对癫痫引起的神经元损伤具有保护作用。线粒体功能障碍被认为是癫痫的一个重要促发因素[7],鉴于线粒体在诱导细胞凋亡中的重要作用,假设靶向线粒体信号通路的药物可能具有广泛的神经保护作用。
越来越多的研究表明[8],氧化应激作为一个关键因素不仅是癫痫发作的后果,而且可能参与了癫痫发生。在癫痫患者大脑中,过量ROS产生会导致细胞损伤和死亡。线粒体除了合成ATP外,还具有多种极为重要的功能,是细胞内生成ROS的主要部位,也是ROS诱发氧化损伤的主要靶点[9]。线粒体功能失调会产生更多ROS,同时ROS介导的线粒体氧化损伤也会导致更多ROS产生[10]。癫痫发作产生大量ROS,随后ROS引发的氧化损伤会导致MPTP开启,这使线粒体释放诸如CytC及凋亡诱导因子等成分依次启动凋亡[11],因此使用抗氧化剂调节线粒体功能可能是癫痫的潜在治疗方法。Nissl染色显示,25、50 mg/kg葛根素组能减轻癫痫诱发的神经元凋亡(P<0.05),这说明葛根素对癫痫诱发神经元死亡具有保护作用;葛根素对线粒体膜电位及ROS影响:经25、50 mg/kg葛根素治疗后,线粒体产生的ROS明显减少,而膜电位增加,这可能是葛根素抗氧化作用的结果,ROS减少可能会调节线粒体功能从而减少细胞凋亡;在本研究中,葛根素预处理能显著减少癫痫发作后大鼠海马神经元TUNEL阳性细胞的数量,这提示葛根素通过保护线粒体功能发挥抗凋亡作用,可能与其抗氧化作用具有潜在关系。
Bcl-2家族蛋白在细胞凋亡过程中起着重要作用,如Bax和Bcl-2是调节细胞凋亡和CytC的关键分子[12]。Bcl-2能促进细胞存活并抑制各种刺激引起细胞凋亡,其过表达能减少线粒体释放CytC[13]。而Bax是一种促凋亡因子,它可以插入线粒体外膜从而开启MPTP,释放CytC,而CytC释放会最终激活caspase-3,导致DNA断裂、核染色质浓缩和凋亡[14]。Western blot结果显示,匹罗卡品组大鼠Mito-CytC表达较对照组明显下降,这可能是由于匹罗卡品能上调Bax表达、抑制Bcl-2表达,而25、50 mg/kg葛根素预处理后上调Bcl-2表达、下调Bax表达,从而抑制Cyto-CytC以及caspase-3的激活。
ROS诱导的DNA损伤可导致细胞周期停滞甚至凋亡。还有研究[15]表明,ROS参与了癫痫介导神经元变性过程中凋亡机制的触发。因此,ROS可能参与了一些癫痫模型中细胞凋亡相关蛋白的调节。Western blot结果显示,葛根素组Bcl-2、Mito-CytC表达升高,Bax、Cyto-CytC、Cl-caspase3表达降低,这可能是葛根素抗氧化作用的结果,葛根素能有效地减少癫痫大鼠海马线粒体ROS的生成,恢复线粒体功能,进而通过抑制Bax诱导的线粒体CytC释放而减少细胞凋亡。
综上所述,本研究首次证明葛根素对癫痫大鼠海马损伤的治疗作用,尽管其可能机制和长期使用效果仍需确定,但葛根素是一种很好的抗氧化剂,它通过保护线粒体功能从而对癫痫损伤起到神经保护作用,具有潜在的治疗价值。
