IPO-38、NIBP2 表达与结肠癌TNM 分期的关系
2021-01-18刘松鸽王军凯李晓娜
刘松鸽,王军凯,李晓娜
(河南科技大学附属许昌市中心医院病理科,河南 许昌461000)
流行病学研究表明, 结肠癌的发病率可超过896/10 万人左右[1],在合并有相关消化道恶性肿瘤家族史的群体中,结肠癌的发病率可持续上升。结肠癌的发生,能够导致患者近期生活质量及高肿瘤负荷的出现,并增加了结肠癌患者远期病死的风险[2]。在研究结肠癌患者临床病理特征进展的相关因素过程中,发现细胞因子的改变,能够通过影响到癌细胞的生物学特征,干预到消化道上皮粘膜细胞的浸润能力。增殖相关蛋白(IPO-38)的表达上升,能够通过诱导转录因子的激活, 增加癌细胞核DN A 的异常分裂风险,加剧癌细胞的异常扩增和复制过程[3];NIK 和 IKKβ 结合蛋白(NIBP2)是细胞周期调控相关因子, 其能够通过诱导癌细胞G1/S 期细胞比例的改变,最终促进癌细胞的凋亡抑制,促进癌细胞的异常分化[4]。为了揭示 IPO-38、NIBP2 的表达与结肠癌患者的病情关系,从而为临床上结肠癌患者的诊疗提供参考,本次研究选取我院收集的88 例结肠癌组织标本,探讨了 IPO-38、NIBP2 的表达及其与结肠癌患者的病情关系。
1 资料与方法
1.1 临床资料 选取 2014 年 1 月至 2017 年 7 月我院收集的88 例结肠癌组织标本、44 例经病理学检查证实为正常肠粘膜组织(正常组)。
结肠癌组,年龄 47~75 岁,平均 60.3±9.1 岁,性别构成:男 50 例、女 38 例;病灶直径>5cm 41 例、≤5cm 47 例;TNM 分期:Ⅰ期 22 例、Ⅱ期 34 例、Ⅲ期 29 例、Ⅳ期 3 例;浸润深度:T1~T2 26 例、T3~T4 62 例;淋巴结转移阳性38 例;其中左半结肠38 例、右半结肠 50 例。正常组,年龄 42~75 岁,平均 59.0±8.8 岁;性别构成:男 27 例、女 17 例。两组患者的年龄、性别比较,差异均无统计学意义(P>0.05)。
诊断及入选标准:⑴结肠癌的诊断标准参考中华医学会制定的标准[5];⑵纳入对象的年龄≤75岁;⑶经手术后病理学或经肠镜取活组织进行病理学检查证实;⑷正常组为实施结肠镜检查且为正常的患者;⑸本研究符合《赫尔透辛基宣言》相关伦理及保密原则。
排除标准:⑴转移性结肠癌;⑵在获取标本前具有放化疗史、免疫学治疗病史;⑶伴有其他系统的重大疾病;⑷免疫疾病或长期使用糖皮质激素治疗的患者。
1.2 免疫组化染色方法及评价标准 石蜡切片采用二甲苯进行脱腊至水,5%的双氧水常温在孵育10min,采用磷酸盐缓冲液孵育5min,蒸馏水冲洗3 次,每次5min,5%的山羊血清抗体封闭10min,不冲洗,滴加一抗(购自abcum 公司 批号:20119304浓度:1:500),4℃冰箱孵育过夜,蒸馏水冲洗 3 次,每次5min,滴加生物素标记好的二抗(购自北京康泰生物批号:20104856 浓度:1:1000),37℃孵育30min,蒸馏水冲洗3 次,每次5min,滴加第二代辣根酶标记的工作液体,37℃孵育10min,蒸馏水冲洗3 次,每次5min,显色之后采用酒精脱水、二甲苯透明、树胶封片,镜下观察。
免疫组化结果判定:IPO-38 蛋白阳性着色表达于细胞质、NIBP2 蛋白的阳性着色表达于细胞质及细胞核,呈黄色、棕黄色、褐色表达,⑴根据着色强度:0 分为无色、1 分为淡黄色、2 分为棕黄色、3分为褐色、黑色;⑵根据阳性细胞比例:阳性细胞数目所占比例≤10%为1 分、 阳性细胞所占比例11%~50%为 2 分、 阳性细胞数 51%~75%为 3 分、阳性细胞数所占比例>75%为4 分, 两种积分相乘总分<3 分为阴性、≧3 分为阳性。
1.3 统计学方法 采用美国IBM SPSS 公司的统计软件包SPSS21.0 版本对本研究的数据进行统计学处理, 采用表示符合正态分布的计量资料,两组间分析采用t 检验;计数资料组间分析采用χ2检验;P<0.05 为差异具有统计学意义。
2 结果
2.1 结肠癌组织与正常组中的IPO-38 蛋白、NIBP2 蛋白阳性率比较 结肠癌组织中IPO-38 蛋白、NIBP2 蛋白阳性表达率 70.45%、64.77%, 正常组的IPO-38 蛋白、NIBP2 蛋白阳性表达率 38.64%、27.27%,两组比较差异具有统计学意义(P<0.05);见表 1、图 1、图 2。

表1 结肠癌组织与正常组中的IPO-38蛋白、NIBP2 蛋白阳性率比较[n(%)]
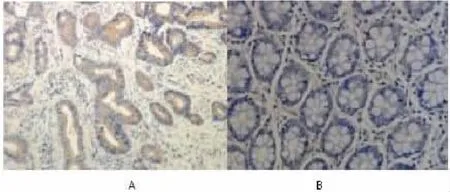
图1 NIBP2 蛋白免疫组化结果,A 为结肠癌组织、B 正常结肠组织,(×200 倍)
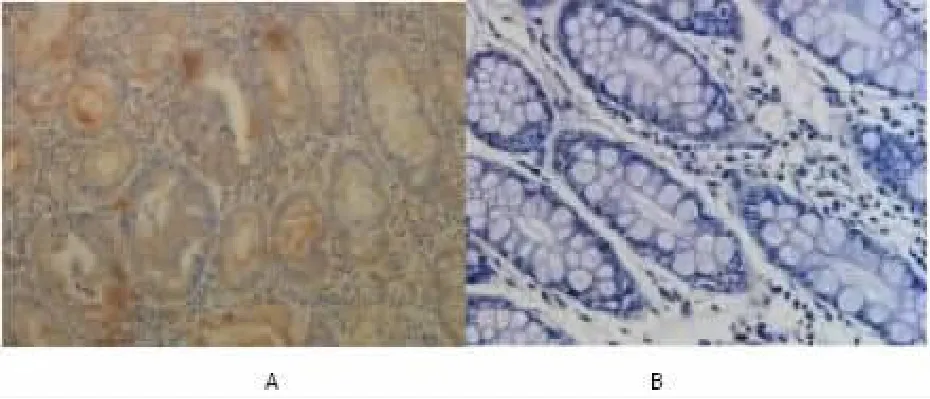
图2 IPO-38 蛋白免疫组化结果,A 为结肠癌组织、B 正常结肠组织,(×200 倍)
2.2 结肠癌组织与正常组中的IPO-38 蛋白、NIBP2 蛋白阳性率比较 TNM 分期 (Ⅲ期+Ⅳ期)、发生淋巴结转移、浸润深度(T3~T4)的结肠癌组织中IPO-38 蛋白、NIBP2 蛋白阳性表达率显著的高于TNM 分期(Ⅰ期+Ⅱ期)、未发生淋巴结转移、浸润深度(T1~T2),差异具有统计学意义(P<0.05);见表 2、表 3。

表2 结肠癌组织与正常组中的IPO-38 蛋白阳性率比较
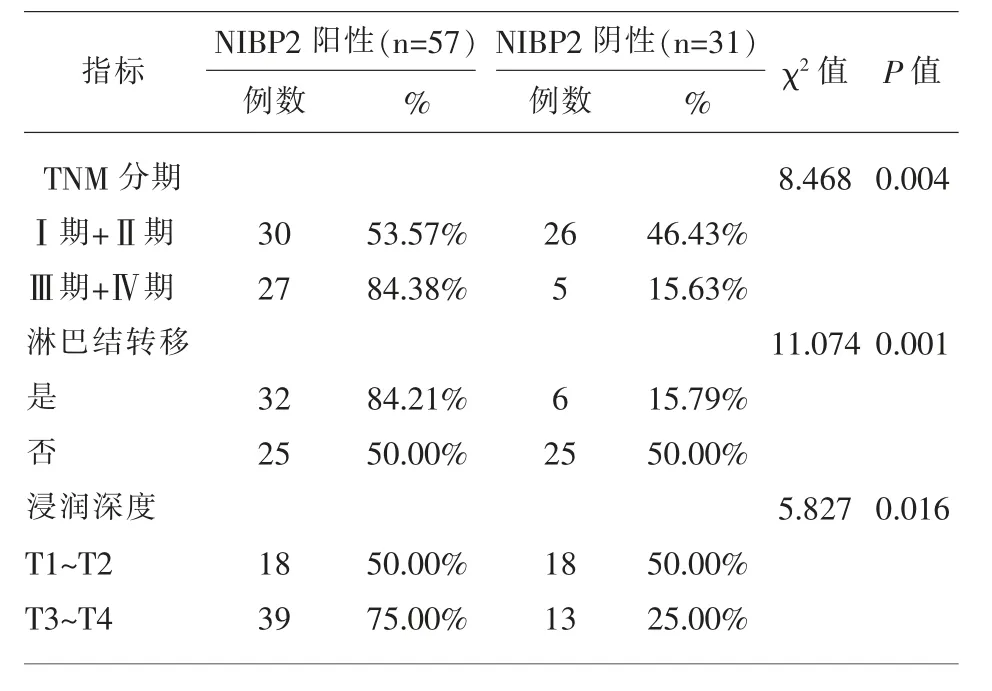
表3 结肠癌组织与正常组中的NIBP2 蛋白阳性率比较
3 讨论
消化道恶性肿瘤家族史或者携带有相关遗传易感基因,均能够促进结肠癌的发生,特别是在长期高蛋白饮食或者低纤维素饮食的群体中,结肠癌的发病率可进一步的上升[6]。长期的临床随访观察研究发现,结肠癌患者的5 年生存率不足45%,其中位生存时间不足34 个月[7,8]。现阶段缺乏对于结肠癌患者病情评估的肿瘤标志物, 虽然CA199 或者CEA 等肿瘤指标能够在结肠癌的临床病理特征评估过程中发挥作用。但部分研究发现,采用CA1 99 或者CEA 评估结肠癌患者病情的灵敏度较低,其对于结肠癌患者病情评估的一致性率或者可参考性较低[9]。本次研究通过对于结肠癌患者病灶组织中IPO-38、NIBP2 的表达分析研究,能够在部分揭示结肠癌临床病理特征进展机制的同时,为临床上结肠癌患者的诊疗提供理论方面的参考。
IPO-38 是增殖相关因子, 其通过对于癌细胞膜上转录结合因子的结合,能够提高癌细胞转录上游启动子的激活程度, 提高癌细胞的转录激活水平。基础方面的研究认为,IPO-38 能够通过诱导癌细胞内MAPK 或者AKT 信号通路,进而加剧癌细胞的异常分化过程,导致癌细胞浸润能力的上升;NIBP2 作为细胞周期调控相关因子,其不仅能够影响到处于静止期癌细胞的比例,同时其还能够增加癌细胞上皮-间质转换的风险,促进癌细胞的转移和复发。NIBP2 对于肿瘤微环境的影响,能够进一步加剧癌细胞生物学特征的恶化,影响到癌细胞的早期异常分裂过程。部分研究者探讨了NIBP2 的表达与结肠恶性肿瘤的关系,认为在结肠恶性肿瘤患者中,NIBP2 蛋白的表达浓度明显上升[10],但对于IPO 的分析研究较少。
本次研究通过免疫组化探讨了IPO-38、NIB P2 的表达情况,发现在结肠癌患者中,病灶组织中的IPO-38、NIBP2 表达阳性率明显的上升,高于良性对照组结肠组织,统计学差异显著,提示了IPO-38、NIBP2 的高表达均能够影响到结肠癌患者的病情进展。这主要由于IPO-38、NIBP2 的表达上升,能够通过影响到结肠粘膜上皮细胞的自我增值失调,加剧癌细胞突破基底膜组织的能力,最终促进结肠癌的发生和中晚期病情进展过程。王爱军等[11]研究者也发现,在结肠癌患者病灶组织中,增殖相关蛋白的表达阳性率可平均上升35%~65%, 同时在合并有明显的肠道外转移或者腹水的患者中,病灶组织中增殖相关蛋白的表达阳性率可进一步的上升。免疫组化染色分析可见,在病灶组织中,IPO-38、NIBP2 蛋白主要定位于癌细胞膜周边或者细胞质内侧,同时在癌细胞异型性较为明显的区域,IPO-38、NIBP2 的染色强度可明显上升。在探讨IPO-38、NIBP2 的表达与结肠癌患者临床病理特征关系的过程中,发现在临床分期较晚、浸润深度较深或者发生了淋巴结转移的患者中,IPO-38、NI BP2 蛋白的表达阳性率较高, 提示IPO-38、NIBP2的表达可明显的上升。这可以从下列几个方面进行理解[12-15]:⑴IPO-38 的上升,能够提高结肠腺体上皮细胞的变形能力,促进癌细胞浸润范围和浸润深度的增加,提高了临床分期的进展;⑵NIBP2 的上升能够影响到癌细胞分泌淋巴结内皮细胞粘附分子的能力,导致淋巴结转移的发生。
综上所述,在结肠癌患者病灶组织中,IPO-38、NIBP2 蛋白的表达阳性率均明显上升, 同时IPO-38、NIBP2 的表达与结肠癌患者的临床分期、 淋巴结转移或者浸润深度密切相关。
