发酵饲料的混菌复配优化及应用评价
2021-01-18马娜娜张心青杨传伦杨丹丹刘结磊王秀芝曹清杰
马娜娜,张心青,杨传伦,杨丹丹,刘结磊,王秀芝,曹清杰
(1.黄河三角洲京博化工研究院有限公司,山东滨州 256500;2.博兴红马饲料科技有限公司,山东滨州 256500)
发酵饲料主要通过微生物的生长代谢作用或生产代谢过程产生的一些活性物质作用于发酵底料,将其中的大分子物质或抗营养因子分解为更易于动物体吸收的小分子物质从而提高饲料的利用率[1-3],同时发酵饲料中富含的微生物进入动物肠道后能够增加肠道有益菌群数量[4],抑制或降低病原菌数量,从而提高肠道健康[5,6]。
酵母菌、芽孢杆菌及乳酸菌为最常见的可饲用益生菌[7]。酵母菌体中含丰富的蛋白、维生素等营养物质[8]。芽孢杆菌产生的芽孢生命力强,对动物体中的胃液和肠液耐受度高[9];该菌属好氧菌,能够为乳酸菌等厌氧菌提供有利的生长环境[10];此外,该菌能够分泌多种酶物质而促进饲料中大分子物质被消化[11,12]。乳酸菌发酵可产生多种有机酸类活性物质,对肠道内的病原菌有较强的抑杀效果[13];有研究表明乳酸菌发酵后期含有较高的超氧化物歧化酶,对动物体的免疫力提高有显著效果[14]。混菌发酵就是利用益生菌之间相互作用实现饲料的营养和益生价值最大化。本研究旨在探讨混菌发酵饲料中各益生菌复配比例的最优化及其对猪生长性能的影响,研制具有微生物饲料添加剂和发酵饲料双重特点的复合益生菌发酵饲料,为复合益生菌发酵饲料的生产与应用提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 试验菌株及动物 饲用菌株:地衣芽孢杆菌(Bacillus licheniformis)、EM 酵母、屎肠球菌(Enterococcus faecium)、凝结芽孢杆菌(Bacillus coagulans)、纳豆芽孢杆菌11083(Bacillus natto)、植物乳杆菌ZP(Lactobacillus plantarum)、产朊假丝酵母(Candida albicans)、酿酒酵母(Saccharomyces cerevisiae)。
病原菌菌株:大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)和沙门氏伤寒菌(Salmonella)。
试验动物:雄性长白猪,88日龄,体重70~80 kg。
1.1.2 试验溶剂及培养基 人工胃液[15]:取稀盐酸(1 mol/L)16.4 mL,加水约800 mL及胃蛋白酶10 g,搅匀后加水定容至1 000 mL,充分溶解后用0.22μm微孔滤膜过滤除菌。
人工肠液[15]:取磷酸二氢钾6.8 g加水500 mL,用0.4%氢氧化钠溶液调节pH至6.8,另取胰蛋白酶10 g和猪胆盐3 g加水适量使其溶解,将两液混合后,加水定容至1 000 mL,充分溶解后用0.22 pm微孔滤膜过滤除菌。
淀粉培养基:酵母膏胨葡萄糖(YPD)琼脂培养基中添加1%的可溶性淀粉。
脱脂奶粉培养基:5 g脱脂奶粉加50 mL蒸馏水溶解,1.5 g琼脂粉加50 mL蒸馏水溶解,分别高温高压灭菌,冷却后混合倒板。
纤维素刚果红培养基:称取25.3 g纤维素刚果红,加热溶解于1 000 mL蒸馏水中,分装,121℃高压灭菌15 min。
发酵底料:玉米粉∶麸皮∶豆粕 =4∶3∶3。
1.2 试验器材
超净工作台VS-840,苏州尚田洁净技术有限公司产品;灭菌锅YXQ-75G,上海博迅实业有限公司产品;恒温振荡器SHY-2(THZ-82),常州中捷精密机械有限公司产品;烘箱101-0B,苏州台德数控机械有限公司产品;电子天平FB124,上海齐强仪器制造有限公司产品;生化培养箱BJPX,山东博科生物产业有限公司产品。
1.3 试验方法
1.3.1 菌株筛选 产酸能力评价:无菌条件下用接种环取固体培养基上的单菌落接种于液体培养基中,培养24 h后进行菌液pH检测。
菌株耐受能力评价:用柠檬酸盐缓冲液将益生菌培养液离心制备成菌悬液,吸取0.5 mL分别转接至加有4.5 mL人工胃液或人工肠液的无菌试管中培养,分别取0.5 mL培养1 h和2 h后的培养液进行稀释涂布,测定活菌数。
对病原菌的拮抗:取培养12 h的病原菌菌液加入到冷却至适宜温度的LB固体培养基中,摇匀倒板,用打孔器于平板中间打一个孔,加入50 μL益生菌菌液,每个菌3个平行,之后将平板置于恒温培养箱中培养过夜,测定抑菌圈大小。
菌株产酶活性检测:将待测菌液分别滴加到淀粉培养基、脱脂奶粉培养基及纤维素刚果红培养基上,于培养箱内培养48 h,观察是否有透明圈。
1.3.2 混菌复配优化 进行菌株的正交设计试验,通过检测分析各组发酵饲料的指标,筛选最佳复配组合,检测指标如下。
pH检测:参照 NY-T 1377—2007[16]。
水分、粗蛋白 检 测:参 照 GB/T 5915—2008[17]。
乳酸、游离氨基酸含量检测:将发酵饲料稀释10倍后,在摇床匀速振荡30 min,分别利用乳酸检测试剂盒、游离氨基酸检测试剂盒(南京建成生物工程研究所)进行乳酸、游离氨基酸含量的检测。
菌量检测:准确称取发酵饲料1 g加入带有玻璃珠的无菌盐水中,摇床振荡30 min,进行平板稀释涂布,每个梯度做两个平行。
1.3.3 饲料发酵 按量称取所需物料混合均匀,调节水分至35%左右,接种率6%,接种完成后将菌包放置35℃好氧发酵15~18 h,然后厌氧发酵4 d。
1.3.4 应用评价 设置空白组与混菌饲喂组,每组3个重复,每重复2个平行。对照组饲喂全价料,混菌组饲喂10%发酵饲料+90%全价料。从试验第10 d开始取样,每隔7 d左右取样一次,检测猪粪菌量、粗蛋白表观消化率[18]。试验结束进行平均日增重和料肉比的计算。试验周期2个月。
1.4 数据处理与分析
采用Microsoft Excel和正交设计助手软件对数据进行处理与分析。
2 结果与分析
2.1 饲用菌株的筛选
2.1.1 产酸性能检测 植物乳杆菌ZP、凝结芽孢杆菌、EM酵母、屎肠球菌及产朊假丝酵母产酸能力相对较强,纳豆芽孢杆菌11083呈碱性,不具备产酸能力(图1)。
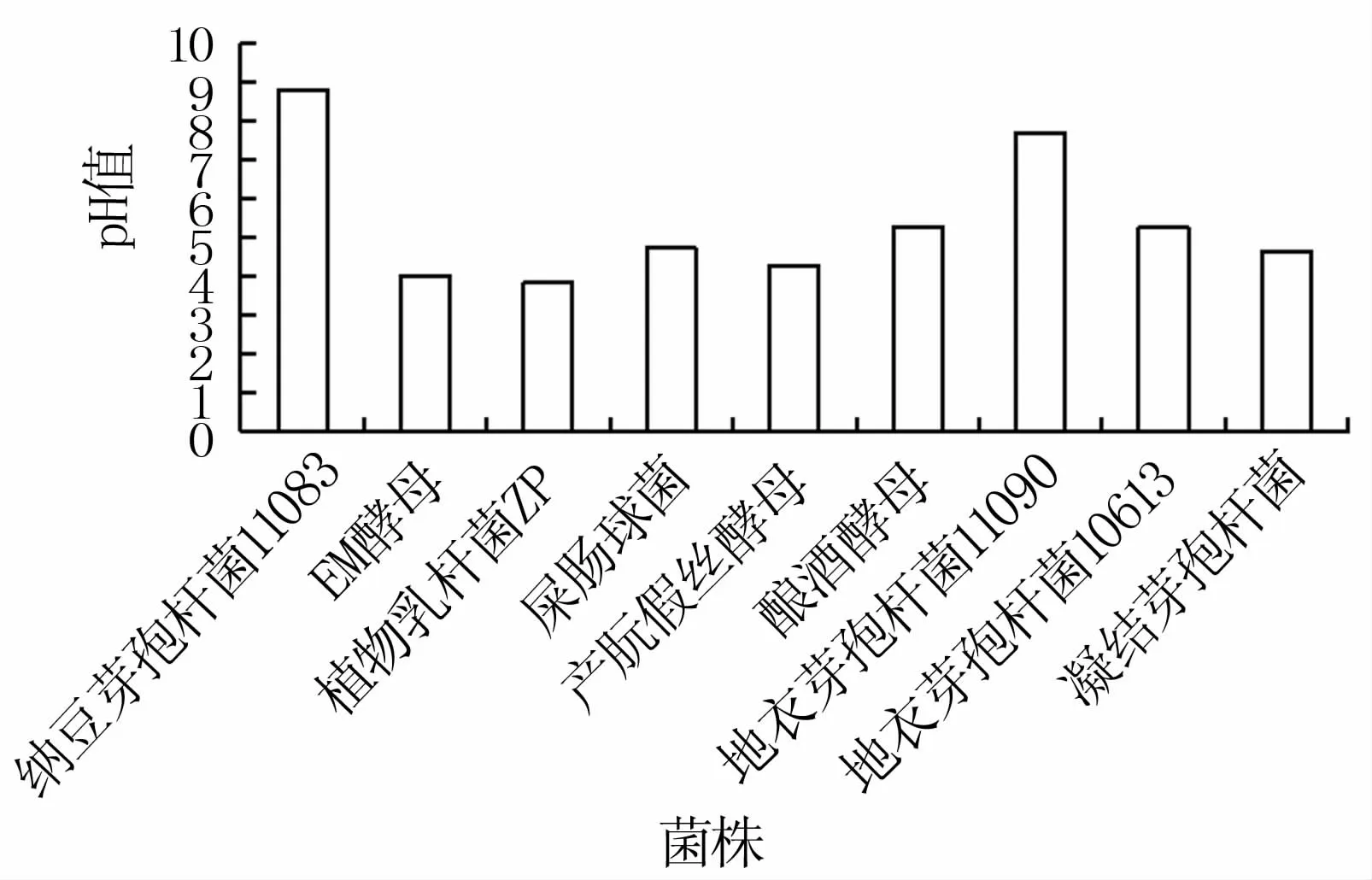
图1 发酵液pH值
2.1.2 抑菌试验 由表1可知,凝结芽孢杆菌、纳豆芽孢杆菌、植物乳杆菌ZP、屎肠球菌及产朊假丝酵母对3株病原菌均具有抑制性,其中凝结芽孢杆菌和植物乳杆菌ZP对3株病原菌的抑菌效果较优。
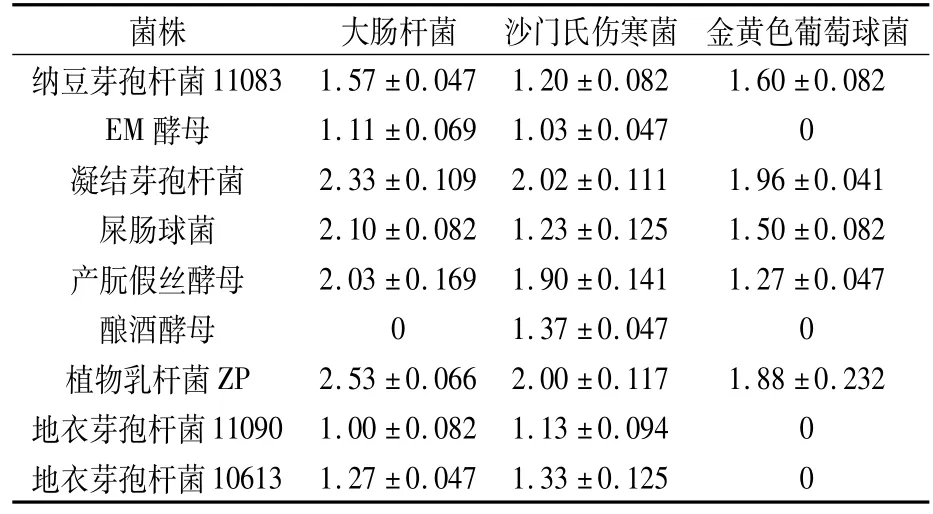
表1 菌株抑菌圈直径 (cm)
2.1.3 产酶性能检测 由表2和图2可知,纳豆芽孢杆菌11083、地衣芽孢杆菌10613、地衣芽孢杆菌11090均具有蛋白酶、淀粉酶和纤维素酶活性,综合比较地衣芽孢杆菌10613的产酶性能优于其它菌株。

表2 菌株酶活检测 (cm)
2.1.4 耐受能力试验 EM酵母和凝结芽孢杆菌对人工胃液和人工肠液均具有良好的耐受能力,除屎肠球菌在人工胃液中不耐受外,其它菌株对人工胃液和人工肠液均有一定耐受性(图3)。
综上评价结果,凝结芽孢杆菌、地衣芽孢杆菌10613 、植物乳杆菌ZP及EM酵母表现出一定的优势,后续以该4株菌进行混菌复配优化试验。
2.2 混菌复配优化
2.2.1 混菌复配正交试验 根据各菌株的生长特性及其发酵饲料的实用性,设计4因素3水平L9(34)的正交试验,各因素水平见表3。发酵结束后,从外观看9组发酵饲料均呈黄色,质地均匀,有清香酸味。发酵饲料总菌量最高为8.81×109cfu/g(表4),总菌量最高组各指标均显示为最优或较优,由此可见总菌量与发酵饲料的品质呈正相关性。以总菌量为依据进行正交试验,极差分析显示各因素对发酵饲料总菌量的影响为凝结芽孢杆菌>植物乳杆菌ZP>EM酵母>地衣芽孢杆菌10613(表5)。
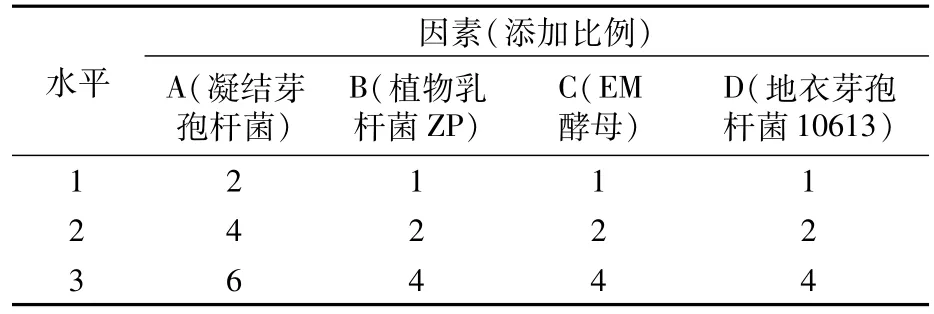
表3 混菌复配正交试验因素水平
2.2.2 正交验证试验 根据正交试验结果进行菌株复配,同时将正交试验中菌量最高组重新验证,发酵结束后进行饲料品质评价,结果见表6。A3B2C2D1组菌量达2.01×1010cfu/g,其它指标也均优于A3B3C2D1组,因此,发酵饲料混菌最佳复配比例为凝结芽孢杆菌∶植物乳杆菌ZP∶EM酵母∶地衣芽孢杆菌 10613=6∶2∶2∶1。
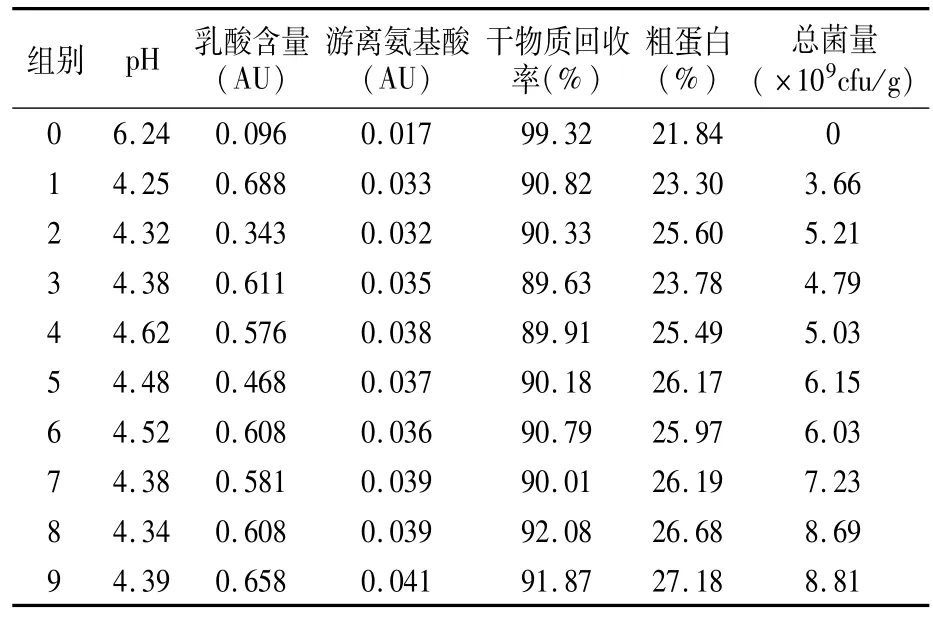
表4 混菌复配发酵结果

图2 酶活筛选试验

图3 菌株耐受能力试验结果

表5 正交试验结果分析
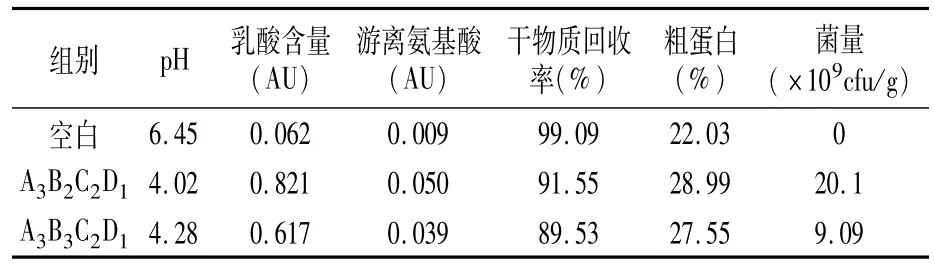
表6 正交验证试验结果
2.3 应用评价
2.3.1 猪粪菌量 猪粪中大肠杆菌和益生菌含量的变化趋势见图4。大肠杆菌数量未存在数量级差异,但饲喂混菌组的大肠杆菌数量始终低于空白组。混菌组益生菌菌量是空白组的100倍,且后期菌量有所增长,说明饲喂混菌发酵饲料后能够提高猪只体内的有益菌群数量,抑制大肠杆菌的繁殖。
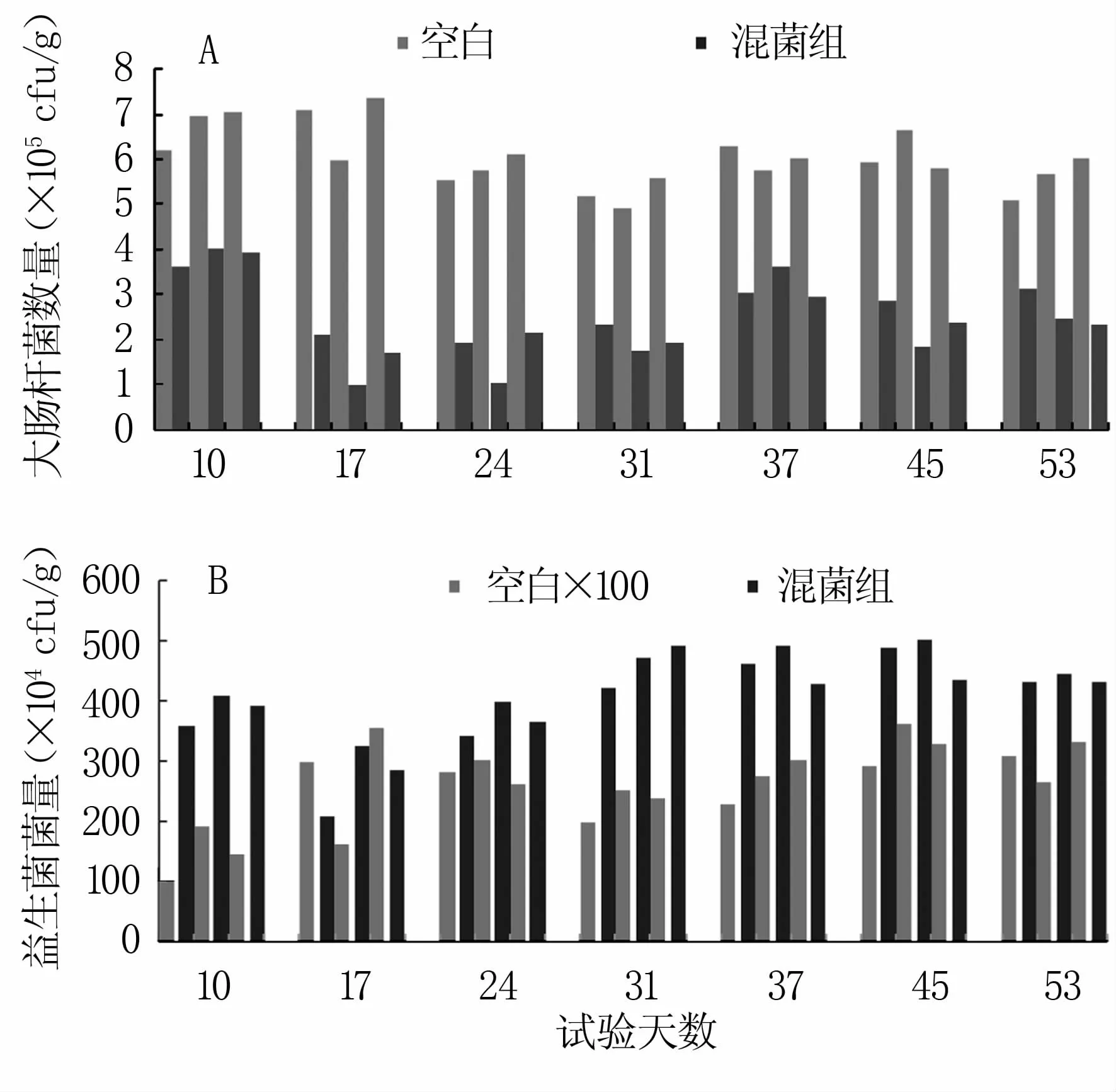
图4 猪粪菌量变化趋势
2.3.2 饲料粗蛋白表观消化率检测结果 饲喂混菌组对饲料中粗蛋白的表观消化率优于空白组,并呈递增趋势,说明发酵饲料有助于提高猪只对饲料中蛋白的消化吸收(图5)。
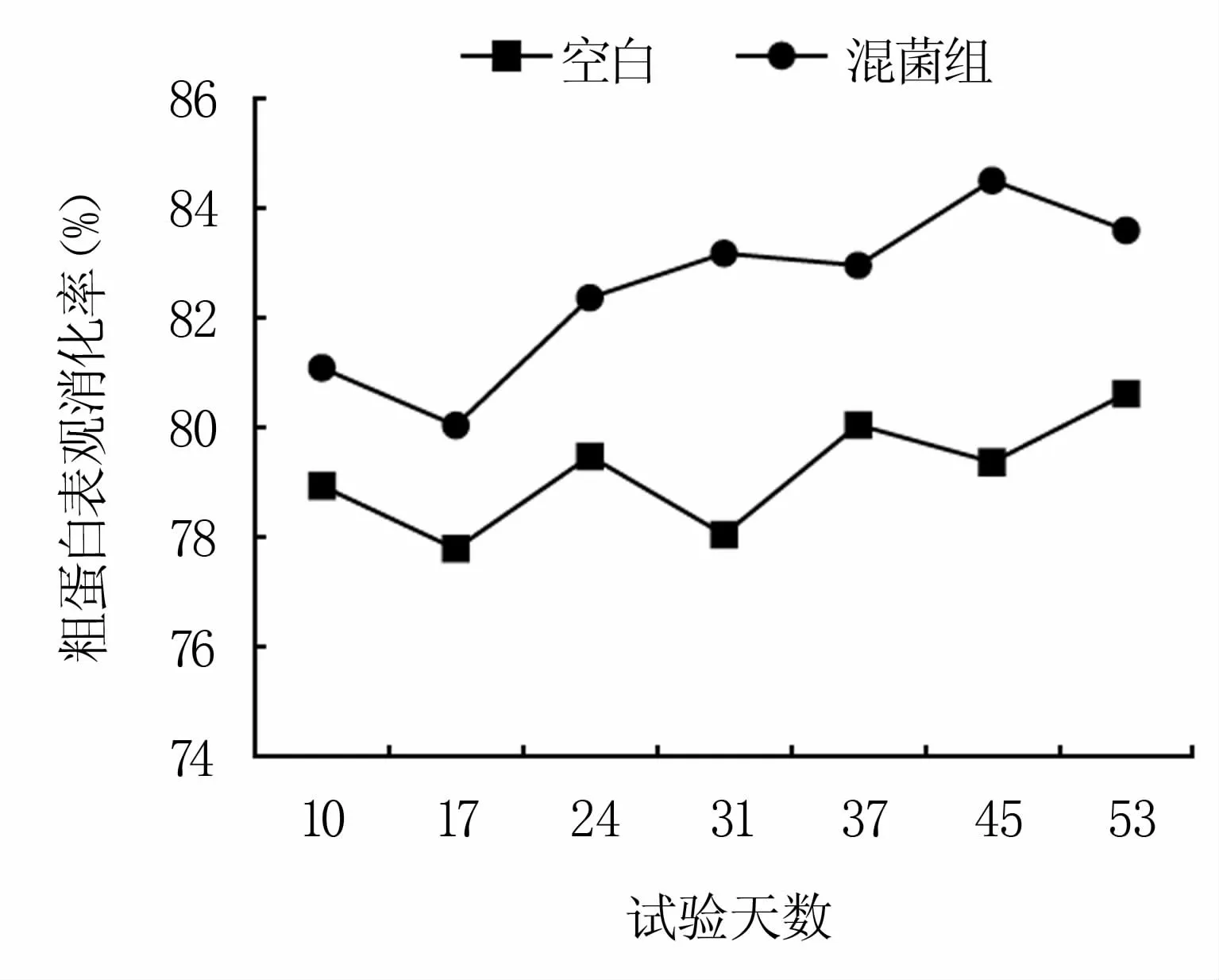
图5 粗蛋白表观消化率
2.3.3 平均日增重与料肉比检测结果 如表7所示,混菌组6头猪平均日增重的平均值为1.10 kg/d,空白组6头猪平均日增重的平均值为0.78 kg/d,混菌组较空白组提高了41.03%。混菌组料肉比的平均值为2.46,空白组料肉比为3.02(表8),混菌组较空白组降低18.54%。表明饲喂混菌发酵饲料能够促进猪只的生长,降低饲喂成本。

表7 增重结果
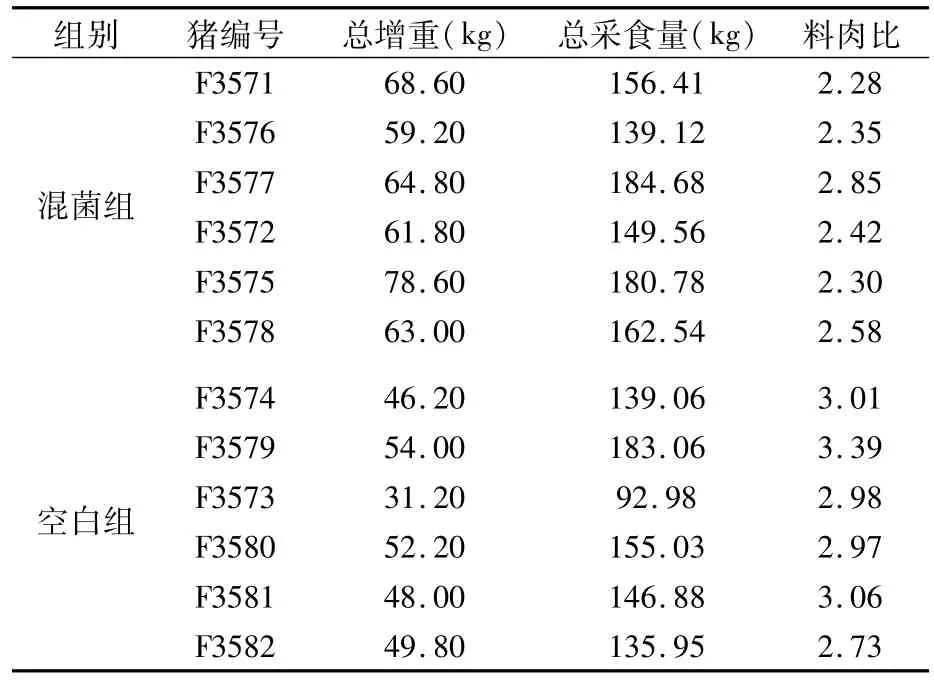
表8 料肉比结果
3 讨论与结论
利用益生菌进行混合连续发酵,与单菌发酵相比,可充分发挥不同菌株间的交互作用,增加饲料中益生菌数量的同时提高饲料的利用效率[19]。本试验通过菌株筛选、正交试验确定最佳混菌复配比例为凝结芽孢杆菌∶植物乳杆菌ZP∶EM 酵母∶地衣芽孢杆菌 10613=6∶2∶2∶1。混菌发酵饲料按照10%的比例加入全价料中进行饲喂,结果表明混菌发酵饲料能够增加猪只体内有益菌群数量,且对大肠杆菌有一定抑制作用;在猪粪有益菌菌量检测中均能发现发酵饲料所用的4株菌株,说明其对猪只体内的环境适应性较强;饲喂混菌发酵料可促进猪只对饲料中粗蛋白的消化吸收,猪只平均日增重较空白组提高41.03%,料肉比降低18.54%。这表明饲喂混菌发酵饲料能够明显促进猪只生长,降低饲喂成本。可见混菌发酵饲料在动物体防疾病、促生长方面起到积极的作用[20]。
