350份小麦种质的SSR遗传多样性分析
2021-01-18郑永胜王丽媛段丽丽王晖王穆穆李华王玮耿慧晶张晗李汝玉
郑永胜,王丽媛,段丽丽,王晖,王穆穆,李华,王玮,耿慧晶,张晗,李汝玉
(山东省农业科学院作物研究所,山东济南 250100)
小麦(Triticum aestivum L.)是一种适应性强且分布广泛的世界性重要粮食作物,在植物学分类上属于禾本科(Poaceae)小麦族(Triticeae)小麦属(Triticum)。小麦是我国三大粮食作物之一,在我国农业生产及国民经济中占有重要地位,其产量水平对国家粮食生产至关重要。然而,由于育种过程中选用的亲本来源较为单一,近年来小麦育成品种的产量、品质和抗性均受到一定程度限制,种质改良进展缓慢[1,2]。
简单重复序列(simple sequence repeat,SSR)是以1~6个核苷酸为重复单位的串联重复序列,是以PCR扩增技术为基础的DNA标记。SSR标记多数是共显性标记,符合孟德尔遗传定律,可以有效地区分杂合或纯合基因型,同时具有多态性高、重复性好、操作简单等优点,在遗传多样性检测等方面广泛应用[3,4]。SSR标记已广泛应用于植物遗传多样性分析,在水稻[5]、高粱[6]、甘薯[7]、大白菜[8]、菜豆[9]等作物中均有相关报道。小麦中,于明寨等[3]选用64对SSR引物对73个冬小麦亲本材料进行遗传多样性分析,结果表明本地育成品种遗传背景相似度较高;郑军等[10]通过SSR标记对山西省162份小麦品种进行遗传多样性分析,发现2000—2005年审定品种的遗传多样性最高;张彦军等[11]利用150个SSR引物分析43份不同来源的和尚头小麦种质材料,将其划分为8个组群,认为这些种质资源具有丰富的遗传多样性。本研究利用37对SSR引物对2012—2017年进行新品种保护的350份小麦种质材料进行遗传多样性分析,旨在从分子水平上为小麦品种选育、种质创新和品种鉴定提供一定科学依据。
1 材料与方法
1.1 试验材料
供试的350份小麦种质材料为2012—2017年间进行新品种保护的小麦品种,多来源于黄淮地区(表1)。
1.2 基因组DNA提取
取幼嫩叶片0.2 g,放入1.5 mL离心管中,在液氮中研碎。将DNA提取液预热到65℃,向每管中加入400μL,混匀;将离心管置于65℃金属浴或水浴锅中保温30 min后取出;向离心管中加入氯仿-异戊醇(体积比为24∶1)400μL,振荡混匀,10 000×g离心10 min;将上清液200μL转入另一只1.5 mL离心管,加入-20℃预冷无水乙醇400μL沉淀DNA,再10 000×g离心1 min,弃上清,加入乙醇-乙酸铵溶液500μL,6 000×g离心5 min收集沉淀。加入TE溶液(pH 8.0)100 μL溶解DNA,通过Nanodrop 2000分光光度计测定浓度与OD260/OD280值,检测DNA纯度;用1%琼脂糖凝胶电泳评估DNA完整性,-20℃保存。

表1 供试的350份小麦种质资源

表1 (续)
1.3 SSR引物合成与梯度PCR扩增
PCR反应所使用的SSR引物根据课题组前期筛选结果[12],利用2%的琼脂糖凝胶电泳进行初步筛选,并从中筛选出扩增条带清晰、可重复、多态性好且均匀分布于小麦21对染色体上的37对引物用于本研究。引物序列由生工生物工程(上海)股份有限公司合成。本研究所用PCR反应体系及梯度PCR扩增反应程序参考段丽丽等[8]的试验方法。
1.4 荧光毛细管电泳检测
在37对引物的5′端加入6-FAM(蓝色)、HEX(绿色)、TAMRA(黑色)和 ROX(红色)中的一种荧光标记,6-FAM和HEX荧光标记的PCR产物分别稀释30倍,TAMRA和ROX荧光标记的PCR产物分别稀释10倍,然后分别取等体积的上述4种稀释液进行混合,随后使用ABI 3730 XL型DNA分析仪进行毛细管电泳检测。
1.5 数据统计与分析
用 GeneMapper软 件 (https://www.thermofisher.com/)对毛细管电泳检测结果进行图像分析和数据采集,无效等位变异记录为0/0。利用PowerMarker V3.25[13]软件分析每对引物扩增条带结果,计算每对引物的等位基因数(number of alleles,A)、主要等位基因频率(major allele frquency,M)、基因多样性指数(gene diversity index,GDI)和多态性信息含量(polymorphic information content,PIC),计算 Nei氏遗传距离;采用邻近法(neighbor joining,NJ)进行遗传聚类分析,绘制聚类树状图。
2 结果与分析
2.1 SSR标记的遗传多样性分析
利用37对SSR引物对350份小麦种质进行扩增,共检测到288个等位基因变异。由表2可以看出,每对SSR引物检测的等位基因数差异较大,变异范围为2~14个,平均每对引物检测到7.784个等位基因,其中有10对引物扩增出10个及以上的等位基因。37对引物的主要等位基因频率相差较大,引物xgwm445的主要等位基因频率最大,为0.849;引物barc4的主要等位基因频率最小,为0.309;所有引物的主要等位基因频率平均值为0.481。37对SSR引物的基因多样性指数分布范围为0.268~0.807,平均值为0.653,引物cfd76的最大,xgwm445的最小。多态性信息含量(PIC)是用来衡量遗传标记座位多态性信息量的指标,37对 SSR位点的平均 PIC值为0.608,变幅为0.250~0.785,引物cfd76的最高,xgwm445的最低。综上所述,供试350份小麦种质材料的遗传多样性较高。
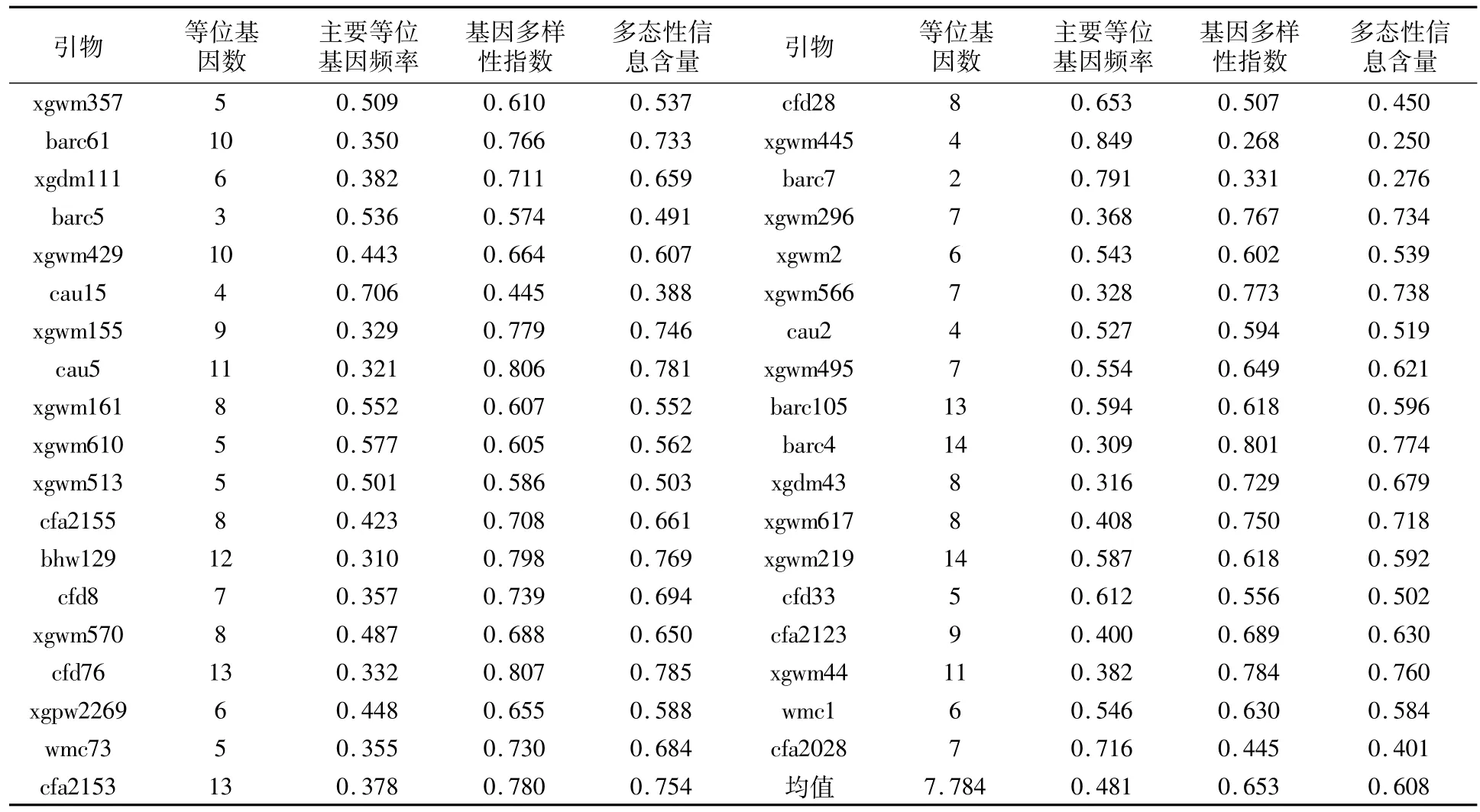
表2 37对SSR引物的多态性信息
2.2 350份小麦种质的遗传距离分析
遗传距离指不同的种群或种之间基因差异的程度,是用来衡量物种之间或同一物种不同群体之间遗传分化的指标。本研究中350份小麦种质间的Nei氏遗传距离在0~0.957之间,平均值为0.649,表明多数小麦种质间遗传差异较大,亲缘关系相对较远。在350份小麦种质两两间遗传距离比较中发现,‘轮选526’与‘郑麦369’间遗传距离最大(0.957),两者间亲缘关系最远;有6组品种间遗传距离为0,遗传相似度最高,这6组材料分别是‘百农矮抗58’与‘冀麦38’、‘济麦19’与‘中麦13’、‘九麦2号’与‘双麦998’和‘周麦16’、‘轮选496’与‘轮选 987’和‘前 A182’、‘豫麦49’与‘豫麦49-198系’、‘郑优6号’与‘周麦22号’。查询这些材料的遗传来源发现多为共同亲本或相近亲本材料选育而来,目前所选的37对分子标记不足以明显区分开这些材料,需要继续挖掘代表性标记。
2.3 350份小麦品种的系统聚类分析
使用 PowerMarker V3.25软件,根据37对SSR引物所检测的288个等位变异位点数据计算得到Nei氏遗传距离,采用NJ方法进行聚类。参试的350份小麦种质可分为4大类群,第Ⅰ类(红色分支)包括33份种质,第Ⅱ类(蓝色)包括83份种质,第Ⅲ类(绿色)包括76份种质,第Ⅳ类(紫色)包括158份种质(图1)。
根据遗传背景来看,亲缘关系相同或相近的材料遗传相似系数较高,在聚类图中也明显聚在一起。如第Ⅰ类群中,‘冀麦585’和‘冀麦518’最先聚在一起,它们均由太谷核不育群体选育而来;‘石新828’和‘石新633’聚在一起,它们均由‘石新733’与其他材料杂交选育而来。第Ⅱ类群的品种多以矮败小麦轮选群体材料为亲本进行有性杂交选育而成,如共同亲本‘轮选987’‘轮选496’‘轮选9873’等。第Ⅳ类群的品种多是由‘矮抗58’‘周麦16’等亲本衍生而来,如‘郑品麦8号’‘周麦32号’‘丰德存麦1号’‘冀麦38’‘锦绣21’‘洛麦28’‘枣乡158’‘洛麦31’‘开麦22’‘周麦33号’等16个材料与‘矮抗58’聚为一支。

图1 基于SSR标记的350份小麦种质材料聚类结果
3 讨论与结论
种质资源是育种工作的基础,而遗传多样性又是种质资源创新和改良的基础,也是种质资源研究的主流[14]。研究小麦种质资源的遗传多样性,可为小麦品种选育、种质创新和品种鉴定提供理论依据,对于促进小麦育种水平的提高具有重要意义[2]。基因多样性指数和多态性信息含量是用来衡量种群遗传多样性的指标,多态性信息含量(PIC)超过0.5时,遗传位点多态性较高;低于0.25时,则遗传位点多态性程度较低。本研究所有SSR位点的PIC平均值达0.608,其中有31对引物的PIC大于0.500,占所有引物的83.8%;同时本研究中34对(91.89%)引物的基因多样性指数大于0.500。遗传距离是另一个用来衡量物种或群体之间遗传分化的指标,本研究350份小麦种质间的Nei氏遗传距离平均值为0.649,这与侯丞志等[15]的研究结果相似,但与其他研究结果相比相对较高[3,16-20]。综上所述,37对 SSR引物在350份小麦种质中的多态性位点具有很大的变化幅度,且多态性较高的位点较多;350份试验材料的遗传变异丰富,具有丰富的遗传多样性。
聚类分析是研究不同种质资源间遗传差异的重要方法,可以为杂交育种过程中的亲本选配提供参考[21]。本研究中不同来源的350份小麦种质聚为4大类,有共同亲本或由同一育种单位育成的品种亲缘关系较近,通常聚为一类;但也有一些具有相同的一个或多个亲本材料的种质材料分散在不同的类群,可能原因是杂交选育的子代品种仅继承了单一亲本的遗传信息。综合比较350份小麦种质的系谱发现,这些材料的亲本来源信息多集中于几个骨干亲本,如太谷核不育群体、‘轮选987’‘矮抗58’‘周麦16’等。在今后的小麦育种中,应选用遗传背景差异大、遗传基础宽的亲本,有利于优异性状的聚合,促进种质创新,丰富小麦品种的遗传多样性[19,22]。
