超声辅助鸡爪胶原蛋白肽处理对鸡胸肉贮藏品质的影响
2021-01-17邹烨吴瑀婕卢方云马晶晶杨彪杨静张新笑王道营徐为民
邹烨 吴瑀婕 卢方云 马晶晶 杨彪 杨静 张新笑 王道营 徐为民



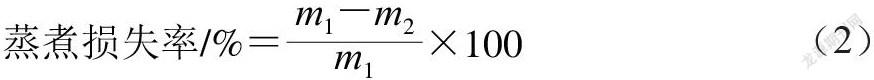

摘 要:探究4 ℃(冷鲜)与-18 ℃(冷冻)条件下超声辅助鸡爪胶原蛋白肽处理对鸡胸肉贮藏品质的影响。设置未处理、去离子水浸泡、超声辅助去离子水浸泡、鸡爪胶原蛋白肽溶液浸泡、超声辅助鸡爪胶原蛋白肽溶液浸泡5 个处理组,研究4、-18 ℃贮藏期间鸡胸肉的品质变化,包括滴水损失率、蒸煮损失率、水分分布、质构指标和组织结构变化。结果表明:随著贮藏时间的延长,2 个贮藏温度下的鸡胸肉水分构成均发生大幅改变,4 ℃组的不易流动水向自由水大量转化,导致滴水损失率和蒸煮损失率变化的上升速率更快,-18 ℃组的水分迁移程度较小;4 ℃组鸡胸肉的保水性较差;超声处理组的质构参数得到显著改善(硬度降低、弹性增加),且对鸡胸肉色泽无显著影响。超声辅助鸡爪胶原蛋白肽处理能显著提高鸡胸肉贮藏期内的品质。
关键词:超声;鸡爪胶原蛋白肽;鸡胸肉;保水性;贮藏品质
Abstract: The effect of ultrasound-assisted chicken feet collagen peptide treatment on the quality of chicken breast meat during storage at 4 or −18 ℃ was investigated. Five groups including untreated (control), deionized water immersion, ultrasound-assisted deionized water immersion, chicken feet collagen peptide solution immersion and ultrasound-assisted chicken feet collagen peptide solution immersion were set up to study the changes in meat quality traits including drip loss, cooking loss, water distribution, texture properties and histological features during storage. The results showed that for each storage temperatures, the states of water changed significantly with storage time. At 4 ℃, a large amount of immobilized water was transformed into free water, resulting in faster increase in dip loss and cooking loss, while the extent of water mobility was small at −18 ℃. Chicken meat had poor water-holding capacity at 4 ℃. The ultrasonic-treated groups showed a significant improvement in texture parameters (decreased hardness, increased elasticity) and had no significant effect on meat color. To sum up, ultrasound-assisted chicken feet collagen peptide treatment can significantly improve the quality of chicken breast meat during storage.
Keywords: ultrasound; collagen peptide from chicken feet; chicken breast meat; water-holding capacity; storage quality
DOI:10.7506/rlyj1001-8123-20210810-199
中图分类号:TS251.9 文献标志码:A 文章编号:1001-8123(2021)12-0038-08
引文格式:
邹烨, 吴瑀婕, 卢方云, 等. 超声辅助鸡爪胶原蛋白肽处理对鸡胸肉贮藏品质的影响[J]. 肉类研究, 2021, 35(12): 38-45. DOI:10.7506/rlyj1001-8123-20210810-199. http://www.rlyj.net.cn
近年来,我国肉鸡养殖量与鸡肉总产值已居世界前列[1],但受传统饮食习惯所限,我国广大消费者偏好鸡翅、鸡腿、鸡爪及鸡内脏制品[2]。鸡胸肉富含蛋白质,且易被人体吸收利用,脂肪含量低、肌纤维紧密,炖煮易导致口感僵硬,嫩度差而不易被大部分消费者接受。随着生活水平的提高,人们对于肉制品品质也有了更高的要求,但肉品在生产、运输、贮藏过程中易造成汁液损失和肉质劣变,因此急需改善此类现象。目前市场上肉品贮藏主要包括冷鲜与冷冻2 种方式,不同贮藏温度会对肉品品质产生影响,尤其是冷冻条件下对其影响更为严重[3],因此研究鸡胸肉贮藏品质对提高我国鸡肉产品的市场竞争力具有十分重要的意义。
在营养物质补充中,由蛋白质分解得到的功能肽类成为当前研究热点[4]。功能肽类比完整的蛋白质更易被消化吸收。胶原蛋白是很多结缔组织的结构性蛋白,胶原蛋白肽是胶原蛋白的酶解产物。胶原蛋白肽中富含精氨酸和甘氨酸,这2 种氨基酸是合成肌酸的重要物质。研究发现,胶原蛋白肽可促进血液微循环,因此有利于消费者摄入蛋白质后氨基酸的运输,提高厌氧反应,因此与其他蛋白質相比,更有利于肌肉的增长[5]。邵京等[6]研究发现,冷藏成熟过程中鸡肉新鲜度和嫩度与肽含量呈显著正相关。超声波是一种绿色节能加工技术,大量研究发现,超声可辅助试剂对肉品进行腌制,以提高肉品品质。
本研究以冷鲜鸡胸肉为研究对象,基于鸡爪胶原蛋白肽具备的各项优良性质,将其配制成一定质量浓度的溶液,浸泡鸡胸肉肉块,并辅以超声波技术前处理,探究其在贮藏期间对鸡胸肉保水性、质构、肌原纤维结构变化的影响。
1 材料与方法
1.1 材料与试剂
本实验室前期经真空冷冻干燥制得的鸡爪胶原蛋白肽粉末[7];泰森冷鲜鸡胸肉,购于江苏南京钟灵街某超市。
氢氧化钠、无水碳酸钠、盐酸等(均为分析纯) 国药集团化学试剂有限公司;胃蛋白酶(猪胃黏膜,USP级,1∶30 000)、胰蛋白酶(1∶4 000)、碱性蛋白酶(200 U/mg)、复合蛋白酶(120 U/mg) 上海源叶生物科技有限公司。
1.2 仪器与设备
PTX-FA210S电子天平 福州华志科学仪器有限公司;Scientz-IID超声波细胞粉碎机 宁波新芝生物科技股份有限公司;78-1磁力加热搅拌器、HH-4数显恒温水浴锅 常州国华电器有限公司;Direct-Q3uv超纯水机 美国Millipore公司;Alpha1-2LD plus实验室型冻干机 德国Christ公司;T-25数显匀浆机 德国ZKA公司;CENTER-3094数显温度计 台湾群特公司;Meso MR23微型核磁共振仪 苏州纽曼分析仪器有限公司;TVT300XP质构仪 瑞典TexVol公司;EVO-LS10扫描电子显微镜 德国Zeisse Oberkochen公司;BX43光学显微镜 日本Olympus公司;TMS-Touch物性分析仪 美国FTC公司。
1.3 方法
1.3.1 样品前处理
将冷鲜鸡胸肉用去离子水清洗干净,切成质量约(20±1) g(大小约为40 mm×30 mm×10 mm)的块状备用。随机选取鸡胸肉,平均分为5 组,放入5 个烧杯中。分别进行以下处理:第1组为空白处理(未处理)组,用保鲜膜包裹后于4 ℃放置60 min,记为A组;第2组在去离子水中于4 ℃浸泡60 min,记为B组;第3组先超声处理5 min后置于去离子水中于4 ℃浸泡55 min,记为C组;第4组置于质量浓度0.15 g/100 mL的鸡爪胶原蛋白肽溶液中于4 ℃浸泡60 min,记为D组;第5组先超声处理5 min后置于质量浓度0.15 g/100 mL的鸡爪胶原蛋白肽溶液中于4 ℃浸泡55 min,记为E组。处理后分别取出肉块,用滤纸轻轻擦拭肉块表面可见水分,然后分别装入自封袋中,备用。
鸡爪胶原蛋白肽的制备方法[7]:称取经过预处理(脱脂和除杂)后的鸡爪5 g左右(湿质量),加入碱性蛋白酶(4 000 U/g),进行超声波(工作时间2 s、停歇时间3 s、超声总时间30 min)辅助提取,料液比1∶26(m/V)(溶液为去离子水)、超声波功率250 W、酶提时间4 h。结束后置于100 ℃水浴锅中灭酶10 min,冷却到室温。10 000 r/min离心10 min,将所得上清液冻干制成鸡爪胶原蛋白肽粉。
1.3.2 超声处理
将肉块浸于1 L烧杯中(含800 mL冰水),冰水用于避免因超声产生的温度上升对肌肉蛋白的影响。然后将烧杯置于装有碎冰的泡沫盒中,防止超声能量散发引发溶液温度变高[8],可能致肌肉蛋白变性[9]。超声波细胞破碎仪配备直径12 mm超声探头,超声探头距离肉块表面25 mm,根据前期实验优化结果,超声波工作参数选定超声功率300 W(频率20 kHz、强度15.6 W/cm2),超声总时间5 min(工作时间2 s、停歇时间3 s),当超声时间达2.5 min时,将肉块翻面并继续超声处理,以使超声能均匀作用于整个肉块。
1.3.3 冷鲜和冷冻条件下鸡胸肉放置处理
将处理好的肉块在4 ℃和-18 ℃条件下分别放置如下时间:4 ℃放置0、1、3、5、7 d;-18 ℃放置0、5、10、15、20 d。经检测,在4 ℃条件下,对照组贮藏到7 d时,菌落总数达到约6(lg(CFU/cm2)),再延长贮藏时间至9 d时,样品微生物超标,表明可对在该条件下贮藏7 d内的鸡胸肉进行研究;-18 ℃条件下仅研究贮藏20 d内鸡胸肉的品质变化。
1.3.4 滴水损失率测定
根据Jiang Jiang等[10]方法进行测定,并稍作修改。记录1.3.1节肉块的初始质量,记为m1(g)。用金属钩悬挂肉块并悬浮于100 mL离心管中,使用保鲜膜密封离心管口,离心管中的肉块底端高度均与管底保持一定距离,以预留足够的空间来沉积肉块渗出的水分。将上述离心管放置于4 ℃冰箱24 h,取出去除保鲜膜,用滤纸轻轻擦拭肉块,吸取表面水分后,再次记录肉块质量(m2,g),滴水损失率根据公式(1)计算。
1.3.5 蒸煮损失率测定
根据李婉竹等[11]的方法进行测定。将肉块用滤纸轻轻擦拭表面水分后称质量,记为m1(g),随后放入自封蒸煮袋中。使用数显温度计的探头顺着肌肉纤维方向,插入鸡胸肉肉块中心,同时将其放置于恒温水浴锅(85 ℃)中。观测过程中温度变化,直至肉块中心温度达到75 ℃后立即取出,将其放置于提前装满冰块的烧杯中冷却至室温。最后用吸水纸吸干肉块表面残余水分后,再次称质量,记为m2(g),蒸煮损失率根据公式(2)计算。
1.3.6 水分分布测定
参照Cao Minjie等[12]的方法,用台式低场核磁共振仪进行鸡胸肉水分分布的测定,稍作修改。沿鸡胸肉内部肌纤维方向切取约2 g肉样,放置于15 mm玻璃核磁共振管中(质子共振频率设定为22.6 MHz)。测定前,所有样品应在25 ℃条件下平衡30 min,低场核磁共振测定于32 ℃条件下进行,脉冲序列为CPMG,测定横向弛豫时间(T2)。测定参数设置如下:射频线圈直径25 mm,重复采样等待时间4 000 ms,回波个数15 000,回波间隔0.25 ms,重复扫描次数16,由此产生的衰减曲线由MultiExp Inv分析软件进行反演操作,每组3 次重复。4 ℃条件下贮藏7 d,1.3.1节A组和B组均未显示数据。
1.3.7 质构测定
依据巩涛硕等[13]的方法,并稍作修改。取1.3.5节蒸煮后的肉块,用直尺与手术刀沿鸡胸肉纤维方向切成20 mm×20 mm×10 mm大小的肉块。按照TPA模式测定,对不同处理条件下的肉块均进行2 次压缩分析。在室温下采用物性分析仪,测定肉块的硬度、弹性、胶黏性和咀嚼性。测试参数如下:探头型号为P/50平底柱状;测试速率120 mm/min;形变量50%;触发力5 g。每组样品平行测定7 次,取平均值。
1.3.8 超微组织结构观察
根据Shi Haibo等[14]的方法,于10.0 kV加压条件下测定。沿肌纤维方向将肉块切成大小为5 mm×5 mm×3 mm的薄片,先采用2.5%戊二醛溶液固定,再进行乙醇梯度洗脱(乙醇溶液体积分数分别为50%、70%、80%、90%、95%)并真空冷冻干燥、喷金镀膜,采用扫描电子显微镜观察组织微观结构,放大倍数为500。
1.3.9 苏木精-伊红(hematoxylin-eosin,HE)染色切片观察
将1.3.5节蒸煮后肉块切成5 mm长立方块,使用4%多聚甲醛固定,便于制备成石蜡切片,脱蜡后进行HE染色,最后进行脱水封片,经正置光学显微镜镜检,采集清晰彩色图像进行组织结构分析。
1.4 数据处理
以上实验均重复3 次,结果表示为平均值±标准差。采用SPSS 24.0软件进行单因素方差分析,组间数据差异采用Tukey检验,P<0.05表示差异显著。
2 结果与分析
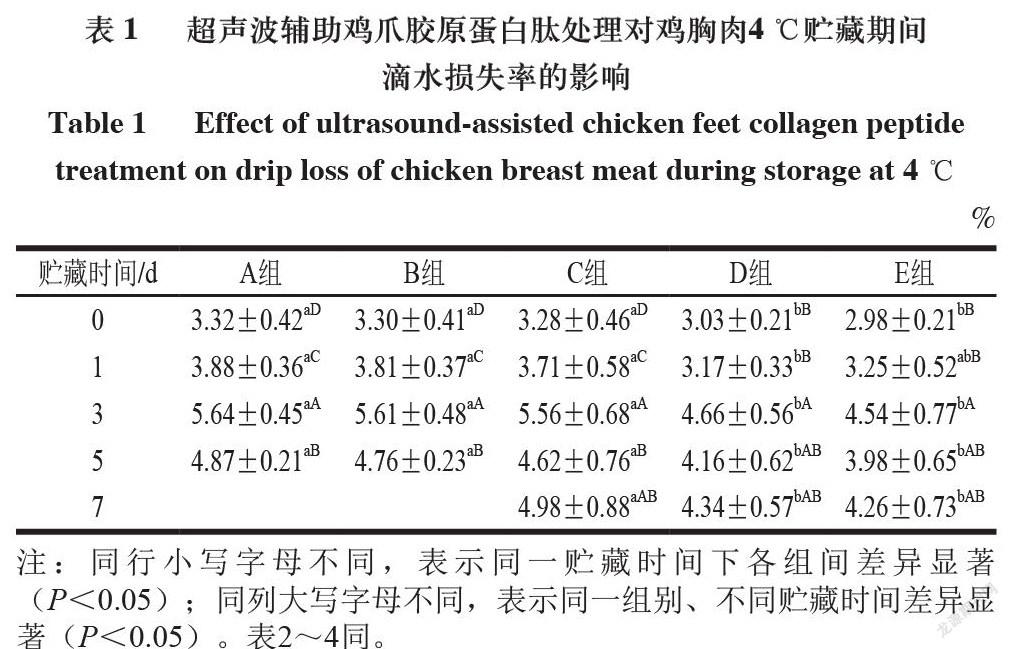
2.1 超声波辅助鸡爪胶原蛋白肽处理鸡胸肉贮藏期间滴水损失率
肉品保水性直接影响肉品经济价值与品质特性,此外,保水性也与肉品色泽、质构、嫩度密切相关[15-16]。肉品加工中,过高的水分损失可导致肉制品出品率低,且产生不良口感。研究发现,超声波处理可促进盐溶性蛋白释放,可溶性蛋白被包裹在液滴表面,形成小尺寸的乳化液滴,使更多水分被肌肉纤维捕获,减少悬挂过程中的液体损失(即滴水损失)。
由表1可知,在4 ℃贮藏条件下,肉块贮藏到3 d时,滴水损失率显著上升(P<0.05),之后有轻微下降趋势,这可能是由于肌原纤维蛋白降解程度增大,导致肌原纤维蛋白的网络结构被破坏,水分冲破障碍,从肌纤维内部向外部迁移。
由表2可知,-18 ℃贮藏5 d时,鸡胸肉滴水损失率达到最大,可能是由于冻结过程中形成的尖锐冰晶对肌纤维结构造成一定伤害,使其持水能力下降。-18 ℃条件下贮藏5 d起,鸡胸肉滴水损失率均高于4 ℃条件下贮藏的所有样品,这可能是由于-18 ℃贮藏5 d起,大量冰晶的形成导致较多细胞膜破裂,增加了样品的滴水损失[17]。在2 种贮藏温度下,随着贮藏时间延长,各组离心损失率均呈现增大趋势,这可能是由于贮藏过程中鸡胸肉中蛋白质所携带的静电荷变少,排斥力变小,所以蛋白质分子间距离缩短,从而将分布在其中的水分向外排出,使保水性降低[18]。D、E组的滴水损失率显著低于A、B、C组,主要是因为鸡爪胶原蛋白肽溶液具有一定的黏度,可引起肌肉纤维间的黏附。另一方面,胶原蛋白肽富含的甘氨酸、脯氨酸、羟脯氨酸可能还会与肌肉中的蛋白质发生非还原性交联反应,导致鸡肉在离心过程中水分不易渗出,更多的结合水或不易流动水保留在肌纤维中。超声联合鸡爪胶原蛋白肽处理可加速胶原蛋白肽渗透到鸡肉中,因此導致滴水损失降低。
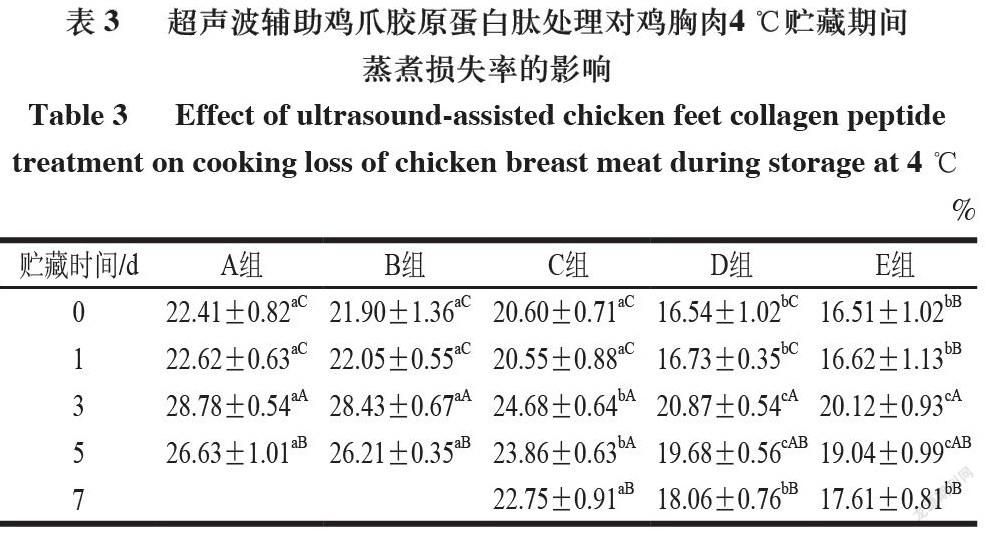
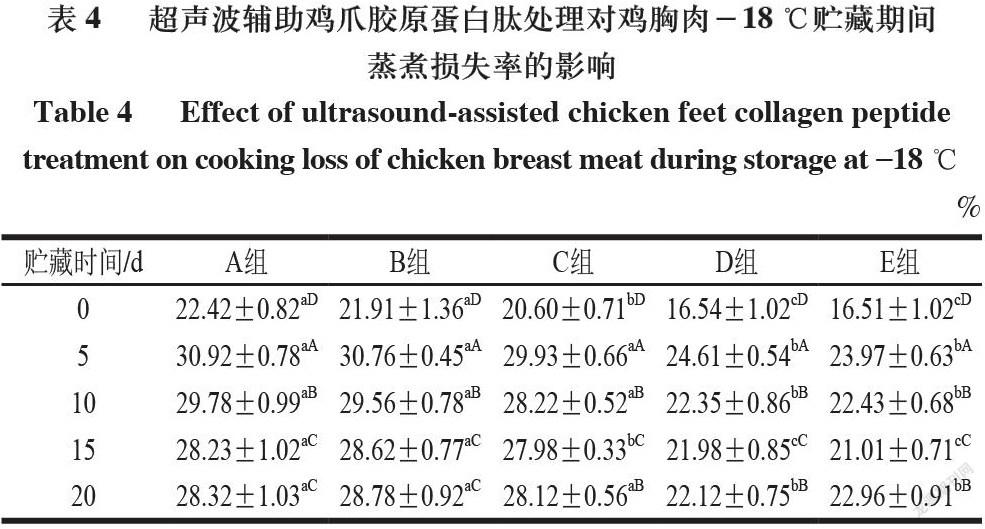
2.2 超声波辅助鸡爪胶原蛋白肽处理鸡胸肉贮藏期间蒸煮损失率
由表3~4可知,在4 ℃和-18 ℃贮藏的鸡胸肉蒸煮损失率总体趋势均随着贮藏时间的延长先增大后减小,相同贮藏时间下A和B组之间的蒸煮损失率无显著性差异,与A、B组相比,D和E组鸡肉的蒸煮损失率显著降低(P<0.05),说明胶原蛋白肽及超声联合胶原蛋白肽处理均能有效减少鸡胸肉的蒸煮损失。A和B组具有较高的蒸煮损失,这是因为其具备更完整的纤维结构,加热过程可诱导肌肉蛋白的不可逆变性[19]。E组蒸煮损失率最低可能是经过超声联合胶原蛋白肽浸泡处理后,胶原蛋白肽浸泡液较为充分地进入肌肉组织,并与其中肌肉蛋白发生反应,使得愈多水分进入肌纤维结构中。同时,渗透的胶原蛋白肽溶液在蒸煮后的肉块表面或内部可形成一层膜,让更多的水分保留在肌肉内部,从而降低蒸煮损失,提高肉品保水性[20]。
2.3 超声波辅助鸡爪胶原蛋白肽处理鸡胸肉贮藏期间水分分布
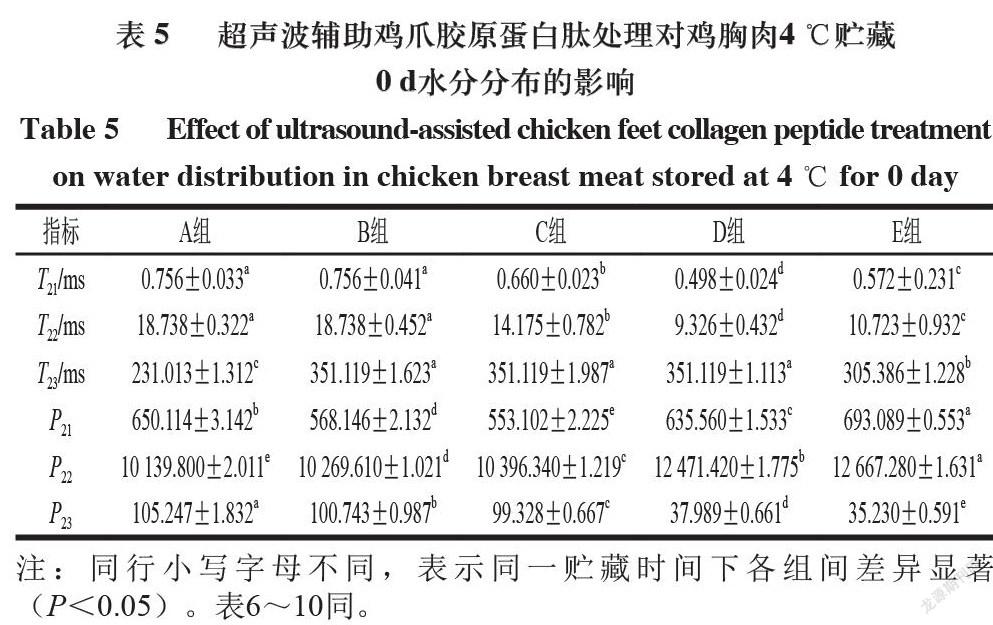
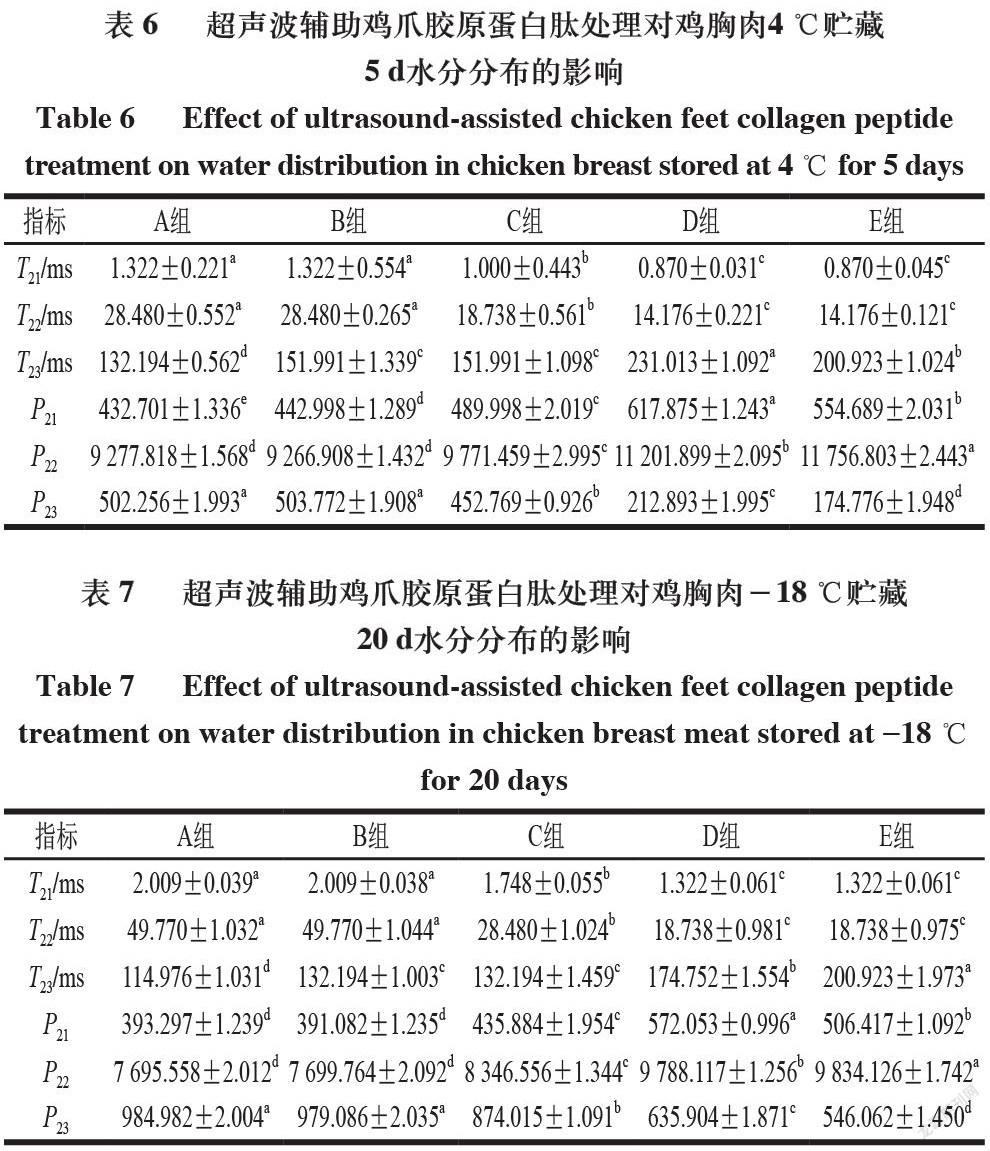
低场核磁共振技术是通过测定肉品中氢原子核位于磁场中的弛豫特性来分析肉品中的水分分布和状态[21]。依据横向弛豫时间T2的差异来确定鸡胸肉中不同状态水分的变化情况(T2越大,则表明肉品中水分自由度越高)。
4 ℃和-18 ℃贮藏期间5 个处理组鸡胸肉的水分分布及流动性由横向弛豫时间T2和峰面积(P)评估,不同贮藏温度下5 组鸡胸肉的横向弛豫时间T2图谱中均出现3 个特征峰,分别对应鸡胸肉中的结合水(T21,0~10 ms)、不易流动水(T22,10~100 ms)和自由水(T23,100~1 000 ms),这与Cheng Shasha等[22]的研究结果相一致。
由表5~7可知,4 ℃贮藏0、5 d和-18 ℃贮藏20 d条件下,随着贮藏时间的延长,5 组鸡胸肉的P22均呈明显减小趋势,P23呈明显增大趋势,这说明随贮藏时间的不断延长,各组鸡胸肉中的不易流动水向自由水转化,锁水能力逐渐减弱,即保水性变差。-18 ℃贮藏条件下,鸡胸肉的T23(自由水)低于4 ℃,这可能是由于-18 ℃下鸡胸肉在反复冷冻和解冻过程中,其结构受到低温和尖锐冰晶挤压的双重作用,引发不易流动水流出,水分组成结构发生变化,自由水含量急剧升高[23]。对比同一贮藏温度和贮藏时间下的不同组别可知,C组的P23显著小于B组,E组的P22显著大于D组,这可能是由于超声协同胶原蛋白肽溶液浸泡可增强肉块捕获水分的能力,从而提高肉品保水性[24];此外,超声处理可促进肌肉纤维溶胀,为胶原蛋白肽的渗透提供更大空间,且超声引起的可溶性蛋白渗出均可使更多水分保留在肉品纤维结构中[25]。
2.4 超声波辅助鸡爪胶原蛋白肽处理鸡胸肉贮藏期间质构特性
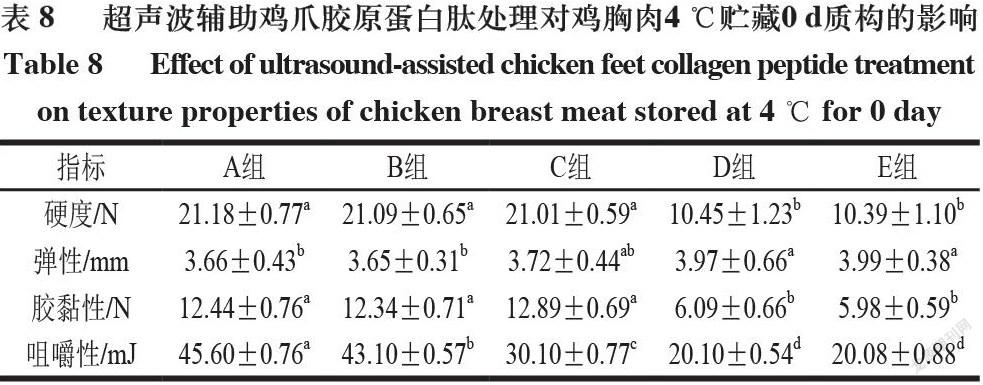
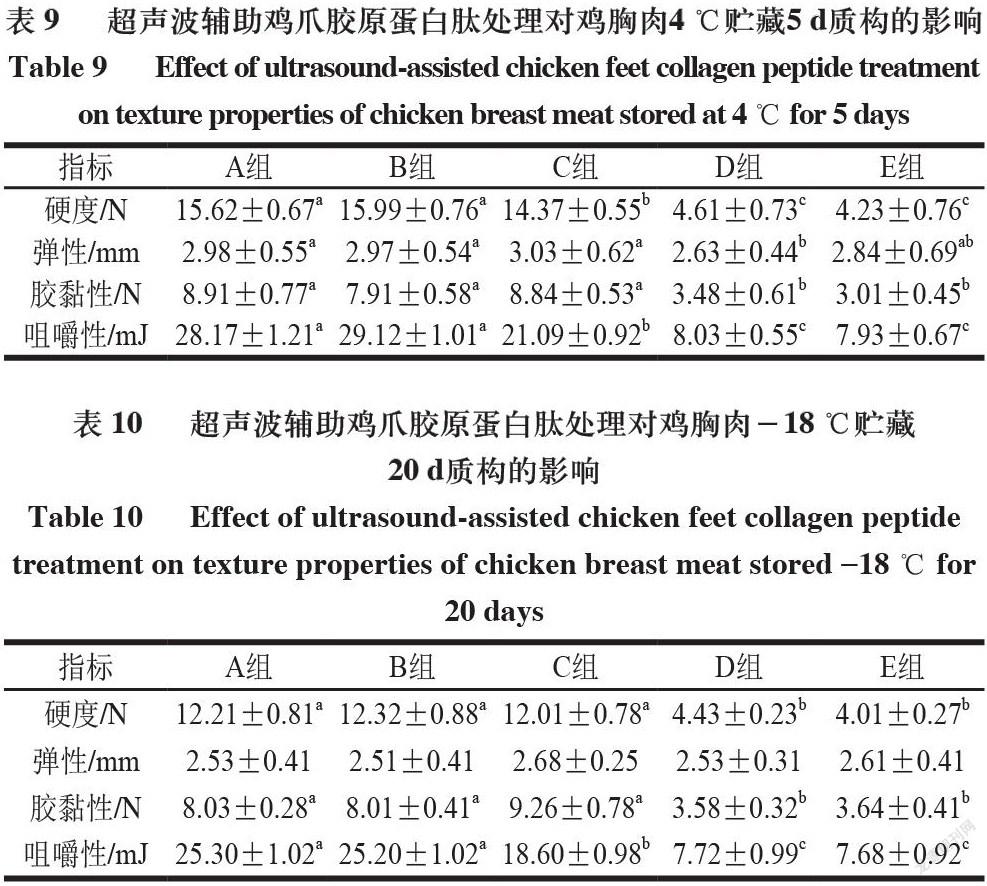
由表8~10可知,各组分别在4 ℃贮藏0、5 d和-18 ℃贮藏20 d,鸡胸肉的硬度和弹性与贮藏时间呈负相关。以上结果是由于随着贮藏时间的延长,鸡胸肉肉质逐渐变得松散,肌肉组织的完整性受到损坏。同一贮藏条件的不同组别,硬度高低排序总体为A组>B组>C组>D组>E组,弹性高低排序总体为E组>D组>C组>B组>A组,这说明经过超声辅助鸡爪胶原蛋白肽处理后的鸡胸肉呈现低硬度、高弹性的特质,且经过超声波和鸡爪胶原蛋白肽协同处理会达到显著提升的效果[26]。同一贮藏条件不同组别鸡胸肉咀嚼性,从A组到E组呈降低趋势。鸡胸肉咀嚼性的降低表明更易咀嚼,这可能是由于鸡胸肉硬度的降低,使肌肉肌丝间空隙变大,肌肉组织的空隙增大[27]。且在相同贮藏条件的不同组别中,从A组到E组咀嚼性与胶黏性均逐渐降低,说明超声辅助胶原蛋白肽处理组的食用性能更优。
2.5 超声波辅助鸡爪胶原蛋白肽处理鸡胸肉超微结构
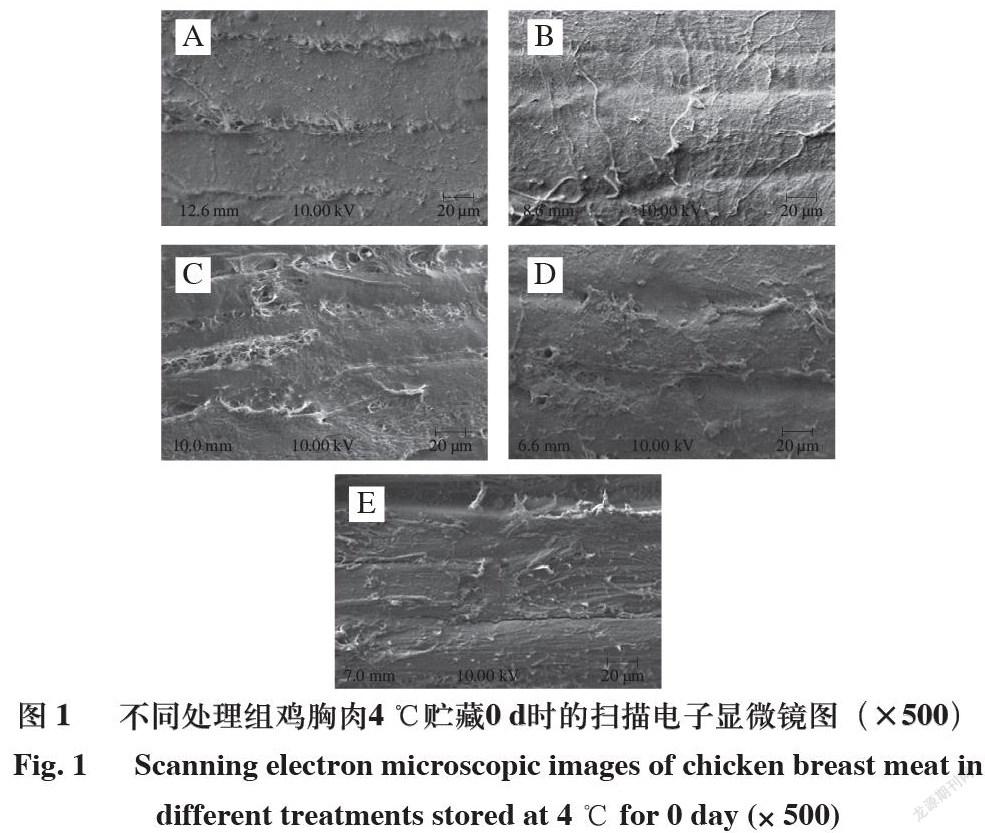
肉品微观结构与保水性和品质密切相关。由图1~3可知,在4 ℃贮藏0 、5 d和-18 ℃贮藏20 d条件下,鸡爪胶原蛋白肽可有效防止鸡胸肉的肌原纤维发生强烈降解,从而保持鸡胸肉中肌原纤维结构的完整性,对鸡胸肉品质和保水性有正面影响[28]。超声辅助鸡爪胶原蛋白肽处理可适当保持鸡胸肉肌原纤维结构的完整性,加快鸡爪胶原蛋白肽有效渗入肌肉的纤维组织,进一步在贮藏过程中有效保护肌原纤维的完整性,因此超声波处理可协同鸡爪胶原蛋白肽提高贮藏鸡胸肉的品质[29]。4 ℃贮藏0 d时,A组和B组的鸡胸肉肌原纤维排列较为整齐且完整、纤维之间基本无断层和空隙;而C、D、E组可明显观察到肌原纤维存在或多或少的破碎,且其中出现内容物溶出,有微小空隙存在。4 ℃贮藏5 d时,A、B、C组的肌原纤维破坏相对于D、E组更为严重,出现明显的块状损坏结构和丝状垂挂现象。-18 ℃贮藏20 d时,C、D、E组结构保存得更完整,可能是由于贮藏温度更低,同时胶原蛋白肽处理可保护肌原纤维蛋白结构。
2.6 超声波辅助鸡爪胶原蛋白肽处理鸡胸肉HE染色图
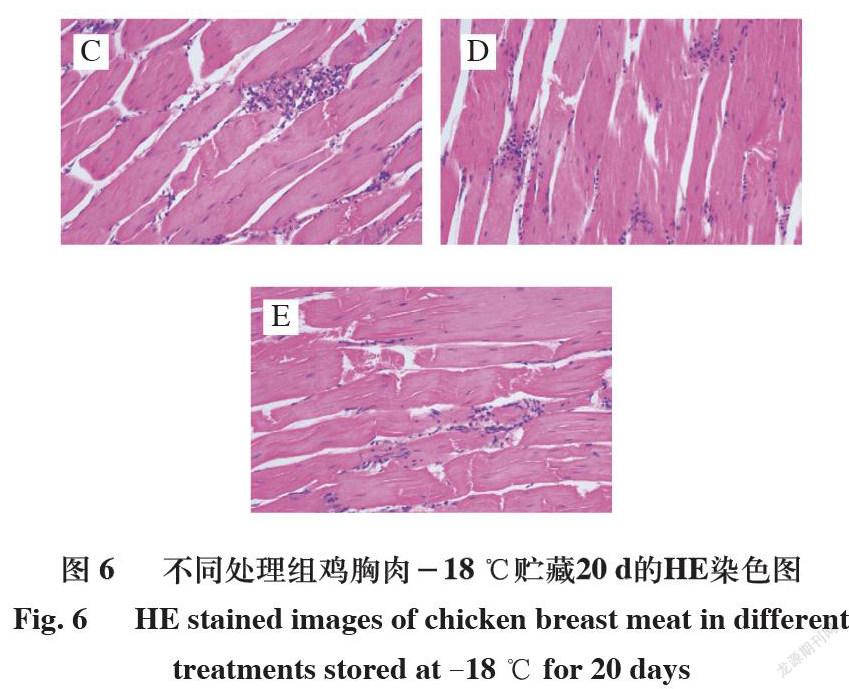
由图4~6可知,4 ℃贮藏0 d时,C组肌纤维束虽出现微小间隔,但总体紧密完整,B组伴有轻微损坏,这可能与短时浸泡于去离子水有关。和B组比较,D组有明显的组织液渗出并伴随轻微的结构腐蚀,这可能与鸡爪胶原蛋白肽浸泡液有关。其浸泡过程可能引起肌肉反应,造成肌纤维及结缔组织的破坏[30]。在4 ℃贮藏5 d和-18 ℃贮藏20 d的C、E组中,可观察到肌纤维不同程度的破坏,纤维空隙增加、内容物渗出明显,超声处理后,鸡爪胶原蛋白肽溶液更易渗透至组织间隙,使得进入组织当中的溶液增多,更多水分保留在鸡胸肉中。
3 结 论
对超声辅助鸡爪胶原蛋白肽处理对鸡胸肉贮藏品质的影响进行研究,结果表明:在2 种贮藏温度下,随贮藏时间的延长,鸡胸肉中的水分均由不易流动水逐渐向自由水迁移,水分整体流动性增强,其中4 ℃组的不易流动水向自由水大量转化,-18 ℃组的水分迁移程度较小;进一步测定不同处理组鸡胸肉的质构指标和内部组织结构特征,与其他组相比,超声处理组的质构指标得到显著改善(硬度降低、弹性增加),超声辅助鸡爪胶原蛋白肽处理可显著改善鸡胸肉品质;结合扫描电子显微镜观察和HE染色技术发现,各处理组鸡胸肉的组织结构与保水性和质构结果逐一对应。本研究结果可为后期改善肉品品质及运动健身肉品的研发提供参考。
参考文献:
[1] 张敬毅, 张莉. 2020年中国肉鸡市场分析与未来展望[J]. 农业展望, 2021, 17(1): 3-8.
[2] 王耀球, 卜坚珍, 于立梅, 等. 不同品种、不同部位对鸡肉质构特性与同位素的影响[J]. 食品安全质量检测学报, 2018, 9(1): 87-92.
[3] LI Xinran, YANG Ruiwen, JU Huapeng, et al. Identification of dominant spoilage bacteria in sea cucumber protein peptide powders (SCPPs) and methods for controlling the growth of dominant spoilage bacteria by inhibiting hygroscopicity[J]. LWT-Food Science and Technology, 2021, 136: 110355. DOI:10.1016/j.lwt.2020.110355.
[4] 李曉杰, 李富强, 朱丽萍, 等. 生物活性肽的制备与鉴定进展[J]. 齐鲁工业大学学报, 2021, 35(1): 23-28. DOI:10.16442/j.cnki.qlgydxxb.2021.01.005.
[5] KITAKAZE T, SAKAMOTO T, KITANO T, et al. The collagen derived dipeptide hydroxyprolyl-glycine promotes C2C12 myoblast differentiation and myotube hypertrophy[J]. Biochemical amd Biophysical Research Communications, 2016, 478(3): 1292-1297. DOI:10.1016/j.bbrc.2016.08.114.
[6] 邵京, 姜童誉, 赵乐涵, 等. 鸡肉冷藏成熟过程中新鲜度和嫩度与肽含量关系[J]. 肉类研究, 2020, 34(11): 58-64. DOI:10.7506/rlyj1001-8123-20200827-209.
[7] 周婷, 吴瑀婕, 卢方云, 等. 鸡膝软骨胶原蛋白肽的超声辅助酶提工艺优化及抗氧化性[J]. 肉类研究, 2021, 35(4): 7-15. DOI:10.7506/rlyj1001-8123-20210226-048.
[8] AlARCON-ROJO A D, CARRILLO-LOPEZ L M, REYES-VILLAGRANA R, et al. Ultrasound and meat quality: a review[J]. Ultrasonics Sonochemistry, 2019, 55: 369-382. DOI:10.1016/j.ultsonch.2018.09.016.
[9] KANG Dacheng, ZOU Yunhe, CHENG Yuping, et al. Effects of power ultrasound on oxidation and structure of beef proteins during curing processing[J]. Ultrasonics Sonochemistry, 2016, 33: 47-53. DOI:10.1016/j.ultsonch.2016.04.024.
[10] JIANG Jiang, TANG Xinyue, XUE Yan, et al. Dietary linseed oil supplemented with organic selenium improved the fatty acid nutritional profile, muscular selenium deposition, water retention, and tenderness of fresh pork[J]. Meat Science, 2017, 131: 99-106. DOI:10.1016/j.meatsci.2017.03.014.
[11] 李婉竹, 梁琪, 张炎, 等. 不同冻融次数下牦牛肉蛋白质氧化与保水性的关系[J]. 食品科学, 2018, 39(2): 14-19. DOI:10.7506/spkx1002-6630-201802003.
[12] CAO Minjie, CAO Ailing, WANG Jing, et al. Effect of magnetic nanoparticles plus microwave or far-infrared thawing on protein conformation changes and moisture migration of red seabream (Pagrus major) fillets[J]. Food Chemistry, 2018, 266(15): 498-507. DOI:10.1016/j.foodchem.2018.06.057.
[13] 巩涛硕, 蓝蔚青, 王蒙, 等. 不同冻结方式对金鲳鱼水分、组织结构与品质变化的影响[J]. 食品科学, 2019, 40(23): 213-219. DOI:10.7506/spkx1002-6630-20181113-149.
[14] SHI Haibo, ZHANG Xinxiao, CHEN Xiao, et al. How ultrasound combined with potassium alginate marination tenderizes old chicken breast meat: possible mechanisms from tissue to protein[J]. Food Chemistry, 2020, 328: 127144. DOI:10.1016/j.foodchem.2020.127144.
[15] 白京, 田寒友, 邹昊, 等. 不同冻结方式对冻结猪肉保水性的影响机制[J]. 食品科学, 2020, 41(11): 83-89. DOI:10.7506/spkx1002-6630-20190604-032.
[16] HUGHES J M, OISETH S K, PURSLOW P P, et al. A structural approach to understanding the interactions between colour, water-holding capacity and tenderness[J]. Meat Science, 2014, 98(3): 520-532. DOI:10.1016/j.meatsci.2014.05.022.
[17] 崔旭海, 畢海丹. 冻藏条件对草鱼鱼糜氧化劣变及其品质的影响[J]. 食品工业科技, 2015, 36(16): 333-337; 342. DOI:10.13386/j.issn1002-0306.2015.16.059.
[18] MOHAMMED H H, HE L C, NAWAZ A, et al. Effect of frozen and refrozen storage of beef and chicken meats on inoculated microorganisms and meat quality[J]. Meat Science, 2021, 175: 108453. DOI:10.1016/j.meatsci.2021.108453.
[19] NASYIRUDDIN R L, NAVICHA W B, RAMADHAN A H. Development of reduced-salt gel of silver carp meat batter using low frequency ultrasound: effect on color, texture, cooking loss and microstructure[J]. Tropical Journal of Pharmaceutical Research, 2017, 18(4): 773-780. DOI:10.4314/tjpr.v18i4.14.
[20] HE Jun, DENG Fang, PAN Daodong, et al. Investigation of the relationships between different enzymes and postmortem duck muscle tenderization[J]. Poultry Science, 2019, 98(11): 6125-6130. DOI:10.3382/ps/pez301.
[21] FAN Daming, MA Shenyan, WANG Liyun, et al. 1H NMR studies of starch water interactions during microwave heating[J]. Carbohydrate Polymers, 2013, 97(2): 406-412. DOI:10.1016/j.carbpol.2013.05.021.
[22] CHENG Shasha, WANG Xiaohui, LI Ranran, et al. Influence of multiple freeze-thaw cycles on quality characteristics of beef Semimembranous muscle: with emphasison water status and distribution by LF-NMR and MRI[J]. Meat Science, 2019, 147: 44-52. DOI:10.1016/j.meatsci.2018.08.020.
[23] LEYGONIE C, BRITZ T J, HOFFMAN L C. Impact of freezing and thawing on the quality of meat: review[J]. Meat Science, 2012, 91(2): 93-98. DOI:10.1016/j.meatsci.2012.01.013.
[24] KANG Dacheng, GAO Xueqin, GE Qingfeng, et al. Effects of ultrasound on the beef structure and water distribution during curing through protein degradation and modification[J]. Ultrasonics Sonochemistry, 2017, 38: 317-325. DOI:10.1016/j.ultsonch.2017.03.026.
[25] HONG G P, MIN S G, CHIN K B. Emulsion properties of pork myofibrillar protein in combination with microbial transglutaminase and calcium alginate under various pH conditions[J]. Meat Science, 2012, 90(1): 185-193. DOI:10.1016/j.meatsci.2011.06.023.
[26] WANG Anran, KANG Dacheng, ZHANG Wangang, et al. Changes in calpain activity, protein degradation and microstructure of beef M. semitendinosus by the application of ultrasound[J]. Food Chemistry, 2018, 245: 724-730. DOI:10.1016/j.foodchem.2017.12.003.
[27] ZHANG Yinyin, ZHANG Daojing, HUANG Yajun, et al. Effects of basic amino acid on the tenderness, water binding capacity and texture of cooked marinated chicken breast[J]. LWT-Food Science and Technology, 2020, 129: 109524. DOI:10.1016/j.lwt.2020.109524.
[28] 郭建鳳, 武英, 呼红梅, 等. 不同储存温度、时间对长白猪肌肉pH及失水率的影响[J]. 西北农业学报, 2009, 18(1): 33-36. DOI:10.3969/j.issn.1004-1389.2009.01.007.
[29] BAREKAT S, SOLTANIZADEH N. Improvement of meat tenderness by simultaneous application of high-intensity ultrasonic radiation and papain treatment[J]. Innovative Food Science and Emerging Technologies, 2016, 39: 223-229. DOI:10.1016/j.ifset.2016.12.009.
[30] CHANG Haijun, XU Xinglian, ZHOU Guanghong, et al. Effects of characteristics changes of collagen on meat physicochemical properties of beef Semitendinosus muscle during ultrasonic processing[J]. Food and Bioprocess Technology, 2012, 5(1): 285-297. DOI:10.1007/s11947-009-0269-9.
