基于高光谱成像技术的稻谷中霉菌定量检测及模型建立
2021-01-16刘纪伟张婉婷丁焱薇任秋涵FirewTafesseMamo周曰春胡秋辉丁超刘强
刘纪伟 张婉婷 丁焱薇 任秋涵 Firew Tafesse Mamo 周曰春 胡秋辉 丁超 刘强
摘要:采用可见/近红外高光谱成像技术,并结合主成分分析(principal component analysis, PCA),利用偏最小二乘回归PLSR算法,构建稻谷储藏过程中典型霉菌(黄曲霉、黑曲霉与杂色曲霉)污染的无损检测方法。结果表明:稻谷分别接种3种霉菌后,黄曲霉菌繁殖速率最快,对比霉变过程下稻谷在400~1 000 nm波段信号发现,光谱反射率随霉变时间延长关联下降,其中黑曲霉对应的光谱信号变化幅度最为明显;结合PCA结果,不同霉变阶段性下稻谷光谱信号存在差异;霉变稻谷中黄曲霉、黑曲霉与杂色曲霉含量预测模型的相关系数分别为0.77、0.76和0.81,均方根误差分别为1.15、1.19和0.95 lg(CFU/g),能够做到对3种霉菌的准确预测。该结果可以为稻谷霉变的无损预测提供技术支持和理论依据。
关键词:高光谱;稻谷;霉变;无损检测;预测模型
中图分类号:TS210.7 文献标识码:A DOI:10.16465/j.gste.cn431252ts.20210521
基金项目:国家重点研发计划课题 (2019YFC1605301);江苏省高校优势学科建设工程资助项目(PAPD);江苏省创新训练省级一般项目(202010327046Y)。
我国是稻谷生产大国,稻谷年产量占全国粮食总量的31%[1]。新鲜稻谷本身营养较为丰富,在储藏的过程中,极易受到霉菌的污染而霉变,稻谷霉变后食用品质大大降低[2]。感染产毒霉菌的稻谷还会产生一些对人体健康有害的真菌毒素,造成极大的健康隐患[3-4]。因此,研究能够快速检测出稻谷储藏过程中的霉菌污染,并对稻谷霉变程度进行有效判别的快速检测技术,在延长稻谷储藏期、保证稻谷产品质量和食用品质方面显得尤为重要。
目前,稻谷中霉菌含量的检测方法主要包括平板计数法、选择性和鉴别培养基法、荧光分析法、微生物活性测定法、分子生物学方法等[5-6]。这些稻谷中霉菌含量检测的常规方法检测准确度较高,但往往需要花费大量时间进行制样和检测,不仅无法做到对储藏稻谷霉变程度的快速检测,还会对检测样品的结构造成破坏[5]。因此,建立一种快速、无损、定量检测储藏稻谷霉变程度的检测方法,对促进稻谷安全储藏和确保消费安全具有重要意义。
高光谱成像技术是一种通过同时采集样品的2D空间信息和1D光谱信息,在获取到样品的3D光谱数据立方体后,再利用高光谱成像系统的空间像元间成分差异辨识能力和光谱分析能力,提取样品图像和光谱信息特征,将样品内外品质指标之间建立联系,实现对样品内外综合品质评价的快速、无损检测的光谱技术[7]。高光谱成像技术由于检测精度高,速度快,不仅能对样品的光谱特征进行区分,还能够对样品中的成分进行分析,现已被广泛应用于农产品中霉菌以及真菌毒素的检测。Del Fiore等[8]使用高光谱成像技术建立了一种无损检测玉米籽粒中产毒真菌的方法,结果表明,使用高光谱成像技术,可以对接种黑曲霉或黄曲霉48 h后的商品玉米籽粒与未被侵染的玉米籽粒进行有效区分。Singh等[9]建立了基于高光谱技术的小麦粒中3种真菌的判别模型,模型正确率为97.3%~100%。Jiang等[10]使用高光谱技术,建立了能够快速判别花生样品是否被真菌侵染的判别方法,正确率为87.14%。以上研究均表明,高光谱成像技术在农产品霉菌快速检测方面效果突出。上述的研究已从可行性方面证实了高光谱成像技术在粮食霉变无损检测的可行性,能否构建更加精准的霉变程度定量检测,特别是霉变含量的无损预测将推动高光谱成像技术在粮食行业中的应用。
综上,本研究聚焦稻谷产后典型霉菌生长特性,以储藏稻谷霉变过程中的霉菌含量为表征指标,通过测定不同储藏时间下霉变稻谷样本的光谱信号和霉菌含量,建立基于高光谱成像系统的储藏稻谷中黄曲霉、黑曲霉与杂色曲霉的定量预测模型,从而实现对稻谷霉变程度的快速、准确分析,为稻谷霉变的在线、快速、精确检测提供参考依据。
1 材料与方法
1.1 材料与试剂
稻谷产自宿迁(2019年京优1号稻谷,湿基水分含量(19.0±0.5)%;孟加拉红培养基(分析级)、马铃薯琼脂培养基(分析级):上海盛思生化科技有限公司;吐温-80 (分析级):阿拉丁试剂(上海)有限公司;黄曲霉(Aspergillus flavus)、黑曲霉(Aspergillus niger)、杂色曲霉(Aspergillus versicolor):广东微生物菌种保藏中心。
1.2 仪器与设备
HIS-Enir-400-1700型可见/近红外高光谱成像仪:台湾五铃光电有限公司;SW-CJ-2FD型超净工作台:苏净集团苏州安泰空气技术有限公司;GNP-9160型恒温恒湿培养箱:上海三发科学仪器有限公司;SX-700型高压蒸汽灭菌锅:上海申安医疗器械厂;HH-6型恒温水浴锅:国华电器有限公司。
1.3 方法
1.3.1 稻谷处理
将去杂与干燥后的稻谷以20 g每袋装入自封袋,置于超净工作台中紫外光辐射下消毒24 h,完成后置于无菌培养皿中隔离存放,防止交叉感染。
1.3.2 菌种活化与接种
参考杨基汉等[11]与张继忠等[12]的方法并稍作修改,具体为:选取稻谷3种典型致腐真菌:黄曲霉菌(Aspergillus flavus,GDMCC 3.493)、黑曲霉(Aspergillus niger,GDMCC 3.649)和杂色曲霉(Aspergillus versicolor,ACCC30169)作为接种对象。在稻谷霉菌接种前,对菌种进行活化,活化时间设为7 d,培养温度设为28 ℃。采用5 mL含0.03%吐温-80 (质量分数)的无菌缓冲液反复冲刷菌落表面,并重复上述步骤一次,共收集约10 mL孢子液。将离心管置于涡漩振荡器上震蕩1 min后获得分散的菌丝-孢子悬液。用3层无菌纱布过滤菌悬液,结合血球计数板进行计数,将孢子悬液的浓度调整到1×106 mL-1备用。
取1 mL孢子悬浮液,均匀地喷洒在稻谷表面,振动晃匀。每种霉菌均接种100个稻谷平板,并设置1组正常稻谷(未接菌)用以空白对照。将4组稻谷平板(黄曲霉组、黑曲霉组、杂色曲霉组和正常稻谷组)隔离存放,于温度(28±1)℃,湿度(85±5)%的条件培养10 d,以加速霉菌滋生繁殖。在贮藏10 d的过程中,每组每天随机抽取10个平板样本用以高光谱扫描及微生物菌落计数[13]。
1.3.3 高光谱成像系统
采用反射模式下可见/近红外高光谱成像设备捕捉样本高光谱信息,光谱成像范围保留400~1 000 nm有效信息,单波段图像像素为804×440。高光谱成像系统由成像系统、移动平台和卤素灯光谱与及若干光纤组成。相机镜头距离样品26 cm,两侧光源由50 W卤素灯组成,投射角度与水平呈60°夹角,光源与样品距离30 cm,光谱分辨率为2.8 nm,移动台速度5 mm/s,曝光时间2.5 ms。
1.3.4 微生物菌落数测定
参照GB 4789.15—2016《食品安全国家标准食品微生物学检验 霉菌和酵母计数》进行微生物菌落总数的测定,含量以lg (CFU/g)表示。
1.3.5 光谱图像数据处理与建模方法


预测模型采用Matlab软件中PLS-toolbox 7.5工具箱进行构建;PCA采用SPSS 18.0版软件进行分析;所有图形绘制均采用Origin 9.0软件;简单数据统计采用Excel文档进行存储。
2 结果与分析
2.1 霉菌含量与霉变程度分析
稻谷接种霉菌后,菌落总数的含量和表观形态与接种时间呈现规律性变化。不同霉菌侵染稻谷的菌落总数随霉菌接种后贮藏时间的变化如图1所示,在接种黄曲霉、黑曲霉与杂色曲霉的孢子悬浮液2 d后,稻谷3种霉菌的含量上升至3.65~4.63 lg (CFU/g),随着接种后贮藏时间的增加,稻谷上3种霉菌的含量显著上升,贮藏10 d时,稻谷上3种霉菌的含量均已超过6.92 lg (CFU/g)。稻谷霉菌含量是判断稻谷是否发生霉变以及霉变程度的重要指标之一[18],当霉菌量在3.0 lg (CFU/g)以下时,稻谷尚未发生霉变,在3.0~7.0 lg(CFU/g) 时稻谷处于霉变状态,超过7.0 lg (CFU/g)时稻谷已经发生严重霉变。稻谷接种不同霉菌孢子悬浮液2 d后,3种霉菌菌落总数均在3.65~4.63 lg (CFU/g),说明3种霉菌均已被成功接种到稻谷上,通常真菌在接种初始阶段呈现潜伏状态,随后进入发病期,对应的生长曲线呈现典型的“S”型上升[19],但此次实验中,接种不同霉菌后,3种霉菌的生长迅速进入指数期,潜伏状态基本没有,可能是因为模拟的贮藏环境,极其适合微生物快速生长。此后,随着储藏时间的延长,3种霉菌便开始快速增殖,样品霉变程度均在逐渐加重,但不同霉菌菌株的增长速率之间存在差异。相对于黑曲霉和杂色曲霉,黄曲霉在稻谷上的生长速率最快,霉变10 d后,稻谷上黄曲霉含量已上升至7.85 lg (CFU/g),显著高于黑曲霉组6.92 lg (CFU/g)(P<0.01)与杂色曲霉组7.80 lg (CFU/g)。说明在3种霉菌当中,黄曲霉侵染稻谷储藏10 d后的霉变程度高于被黑曲霉和杂色曲霉侵染的稻谷。
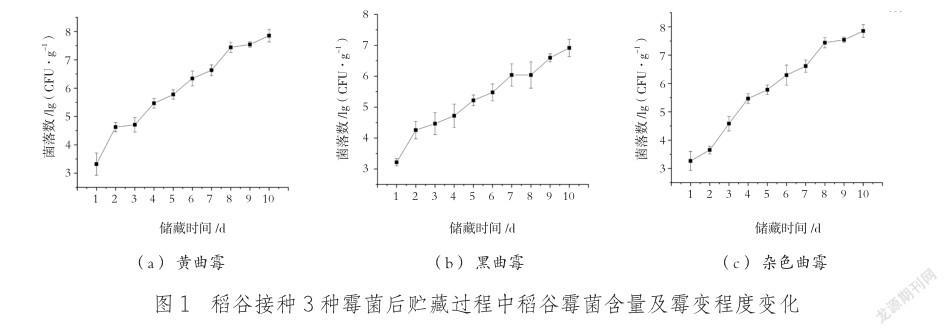
本实验还发现,随着储藏时间的延长,接种黄曲霉、黑曲霉与杂色曲霉的稻谷颜色均在逐渐加深,刘慧等[17]通过测定接种不同曲霉与青霉稻谷的色度,发现接种霉菌的稻谷其黄蓝值(b*值)上升,说明稻谷在接种霉菌后,表面颜色逐渐加深并向黄褐色转变。当储藏时间达到3 d时,稻谷表面已经开始出现肉眼可见的霉菌菌落,储藏10 d时,黄曲霉、黑曲霉、杂色曲霉的菌落几乎将稻谷表面全部覆盖,其中,接种黄曲霉的稻谷表面霉变程度最严重,这与接种不同霉菌的稻谷上霉菌菌落总数的测定结果相对应。但当储藏时间为2 d时,稻谷表面没有出现肉眼可见的霉菌菌落,而此时的菌落数测定结果均大于3.0 lg (CFU/g),说明此时稻谷已经受到了霉菌的侵染。类似研究对稻谷霉变阶段划分表明,当霉菌含量在4.0~4.78 lg (CFU/g) 时,稻谷表观色泽变化幅度有限且会产生轻微异味,可以视为轻度霉变;而当霉菌含量超过5.30 lg (CFU/g)后,稻谷已处于严重霉变,虽然能通过霉菌病斑实现判断,但此时已丧失商品价值[20]。因此,为了实现稻谷早期霉变诊断和定量判断,需要借助一些定量检测方法才能对稻谷霉菌侵染的早期霉变状况进行分析。
2.2 光谱特性分析
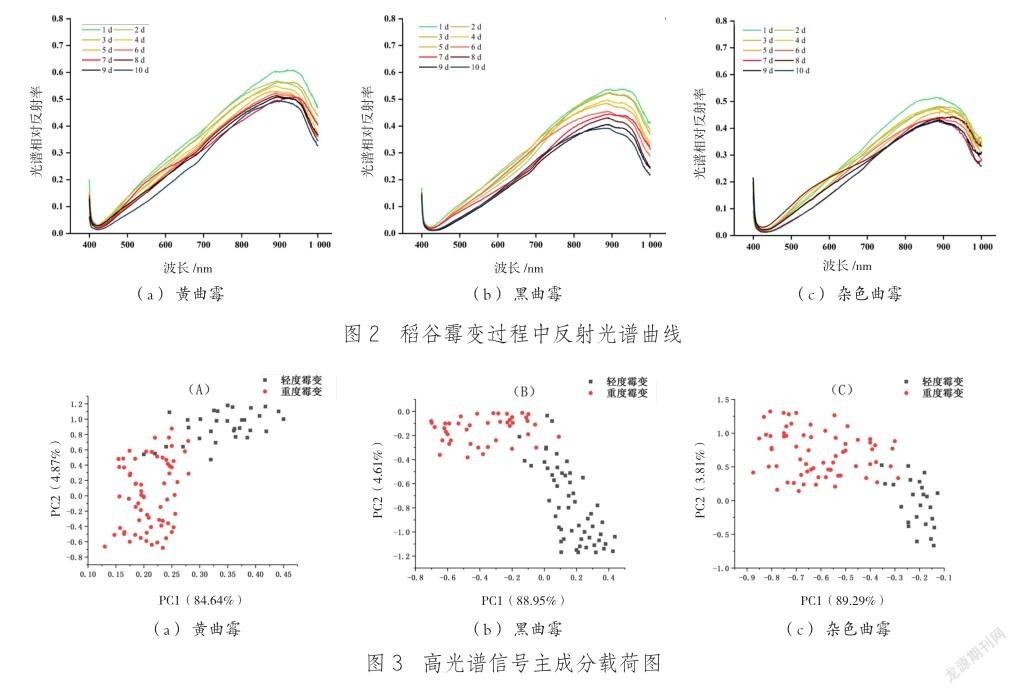
接种霉菌后的稻谷在储藏期间,霉菌的增长会引起光谱反射值的变化。图2为稻谷接种3种霉菌后,稻谷储藏不同天数后在400~1 000 nm光谱范围内的光谱响应曲线,3种不同霉菌侵染后的稻谷反射曲线具有相同的趋势,在750~900 nm波长范围内差异明显。储藏天数相同的条件下,在425~900 nm波长范围内,光谱相对反射率均呈现上升趋势,最大值出现在900 nm处,这可能与稻谷籽粒内部游离态水分含量相关[21]。从霉菌生长天数与光谱相对反射率的关系来看,不同生长天数下,3种霉菌所对应的光谱相对反射率均呈下降趋势,这是因为在霉变早期,由于霉菌生长速度较慢,3种霉菌在稻谷表面尚未形成明显的菌落,且早期形成的菌落呈现白色,对光产生较大的反射[22-23],随着储藏时间的增加,3种霉菌的菌丝体会在稻谷表面产生大量分生孢子,孢子的产生使得稻谷表面的颜色不断加深,降低了对光的反射,进而导致光谱相对反射率的降低[24]。其中,黑曲霉对应的光谱反射率变化幅度最为明显,说明在接种储藏的过程中,被黑曲霉侵染的稻谷前后颜色变化较大,潘磊庆等[22]采用计算机视觉对引起稻谷霉变的5种常见真菌进行检测发现,黑曲霉侵染下的稻谷霉变外观形态变化最为明显,并利用连续投影算法结合支持向量机模型对霉菌霉变程度进行了100%的准确区分,证实了不同真菌引起的稻谷霉变光谱存在差异。杂色曲霉在不同储藏天数下,光谱曲线重合度较高,说明被杂色曲霉侵染的稻谷,在储藏过程中颜色变化程度较小。虽然接种霉菌的稻谷在储藏過程中光谱特性会发生变化,但只能初步说明接种霉菌后的稻谷在储藏过程中颜色特性发生了一定变化。要想准确判断出稻谷的霉变程度,则需进一步对光谱数据进行分析与处理。
2.3 主成分分析
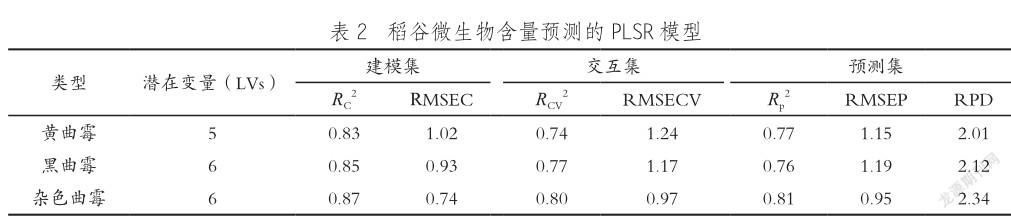
参照万立昊等[19]根据霉变携带量对储藏稻谷霉变程度的划分:轻度霉变(<5 lg (CFU/g) )和重度霉变(≥5 lg (CFU/g))。本文采用PCA对样本光谱数据进行降维和压缩,探讨稻谷各霉变类型下不同霉变程度间的差异。如图3所示,黄曲霉、黑曲霉和杂色曲霉3种霉菌的主成分1(PC1)对总体方差的贡献率分别为84.64%、88.95%和89.29%,主成分2(PC2)对总体方差的贡献率分别为4.87%、4.61%和3.81%,PC1和PC2的累计贡献率分别为89.51%、93.56%和93.1%,当选取的主成分累计贡献率超过85% 时,认为原有的绝大部分信息可以通过降维由PC1和PC2两个主成分对高光谱数据进行保留和有效区分[25],从图3可以看出黄曲霉、黑曲霉与杂色曲霉的样本间均呈现出了一定的聚类趋势。黄曲霉组重度霉变的样本主要位于轻度霉变样本的左下方,黑曲霉组重度霉变样本主要位于轻度霉变样本的左上方,杂色曲霉组重度霉变样本主要位于轻度霉变样本的左上方。3种霉菌样本中,样品之间虽没有完全分离,均有小部分样本发生重叠,但绝大多数样本仍可以被有效地区分,表明了使用高光谱成像技术,可以对稻谷在储藏过程中发生的3种霉变的程度进行有效区分[26]。
2.4 霉菌含量PLSR模型分析
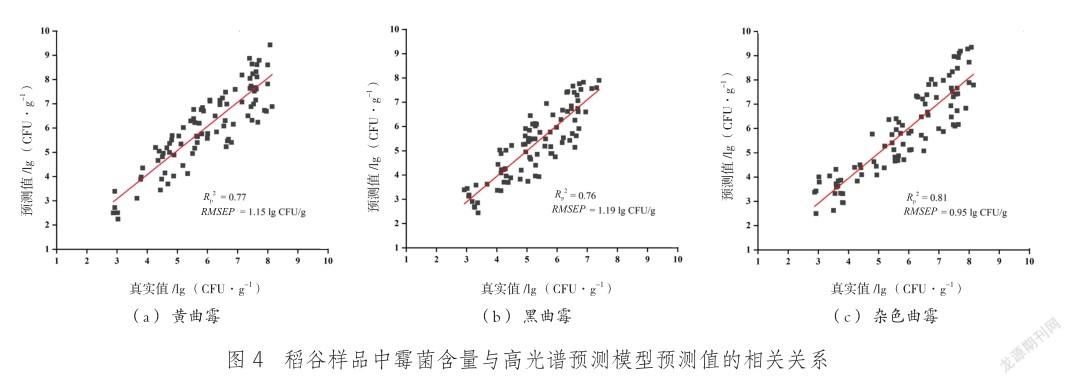
采用蒙特卡罗交叉验证(MCCV)将样本中具有较高均值和标准偏差的样本定义为奇异样本并从总体样本中剔除,将最终剩余的270份样品用于霉菌含量预测模型的建立,使用 SPXY 算法[27]将总样本按照2∶1的比例划分为建模集和预测集,建模样品霉菌含量如表1所示,黄曲霉组霉菌含量在2.93~7.95 lg (CFU/g),黑曲霉组霉菌含量在2.67~6.88 lg (CFU/g),杂色曲霉组霉菌含量在2.50~7.95 lg (CFU/g),3种霉菌样本霉菌含量的变化范围较大,有利于建立稳定的预测模型。使用SNV对原始光谱数据进行预处理,消除在采集过程中由光源强度分布不均匀、摄像头暗电流的存在,以及稻谷自身形状的不规则性等产生的噪声和干扰[28],建立稻谷霉变过程中霉菌含量的PLSR预测模型,采用Rp2和RMSEP两个指标对模型的效果进行评价,建模结果如表 2 所示。

由表2可知,黄曲霉组预测集Rp2为0.77,RMSEP为1.15 lg (CFU/g),黑曲霉组预测集Rp2为0.76,RMSEP为1.19 lg (CFU/g),杂色曲霉组预测集Rp2为0.81,RMSEP为0.95 lg (CFU/g)。通常,拥有较大Rp2值和较小RMSEP值的模型其模型性能较优[29],本实验建立的PLSR模型在3种曲霉样本中对杂色曲霉的预测效果优于黄曲霉和黑曲霉。刘鹏等[29]建立了基于近红外光谱技术的花生中黄曲霉、寄生曲霉与赭曲霉的PLSR模型,模型的Rp2值为0.874,与本实验结果相近;类似的,田容才等[30]建立了基于高光谱技术的不同气候生态型籼稻糙米粗蛋白含量的PLSR模型,发现在不同波长下建立的PLSR模型的Rp2均在0.8以上,RMSE值均小于0.6%。
以霉变稻谷中霉菌含量的真实值为横坐标,模型预测值为纵坐标作图,可以直观地看到稻谷样品中菌落总数与高光谱预测模型预测值的相关关系,结果如图4所示。图形的斜率与截距可以用来评判线性模型的预测效果,当斜率接近于1,截距接近于0時,模型线性相关性高[31]。图4中3种霉菌预测模型的回归曲线斜率和截距均接近于1和0,且所有样品都分布于中心线两侧,说明模型预测值与真实值之间相关度较高。所以使用高光谱技术结合PLSR模型可以对稻谷中的霉菌含量进行定量检测,并对稻谷霉变状况进行判别。
3 结论
本实验通过对接种了单一霉菌的稻谷进行培养,模拟稻谷在储藏过程中受霉菌侵染的过程,利用稻谷不同霉变时期的高光谱检测数据,研究高光谱技术用于霉变稻谷中黄曲霉、黑曲霉和杂色曲霉含量检测模型的构建,并得到以下结论:
(1) 稻谷接种霉菌后,霉菌菌落总数随着接种后储藏时间的增加,含量显著上升,3种霉菌中,黄曲霉在稻谷上生长的速度最快,稻谷表面颜色随储藏时间的延长逐渐加深并向黄褐色转变。
(2) 霉变稻谷在储藏期间光谱反射值发生变化。储藏时间相同时,在425~900 nm波长范围内,光谱相对反射率呈现上升趋势,最大值出现在900 nm处,在900 nm后,呈下降趋势。不同生长天数下,3种霉菌所对应的光谱相对反射率均呈下降趋势,黑曲霉对应的光谱反射率变化幅度最为明显,杂色曲霉在不同储藏天数下,光谱曲线重合度较高。
(3) PCA结果表明:霉变稻谷3种霉菌主成分1(PC1)和主成分2(PC2)的累计贡献率分别为89.51%、93.56%和93.1%,在稻谷霉变的中期以及后期,使用高光谱技术可以对3种霉菌的霉变程度进行有效区分,霉变的早期阶段,可以将黄曲霉与黑曲霉、杂色曲霉进行区分,但无法完全区分黑曲霉与杂色曲霉。
综合上述研究结果,基于高光谱成像技术的稻谷中典型霉菌定量检测模型,可以实现对霉变稻谷中黄曲霉、黑曲霉与杂色曲霉含量的准确预测,预测效果良好。
参 考 文 献
[1]李建平, 李俊杰, 李文娟, 等.“十四五”期间我国水稻增产潜力与实现路径[J].农业经济问题,2021(07):25-37.
[2]李娜, 周红丽, 周涛, 等. 稻谷中霉菌的危害及其毒素检测与防控研究进展[J]. 粮食与油脂, 2020, 33(5): 7-9.
[3]李娜, 周红丽, 张兵, 等. 稻谷霉菌的分离鉴定及其对稻谷品质的影响研究[J]. 中国粮油学报, 2020, 35(12): 115-124.
[4] CONG S L, SUN J, MAO H P, et al. Non-destructive detection for mold colonies in rice based on hyperspectra and GWOSVR[J]. Journal of The Science of Food and Agriculture, 2018, 98(4): 1453-1459.
[5]MCMULLIN D, MIZAIKOFF B, KRSKA R. Advancements in IR spectroscopic approaches for the determination of fungal derived contaminations in food crops[J]. Analytical and Bioanalytical Chemistry, 2015, 407(3): 653-600.
[6]周玉庭, 任佳丽, 张紫莺. 粮食中霉菌污染检测方法现状及发展趋势[J]. 食品安全质量检测学报, 2016, 7(1): 244-250.
[7]高泽东, 郝群, 刘宇, 等. 高光谱成像与应用技术发展[J]. 计测技术, 2019, 39(4): 24-34.
[8] DEL FIORE A, REVERBERI M, RICELLI A, et al. Early detection of toxigenic fungi on maize by hyperspectral imaging analysis[J]. International Journal of Food Microbiology, 2010, 144(1): 64-71.
[9] SINGH C B, JAYAS D S, PALIWAL J, et al. Fungal damage detection in wheat using short-wave near-infrared hyperspectral and digital colour imaging[J]. International Journal of Food Properties, 2012, 15(1): 11-24.
[10] JIANG J B, QIAO X J, HE R Y. Use of near-infrared hyperspectral images to identify moldy peanuts[J]. Journal of Food Engineering, 2016, 169: 284-290.
[11]杨基汉, 张瑞, 王璐, 等. 高湿条件下温度对储藏稻谷水分和脂肪酸值的影响研究[J]. 粮食储藏, 2011, 40(1): 45-47.
[12]张继忠, 王薇. 抗菌防霉试验中标准霉菌的讨论与部分条件因素的比较[J]. 工业微生物, 2018, 48(1): 49-53.
[13]付消费, 宋伟, 钱家铖, 等. 不同储藏条件对粳稻品质变化的影响研究[J]. 粮食科技与经济, 2019, 44(2): 79-87.
[14] SHETTY N, GISLUM R. Quantification of fructan concentration in grasses using NIR spectroscopy and PLSR[J]. Field Crops Research, 2011, 120(1): 31-37.
[15]楊思成, 舒在习, 曹阳. 基于高光谱成像技术的稻谷品种鉴别研究[J]. 光谱学与光谱分析, 2019, 39(10): 3273-3280.
[16]丁立, 田林亚. 单因变量偏最小二乘回归程序设计及其应用[J]. 勘察科学技术, 2015(1): 47-51.
[17]刘慧, 周建新, 方勇, 等. 优势霉菌对稻谷品质的影响[J].食品科学, 2020, 41(21): 197-203.
[18] IMPE J, POSCHET F, GEEROERD A, et al. Towards a novel class of predictive microbial growth models[J]. International Journal of Food Microbiology, 2005, 100(1/2/3): 97-105.
[19]万立昊, 渠琛玲, 薛飞, 等. 稻谷霉变程度与敏感品质变化关系研究[J]. 粮食与油脂, 2019, 32(9): 71-75.
[20] LIU Qiang, SUN Ke, PENG Jing, et al. Identification of bruise and fungi contamination in strawberries using hyperspectral imaging technology and multivariate analysis[J]. Food Analytical Methods, 2018, 11(5): 1518-1527.
[21]都立辉, 和肖营, 刘凌平, 等. 淮稻5号的真菌多样性及其储藏过程中可培养的优势真菌[J]. 中国农业科学, 2016, 49(7): 1371-1381.
[22]潘磊庆, 王振杰, 孙柯, 等. 基于计算机视觉的稻谷霉变程度检测[J]. 农业工程学报, 2017, 33(3): 272-280.
[23] SIRIPATRAWAN U, MAKINO Y. Monitoring fungal growth on brown rice grains using rapid and non-destructive hyperspectral imaging[J]. International Journal of Food Microbiology,2015, 199: 93-100.
[24]王辉, 田寒友, 李文采, 等. 基于顶空气相色谱-离子迁移谱技术的冷冻猪肉贮藏时间快速判别方法[J]. 食品科学, 2019, 40(2): 269-274.
[25]王蓓, 沈飞, 何学明, 等. 电子鼻同步检测花生霉菌及霉菌毒素[J/OL]. 食品科学. [2021-07-27]. http://kns.cnki.net/ kcms/detail/11. 2206.TS.20210524.0953.043.html.
[26] XU Q S, LIANG Y Z. Monte Carlo cross validation[J]. Chemometrics and Intelligent Laboratory Systems, 2001, 56(1): 1-11.
[27]周宏平, 胡逸磊, 姜洪喆, 等. 基于高光谱成像的油茶籽含油率检测方法研究[J]. 农业机械学报,2021,52(5):308-315.
[28]戴国新, 陈国兴, 杨万能, 等. 基于高光谱的水稻精米品质参数测量技术研究[J]. 农业大数据学报, 2019, 1(2): 51-63.
[29]劉鹏, 蒋雪松, 沈飞, 等. 近红外光谱技术的花生产毒霉菌侵染快速检测[J]. 光谱学与光谱分析, 2017, 37(5): 1397-1402.
[30]田容才, 周昆, 高志强, 等. 不同气候生态型籼稻糙米粗蛋白含量光谱估测模型研究[J/OL]. 中国粮油学报.[2021-04-16]. http://kns.cnki.net/kcms/detail/11.2864. TS.20210318.1200.014.html.
[31]沈飞, 魏颖琪, 张斌, 等. 稻谷有害霉菌侵染的近红外光谱快速检测[J]. 光谱学与光谱分析, 2018, 38(12): 3748-3752.
Quantitative Detection and Model Establishment of Mold in Rice Based on Hyperspectral Imaging Technology
Liu Jiwei1, Zhang Wanting1, Ding Yanwei1, Ren Qiuhan1, Firew Tafesse Mamo2, Zhou Yuechun3, Hu Qiuhui1, Ding Chao1, Liu Qiang1
( 1. Collaborative Innovation Center for Modern Grain Circulation and Safety, College of Food Science and Engineering, Nanjing University of Finance and Economics, Nanjing, Jiangsu 210023; 2. Bahir Dar University, Ethiopian Biotechnology Institute, Addis Ababa Ethiopia 999047; 3. Nanjing Lingshan Grain Reserve Co. Ltd., Nanjing, Jiangsu 211599 )
Abstract: The non-destructive detection method of typical molds (Aspergillus flavus, Aspergillus niger and Aspergillus versicolor) during rice storage was constructed by visible/near-infrared hyperspectral imaging technology combined with principal component analysis (PCA) and partial least squares regression PLSR algorithm, which realized the quantitative prediction of three kinds of mold contamination in rice. The results showed that the reproduction rate of Aspergillus flavus was the fastest after the rice was inoculated with three molds. Comparing with the signals of rice between 400~1 000 nm band during the mildew process, it was found that the spectral reflectance decreases with the extension of the mildew time, and the spectral signal corresponding to Aspergillus niger has the most obvious change. The results combined with the PCA showed that there were differences in rice spectral signals under different mildew stages; the correlation coefficient Rp2 of the three mold content prediction models of moldy rice were between 0.77, 0.76 and 0.81, and the root mean square error RMSEP were between 1.15, 1.19 and 0.95 lg ( CFU/g), it was possible to predicted the three types of molds accurately. The results can provide technical support and theoretical basis for the non-destructive testing of rice mildew.
Key words: hyperspectral, rice, mildew, nondestructive testing, prediction model
