植被不同退化状态下尕海湿地土壤氮含量及酶活性特征
2021-01-16徐国荣马维伟宋良翠唐艳梅周晓雷尚友贤
徐国荣,马维伟,宋良翠,唐艳梅,周晓雷,尚友贤,杨 玺
甘肃农业大学林学院, 兰州 730070
氮是植物生长必不可少的大量营养元素之一,是生态系统中最重要的限制养分,其含量高低直接影响系统初级生产力[1]。土壤中氮素循环是土壤生态系统的主要功能之一,是土壤生态学、环境生态学、农业科学等领域关注的重点[2]。土壤中的氮素通过土壤微生物的矿化作用转化为无机氮被植物吸收利用[3]。土壤酶活性作为微生物的主要指示剂,是控制氮素转化过程的重要因素,参与土壤中各种营养元素的生化过程,能很好的反映土壤微生物养分需求和化学反应过程的强度与方向[4]。相关研究表明,随着土壤有机质含量的增加,土壤酶的矿化分解作用是生态系统的主要生产力之一[5]。作为全球碳氮循环的重要组成部分,湿地生态系统在全球氮素循环中扮演重要角色[6]。因此,湿地生态系统氮储量及空间分布受到更多关注[7]。
近年来,随着全球气候变化及不合理的人类活动使得湿地生态系统植被退化严重,降低湿地生物多样性及其碳汇功能,加剧湿地退化,严重危及当地居民生产生活和畜牧业可持续发展[7]。与此同时,植被退化也可能引起高寒湿地土壤氮组分发生改变。一些对草地植被退化的研究指出植被退化改变地表覆被情况,增加土壤有机质的分解速度,导致土壤碳、氮含量降低[8]。Wen等[9]研究发现草地退化降低了土壤养分含量,改变了植物群落结构。这些研究在一定程度上揭示了土壤碳氮养分对植被退化的响应规律,但目前关于高寒湿地土壤氮素含量及酶活性在植被退化程度上的变化尚不清楚,这严重阻碍了对青藏高原高寒湿地土壤氮循环的深入研究,因此,有必要研究湿地退化过程中土壤氮组分含量及酶活性响应机制,对认识湿地土壤氮储量及分布和全球气候变化具有重要作用。
位于青藏高原东缘的尕海湿地,是青藏高原湿地的重要组成部分,在涵养水源、蓄洪防旱、调节气候、维护生物多样性等方面具有重要意义,已被列为国际重要湿地[10]。但近年来随全球气候变化及不合理人为活动干扰,导致尕海湿地面积锐减,植被退化严重[11]。进而引起土壤氮组分及酶活性发生明显改变,但目前对于该区域植被退化过程中土壤氮组分及酶活性变化特征还不清楚。因此,选择尕海的沼泽化草甸为研究对象,研究其植被不同退化状态下土壤氮含量和酶活性变化特征,探究植被退化对高寒沼泽化草甸湿地土壤氮素分布的影响,对揭示植被退化过程中土壤环境变化规律具有重要意义。
1 材料与方法
1.1 研究区概况
尕海湿地位于甘肃省甘南藏族自治州,尕海-则岔国家级自然保护区内,地理坐标33°58′12″—34°32′16″N,102°05′00″—102°47′39″E,海拔3430—4300 m,保护区内湿地面积57846 hm2,主要为河流湿地、沼泽草甸和泥炭湿地,其中沼泽化草甸51160 hm2,泥炭地10429 hm2。气候属于青藏高原带、高寒湿润气候区,年均气温1.2 ℃,无绝对无霜期,年均降水量781.8 mm,主要集中在7—9月,年蒸发量1150.5 mm。植物种类主要有乌拉苔草 (Carexmeyeriana)、唐松草(Thalictrumaquilegifolium) 、线叶蒿(Artenisiasubulata)、萎陵菜(Potentillachinensis)、珠芽蓼(PolygonumviviparumL.)、蕨麻(PotentillaanserinaL.)等[12]。
从20世纪50年代左右开始,受全球气候变化的影响,该地区气温显著上升,而降雨量下降,平均每十年温度升高0.4℃,降雨量下降2 mm[13],湿地开始向疏干方向发展,湿地面积萎缩[14]。近几十年来,在人口不断增长及社会和经济活动的影响下,过度放牧成为植被退化的主要影响因素之一[8]。过度放牧导致植被严重丧失,触发沼泽化草甸植被退化,靠近高山湖泊的地区受到的影响最为明显。团队先前报道中发现,沿湿度递减存在明显的植被退化梯度,优势种从湿生植物向中生和旱生植物转变[15],植被盖度、高度、地上生物量、土壤有机质、全磷和全钾含量减少,土壤容重增加(表1和表2)。

表1 样地基本情况
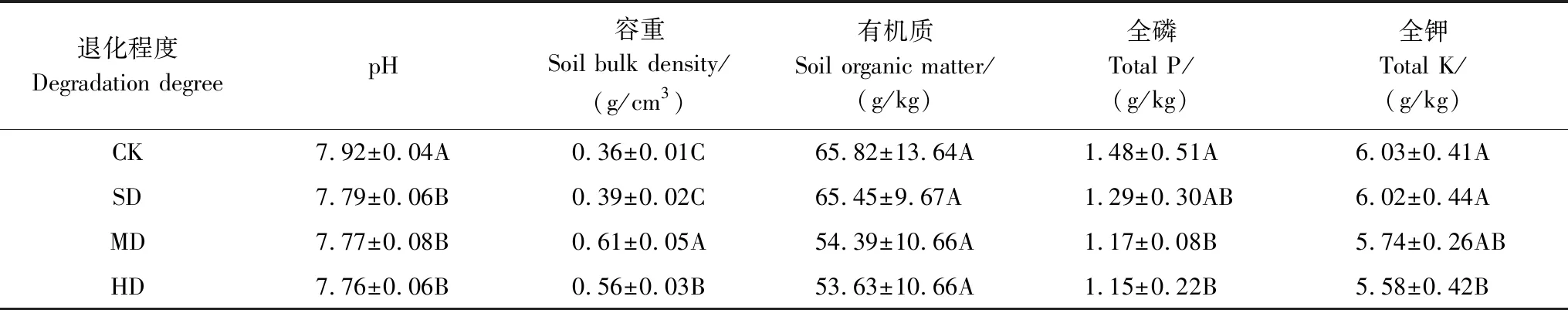
表2 样地土壤理化性质
1.2 样地设置
2019年,在本团队研究工作的基础上,采用空间序列代替时间序列方法,以现在生长季可见的原生湿地为中心向外延伸的办法,选择地势相对平缓坡向一致的地段,参考马玉寿等[16]对高寒沼泽化草甸湿地植被退化等级的划分,根据植被组成、总覆盖度、地表裸露面积等特征,将沼泽化草甸湿地划分为未退化(Non-degraded, CK)、轻度退化(Slightly degraded, SD)、中度退化(Moderately degraded, MD)和重度退化(Severely degraded, HD)4种植被退化梯度,每个植被退化梯度布设10 m×10 m定位研究样地,重复3次,重复之间间隔大于10 m,并围栏以防止人畜对研究区的干扰,样地已于2015年设置,详细的样地理化性质见团队先前报道[15,17],样地情况见表1和表2。
1.3 样品采集
土壤采样于2019年8月中旬植被生长旺季在上述4个植被退化梯度样地内进行,用土钻在研究样地分别按“S”五点法,分0—10 cm、10—20 cm和20—40 cm层取样,相同土层土壤组成混合土样,去掉植物残根和石块等杂物,装入封口袋内,每个土样三次重复,放置在装有冰袋的整理箱中低温运输。
将土壤样品从野外带回实验室后,一部分用于土壤含水量和微生物量的测定,另一部分平摊于塑料布上,置于干净整洁的室内通风处自然风干,严禁暴晒。风干过程中要经常翻动土样。样品风干后,过1 mm筛,封袋储存用于氮组分及酶活性指标的测定。
1.4 室内分析
1.5 数据统计与分析
本文利用Origin 2019绘图,SPSS 20.0软件进行数据统计分析。考虑不同退化程度、土层及二者的交互作用对土壤氮含量及酶活性的差异,采用双因素方差分析(Two-way ANOVA)进行分析比较。采用单因素方差分析(One-way ANOVA)和多重比较(LSD)分析不同退化程度各变量的差异显著性(α=0.05)。用Pearson相关分析法描述各因子之间的相关关系。
2 结果与分析
2.1 植被不同退化状态下土壤温度和含水量变化特征
不同植被退化程度尕海湿地土壤含水量和温度变化如表3所示。土壤含水量随退化程度的加剧逐渐减小,SD、MD和HD较CK分别降低33%、56%和68%,在0—20 cm层不同退化程度间差异显著(P<0.05);在垂直剖面上,土壤含水量随土层加深逐渐降低。0—40 cm土壤温度均值随退化程度加剧呈先减小后增大的趋势,CK、MD和HD较SD分别增加0.3%、5.2%和7.7%;在垂直剖面上,土壤温度随土层加深逐渐降低。
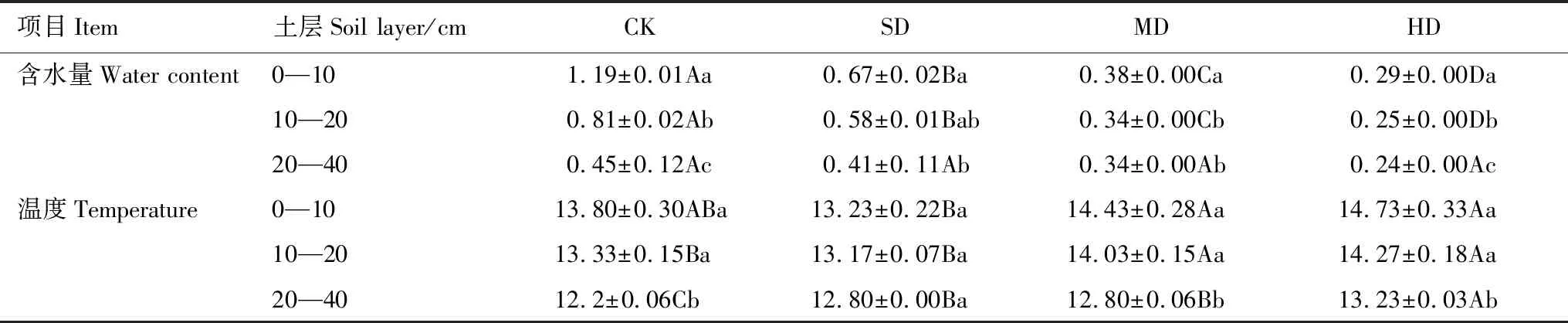
表3 土壤含水量和温度变化
2.2 植被不同退化状态下土壤氮组分含量分布特征
不同植被退化程度尕海湿地土壤TN分布情况如图1所示。各退化程度0—40 cm土层TN含量均值总体为CK(3.20 g/kg)>SD(2.87 g/kg)>MD(2.29 g/kg)>HD(2.02 g/kg)。而在不同土层存在一定差异,最高值出现在CK样地,具体为具体为4.24 g/kg、3.15 g/kg和2.70 g/kg;在0—10 cm和10—20 cm不同退化程度土壤TN含量变化相同,最低值出现在HD样地,值分别为2.16 g/kg和1.96 g/kg;而在20—40 cm土壤,最低值出现在MD样地,值为1.83 g/kg。从土层分布来看,除HD样地外,其他各退化阶段TN含量均随土层深度的增加而显著降低(P<0.05)。因此,植被退化显著降低了土壤0—20 cm的TN含量,而重度退化改变了TN的剖面分布。
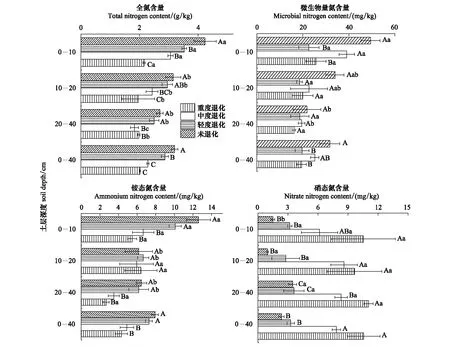
图1 不同退化程度土壤氮组分含量Fig.1 Soil carbon and nitrogen content at different degradation levelsCK:未退化 Non-degraded;SD:轻度退化 Slightly degraded;MD:中度退化 Moderately degraded;HD:重度退化 Severely degraded;不同大写字母表示不同退化程度间差异显著(P<0.05),不同小写字母表示不同土层间差异显著(P<0.05)
植被退化过程中尕海湿地土壤MBN含量变化如图1所示。0—40 cm土层MBN含量均值表现为CK(31.73 mg/kg)>MD(25.18 mg/kg)>SD(19.64 mg/kg)>HD(19.47 mg/kg)。在不同土层间的变化规律与TN一致,最大值均出现在CK样地,具体为49.43 mg/kg、33..96 mg/kg和21.77 mg/kg。在0—10 cm和10—20 cm土壤MBN含量最低值出现在SD样地,值分别为22.62 mg/kg和18.56 mg/kg;在20—40 cm最低值出现在HD样地,值为16.11 mg/kg。除SD样地外,其他样地均随土层深度的增加而降低,但仅在CK和MD间差异显著(P<0.05)。


表4 植被退化和土层交互作用下土壤氮含量方差分析
2.3 植被不同退化状态下土壤酶活性分布特征
植被不同退化程度下土壤酶活性变化有一定差异性。土壤PRO活性随退化程度的加剧而降低(图2),具体表现为CK(3.98 mg g-124h-1)>SD(3.95 mg g-124h-1)>MD(3.91 mg g-124h-1)>HD(2.94 mg g-124h-1);在不同土层间土壤PRO活性变化不一致,0—10 cm和10—20 cm土层,SD、MD和HD土壤PRO活性较CK分别降低了6.30%、13.32%、15.40%和4.45%、15.59%和20.39%; 20—40 cm层,SD和MD的PRO活性较CK分别增加了6.74%和18.72%, HD阶段PRO活性较CK降低了40.25%,差异均不显著。在垂直剖面上,除MD样地外,其他退化样地土壤PRO活性均随土层深度的增加而降低,且差异显著(P<0.05)。说明植被退化降低了土壤PRO活性,重度退化改变了土壤PRO活性垂直分布。
土壤URE活性随植被退化程度的加剧呈先减小后增大的趋势(图2), 0—40 cm土层URE活性均值为HD(1.36 mg g-124h-1)>CK(1.34 mg g-124h-1)>MD(1.23 mg g-124h-1)>SD(1.12 mg g-124h-1);在 0—10 cm土层,SD、MD和HD土壤URE活性较CK分别降低了25.46%、13.68%和18.34%,差异显著(P<0.05);10—20 cm与20—40 cm层,SD和MD的URE活性较CK降低了17.33%和9.21%与12.02%和1.51%,HD的URE活性较CK增加了3.80%和16.96%,差异均不显著。不同植被退化阶段土壤URE活性垂直分布均随土层深度的加深而减小。可见,植被退化降低了土壤URE活性,重度退化增加了10—40 cm层土壤URE活性。
NR活性随退化程度加剧而增大(图2), 具体为HD(7.50 μg g-124h-1)>MD(5.10 μg g-124h-1)>SD(3.41 μg g-124h-1)>CK(2.25 μg g-124h-1)。 在0—10 cm土层,SD、MD和HD的NR活性是CK的6.9倍、6.3倍和4倍,差异显著(P<0.05);10—20 cm和20—40 cm土层的NR活性变化与各退化程度一致,且差异显著(P<0.05);不同退化阶段土壤NR活性在剖面分布也存在一定差异,CK、SD和MD阶段均随土层深度的增加而加强,与HD阶段恰好相反。说明植被退化增加了土壤NR活性,特别是10—40 cm土层NR活性。
NiR活性随退化程度的加剧呈波动性变化(图2),具体为SD(0.67 mg g-124h-1)>CK(0.63 mg g-124h-1)>HD(0.60 mg g-124h-1)>MD(0.57 mg g-124h-1)。在0—10 cm和10—20 cm层,MD和HD的NiR活性较CK降低了16.41%、28.33%和6.69%、5.14%,SD较CK增加了2.5%和11.71%;20—40 cm层,SD和HD的NiR活性较CK增加了8.18%和13.31%,MD较CK降低了4.79%。从土层分布来看,除HD外,其他各退化程度湿地土壤NiR活性均随土层深度的加深而逐渐降低。可见,轻度植被退化有益于NiR活性提高,重度退化改变了NiR的剖面分布。

图2 不同退化程度土壤酶活性Fig.2 Soil enzyme activity at different degradation levels
双因素方差分析显示,植被退化和不同土层对土壤酶活性差异显著(表5)。除PRO和NR外,植被退化和土层对土壤酶活性影响差异显著(P<0.01)。由F值来看,不同土层的PRO、URE和NiR活性大于植被退化的影响程度,说明不同土层之间酶活性差异与植被退化相比更显著。植被退化和土层对土壤NiR和NR活性存在显著的交互作用(P<0.05)。
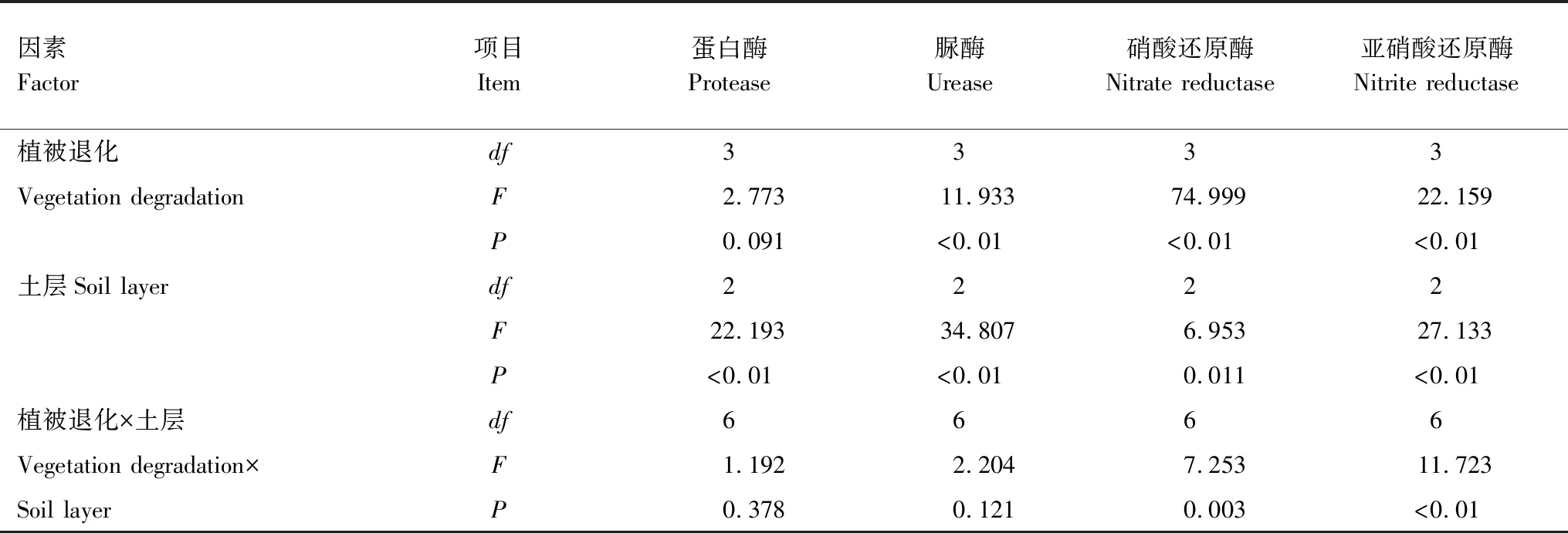
表5 植被退化和土层交互作用下土壤酶活性方差分析
2.4 土壤氮组分含量与酶活性的相关性分析
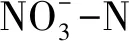
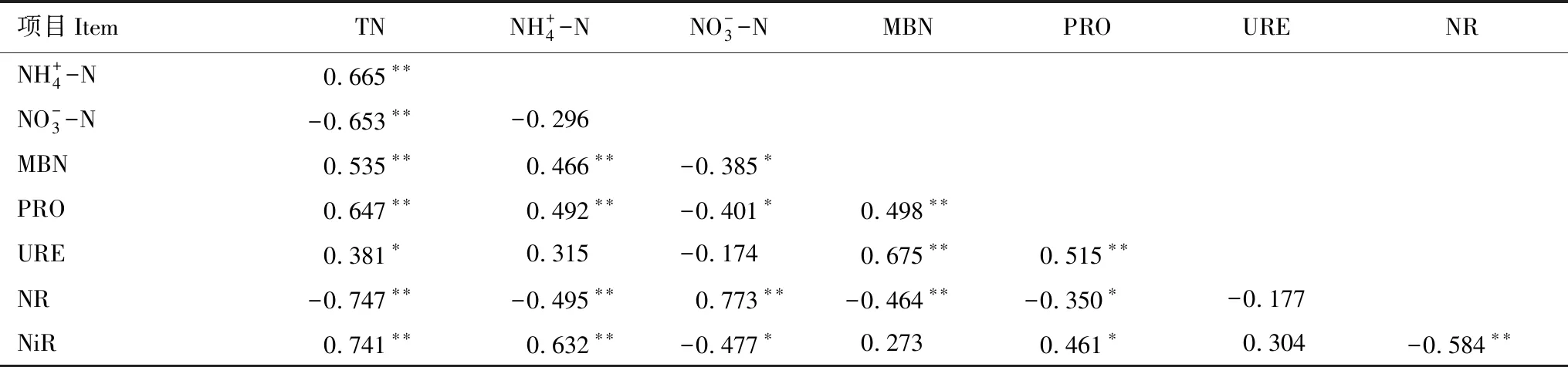
表6 土壤碳氮含量与酶活性之间的相关系数
3 讨论
3.1 植被不同退化状态下土壤氮组分含量的变化
氮是植物从土壤中获取量最大营养元素[7],所有形态的有机和无机态氮,是标志土壤氮素总量和供应植物有效氮素的源和库[21],是土壤肥力状况的重要指标[22]。植被是影响土壤物理、化学和生物学过程的主要因素之一,凋落物和植物根系分解转化是土壤有机质养分的主要来源[23]。研究表明,土壤TN含量沿退化梯度表现为随植被退化程度的加剧而降低,垂直分布呈现出随土壤深度增加而减少的趋势,这与董云霞[24]的研究结果一致。呈现这种规律可能是因为土壤TN含量易受地上枯落物和地下生物量的影响,土壤TN的累积主要来自于植物根系及枯落物的分解,植被退化减少了地上生物量的同时也减少了枯落物的累积量,所以影响土壤TN的输入速度和数量[25]。此外,随着植被退化加剧,土壤含水量和有机质含量减少,土壤容重增加,而土壤TN含量主要来源于土壤有机质的分解和转化,土壤有机质减少,土壤TN含量也随之降低[26]。

土壤微生物是土壤能量和养分转化的重要驱动力,其种群、数量和分布特征影响土壤营养物质的转化、肥力保持和植被生长[30]。微生物量是土壤营养元素的重要储备库,也是土壤中有机质最活跃的部分,调节土壤氮循环与转化过程[31]。研究结果表明,MBN含量随退化程度的加剧整体呈减小趋势,这是因为湿地植被退化后,土壤中的营养结构随之发生变化,土壤中可利用氮素及总储量随之降低,土壤微生物对氮素的转化率下降,MBN含量减少[8]。MBN含量在不同土层中的分布与TN一致,具有一定的垂直分布规律,0—10 cm植被根系比较发达,土壤通气性较强,为微生物生长繁殖提供了充足的营养物质,相比于下层土壤微生物活性较高。同时表层土壤受太阳辐射较高,土壤温度高于下层,也促进了微生物的生长繁殖。具有固氮作用的微生物和植物根瘤菌分布在土壤表层[31],也使得MBN含量随土壤层次加深而降低。
3.2 植被不同退化状态下土壤酶活性的变化
土壤酶是土壤生物化学反应的催化剂,酶活性是表征土壤质量状况的生物化学指标,反映土壤中营养元素转化能力和微生物活性,能迅速指示土壤质量变化趋势[32]。土壤PRO主要来自于微生物释放的内外蛋白酶及植物根系分泌的蛋白酶,将土壤中各类蛋白质及肽类化合物水解为氨基酸[33], PRO的活性影响植物所吸收利用氮素的多少,表征土壤供氮能力的大小[34]。研究发现,随着植被退化程度加剧,土壤PRO活性显著降低,这是由于土壤PRO活性取决于土壤养分含量[35],而在退化湿地,TN含量显著降低,使得PRO活性降低,本研究土壤TN含量和PRO活性之间极显著正相关关系(P<0.01),也证明了这一结论。在垂直剖面上,尕海湿地植物主要以草本植物为主,其根系主要分布在0—20 cm层,同时土壤表层含有大量的枯枝落叶和腐殖质,养分含量较高,为微生物的生存和发展提供良好的环境,所以随着土壤层次的加深,PRO活性降低。
土壤URE是水解土壤有机质中蛋白质和氨基酸的重要酶类,可将有机态氮转化为植物可吸收利用的无机态氮,供植物生长发育[36]。土壤URE活性受土壤水分和养分的影响,朱同彬等[37]研究表明,较高的土壤含水量会抑制土壤URE活性,与本文研究结果不同,可能是由于土壤URE活性受土壤养分的影响程度较大,造成了URE活性随退化程度的加剧而降低[37];而在HD样地,土壤养分含量较低,土壤水分对酶活性的影响占据主导地位,URE活性略有升高。同时URE活性与TN含量呈显著正相关关系,与刘淑娟等[38]研究全国大部分地区土壤URE与TN相关性结果一致。刘淑娟等研究还表明土壤TN对URE活性的影响存在一个阈值(TN为3.5 g/kg),当TN<3.5时,TN与URE活性呈正相关,当TN>3.5时,TN与URE活性呈负相关。本研究中,土壤TN含量均小于此阈值,也证明了土壤TN含量与URE活性呈显著正相关。

4 结论
基于尕海湿地沼泽化草甸不同退化状态下土壤氮组分含量及其相关酶活性的特征分析,研究了植被不同退化状态下土壤氮组分及其酶活性的变化特征,结论如下:
(2)植被不同退化状态下土壤PRO、URE和NiR活性均随退化程度的加剧而减小,NR活性随退化程度加剧而增加。