雌激素对小鼠成骨细胞MC3T3-E1氧化应激损伤的保护作用及机制探究
2021-01-16徐昊
徐昊
(武汉市第四医院,武汉 430000)
绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)是临床常见的一种女性年龄相关的系统性骨骼退行性疾病,早期无明显症状,随病情发展可表现为骨痛、驼背、局部压痛等症状,是引起老年女性骨折最常见的原因,发病率可达10%~20%[1-2]。既往研究认为,PMOP主要由于雌激素缺乏引起[3];然而近年来研究显示[4],氧化应激是PMOP的重要发病机制,活性氧(reactive oxygen species,ROS)增加可以诱导成骨细胞(osteoblast,OB)的氧化应激损伤,影响骨重建,降低骨密度,增加骨折的风险。OB是骨形成的主要功能细胞,来源于骨、骨膜、骨髓及骨外组织,可以合成并分泌多种生物活性物质,参与调节骨的形成和重建[5]。研究显示,随着绝经期妇女年龄的增加,机体的抗氧化系统功能也会降低,导致细胞内的ROS累积,可损伤成骨细胞功能,影响骨的形成[6]。雌激素是生物体重要的内源性激素,可以调节成骨细胞和破骨细胞间的平衡,对于骨的形成和骨量维持具有重要作用[7]。近年来研究显示,雌激素可以通过弱化活性氧作用,增加抗氧化酶的表达,调节破骨细胞和成骨细胞的活性,维持骨吸收和转换的平衡,但其具体的作用和机制尚不清楚[8-9]。因此,本研究探讨了雌激素对小鼠成骨细胞MC3T3-E1氧化应激损伤的保护作用,并进一步阐明了其对MC3T3-E1细胞分化能力的影响及机制,旨在为雌激素在PMOP治疗中的应用提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞
MC3T3-E1细胞由中国科学院上海生命科学研究院提供。
1.1.2 主要试剂与仪器
β-雌二醇(批号190409)购自上海广锐生物科技有限公司;α-MEM培养基(批号190615)、10%胎牛血清(批号190407)、CCK-8检测试剂盒(批号190712)购自上海经科化学科技有限公司;Annexin V-FITC/PI凋亡检测试剂盒(批号190916)和ROS荧光探针购自北京绿源伯德生物科技有限公司;JC-1荧光探针购自 Molecular Probes公司;丙二醛(malondialdehyde,MDA)(批号190410)和超氧化物歧化酶(superoxide dismutase,SOD)(批号 190326)购自南京建成生物科技有限公司;兔抗鼠Smad5、Runx2、Bax、Bcl-2、cleaved Caspase-3、β-actin 单克隆抗体和辣根过氧化酶(horseradish peroxidase,HRP)标记羊抗兔IgG均购于美国CST公司。
流式细胞仪(FACScan)购自美国FranklinLakes公司;多功能酶标检测仪(iMark680)购自Bio-Rad公司;荧光显微镜(ix71)购自日本Olympus公司。
1.2 方法
1.2.1 MC3T3-E1细胞氧化应激损伤模型的建立
将MC3T3-E1细胞培养于质量分数为10%热灭活胎牛血清的α-MEM培养液,置于37℃、5%CO2培养箱中贴壁培养,每周换2次培养液。将贴壁培养至对数生长期的细胞分为空白对照组、H2O2组(300 μmol/L)、H2O2+ 雌激素 0.1 μmol/L 组、H2O2+ 雌激素 1 μmol/L组、H2O2+ 雌激素10 μmol/L 组和H2O2+NAC 1 mmol/L组。除空白对照组加入α-MEM培养液外,其他各组细胞均加入含H2O2(终浓度为300 μmol/L)的培养液孵育3 h,诱导氧化应激损伤。处理后,采用无血清培养液洗2遍,除空白对照组和H2O2组加入α-MEM培养液外,其他各组细胞均加入含相应浓度药物的培养液继续孵育,培养24 h过夜,用于检测细胞的生物学特征。
1.2.2 CCK-8实验检测细胞的增殖
取贴壁培养24 h至对数生长期的细胞,胰酶消化后制成单细胞悬液,以3×10-4mL密度接种至96孔板,37℃、5%CO2培养箱中贴壁培养24 h后,分组与相应药物孵育,分别于24、48、72 h的细胞,弃培养液,每孔分别加入10 μL CCK-8溶液,继续培养4 h,采用酶标仪检测570 nm波长的吸光度值。
1.2.3 试剂盒检测细胞的MDA和SOD水平
取各组与相应浓度药物孵育24 h的细胞,吸去培养基,PBS洗3次后采用IP细胞裂解工作液裂解细胞,离心(10 000 rpm,10 min),取上清,硫代巴比妥酸法检测MDA;黄嘌呤氧化酶法检测SOD水平。
1.2.4 荧光探针法检测细胞的ROS水平
用无血清的α-MEM培养液稀释DCFH-DA(终浓度为10 μmol/L),装载探针。取各组与相应浓度药物孵育24 h的细胞,吸去培养基,加入DCFH-DA培养基重悬细胞,孵育20 min后,采用无血清细胞培养液洗去未进入细胞内的DCFH-DA,荧光酶标仪检测ROS水平。
1.2.5 流式细胞仪检测细胞的凋亡
取各组与相应浓度药物孵育24 h的细胞,离心(1000 rpm,5 min),弃上清,依次加入 5 μL 的AnnexinV-FITC和propidium iodide进行染色,室温避光孵育30 min,经70目的细胞筛过滤后,采用流式细胞仪分析细胞凋亡率。
1.2.6 流式细胞仪检测细胞线粒体膜电位
取各组与相应浓度药物孵育24 h的细胞,2.5%胰酶消化,离心(1000 rpm,10 min),加入1 mmol/L的 JC-1染色工作溶液 1 mL,37℃孵育30 min,JC-1缓冲液洗3次后,倒置荧光显微镜下分析荧光强度,流式细胞仪分析JC-1阳性率。
1.2.7 Western Blot检测细胞分化和凋亡相关蛋白表达
取各组与相应浓度药物孵育24 h的细胞,细胞裂解液提取总蛋白后经BCA法进行蛋白定量,SDSPAGE凝胶电泳,转膜,室温封闭2 h,加入一抗(Smad5、Runx2、Bcl-2、Bax 和 Cleaved Caspase-3,稀释比例均为1∶1000)4℃孵育过夜,以β-actin作为内参,洗膜加 HRP标记的二抗(稀释比例为1∶5000)室温孵育2 h,电化学发光显影,分析对比条带强弱。
1.3 统计学分析
采用SPSS 22.0软件对所得数据进行分析,满足正态分布计量资料均以平均值±标准差()表示,采用单因素方差分析比较组间差异性,若组间比较有差异,采用SNK-q比较两组间差异性,以P<0.05表示差异具有统计学意义。
2 结果
2.1 雌激素对MC3T3-E1细胞增殖的影响
表1结果显示,与空白对照组比较,H2O2组细胞在不同时间点的增殖活性明显下降(P<0.05);与H2O2组比较,H2O2+雌激素1 μmol/L组、H2O2+雌激素10 μmol/L组和H2O2+NAC 1 mmol/L组细胞在不同时间点的增殖活性明显升高(P<0.05)。
2.2 雌激素对MC3T3-E1细胞凋亡水平的影响
流式细胞仪检测结果显示(图1),与空白对照组比较,H2O2组细胞的凋亡率明显升高[(11.74±2.18)vs(4.85 ± 0.53),P< 0.05];与 H2O2组比较,H2O2+雌激素 1 μmol/L组、H2O2+雌激素 10 μmol/L组和H2O2+NAC 1 mmol/L组细胞的凋亡率明显下降[(8.86±0.95)、(6.71±0.72)、(6.53± 0.65)vs(11.74 ± 2.18),P< 0.05]。
2.3 雌激素对MC3T3-E1细胞线粒体膜电位的影响
流式细胞仪检测结果显示(图2),与空白对照组比较,H2O2组细胞的JC-1阳性细胞率明显增加[(9.70±1.53)vs(3.85±0.42),P< 0.05];与 H2O2组比较,H2O2+雌激素1 μmol/L组、H2O2+雌激素10μmol/L组和H2O2+NAC 1 mmol/L组JC-1阳性细胞率明显下降[(7.82±0.93)、(5.61±0.65)、(5.54±0.62)vs(9.70±1.53),P< 0.05]。
2.4 雌激素对MC3T3-E1细胞氧化应激水平的影响
表2结果显示,与空白对照组比较,H2O2组MDA和ROS水平明显升高(P<0.05),SOD活性明显下降(P<0.05);与H2O2组比较,H2O2+雌激素1 μmol/L 组、H2O2+ 雌激素 10 μmol/L 组和 H2O2+NAC 1 mmol/L组 MDA和 ROS水平明显下降(P<0.05),SOD活性明显升高(P<0.05)。
2.5 雌激素对 MC3T3-E1细胞 Smad5、Runx2、Bcl-2、Bax和cleaved Caspase-3表达的影响
图3、表3结果显示,与空白对照组比较,H2O2组细胞Smad5、Runx2和Bcl-2蛋白表达明显下降(P<0.05),Bax和cleaved Caspase-3蛋白表达明显升高(P<0.05);与 H2O2组比较,H2O2+雌激素1 μmol/L组、H2O2+ 雌激素 10 μmol/L 组和 H2O2+NAC 1 mmol/L组细胞 Smad5、Runx2和 Bcl-2蛋白表达明显升高(P<0.05),Bax和cleaved Caspase-3蛋白表达明显下降(P<0.05)。
表1 雌激素对MC3T3-E1细胞增殖的影响(n=6,)Table 1 Effect of estrogen on proliferation of MC3T3-E1 cells(n=6,)

表1 雌激素对MC3T3-E1细胞增殖的影响(n=6,)Table 1 Effect of estrogen on proliferation of MC3T3-E1 cells(n=6,)
注:与空白对照组相比,∗P<0.05;与H2O2组相比,#P<0.05。(下表同)Note.Compared with blank control group,∗P<0.05.Compared with H2O2group,#P<0.05.(The same in the following tables)
?
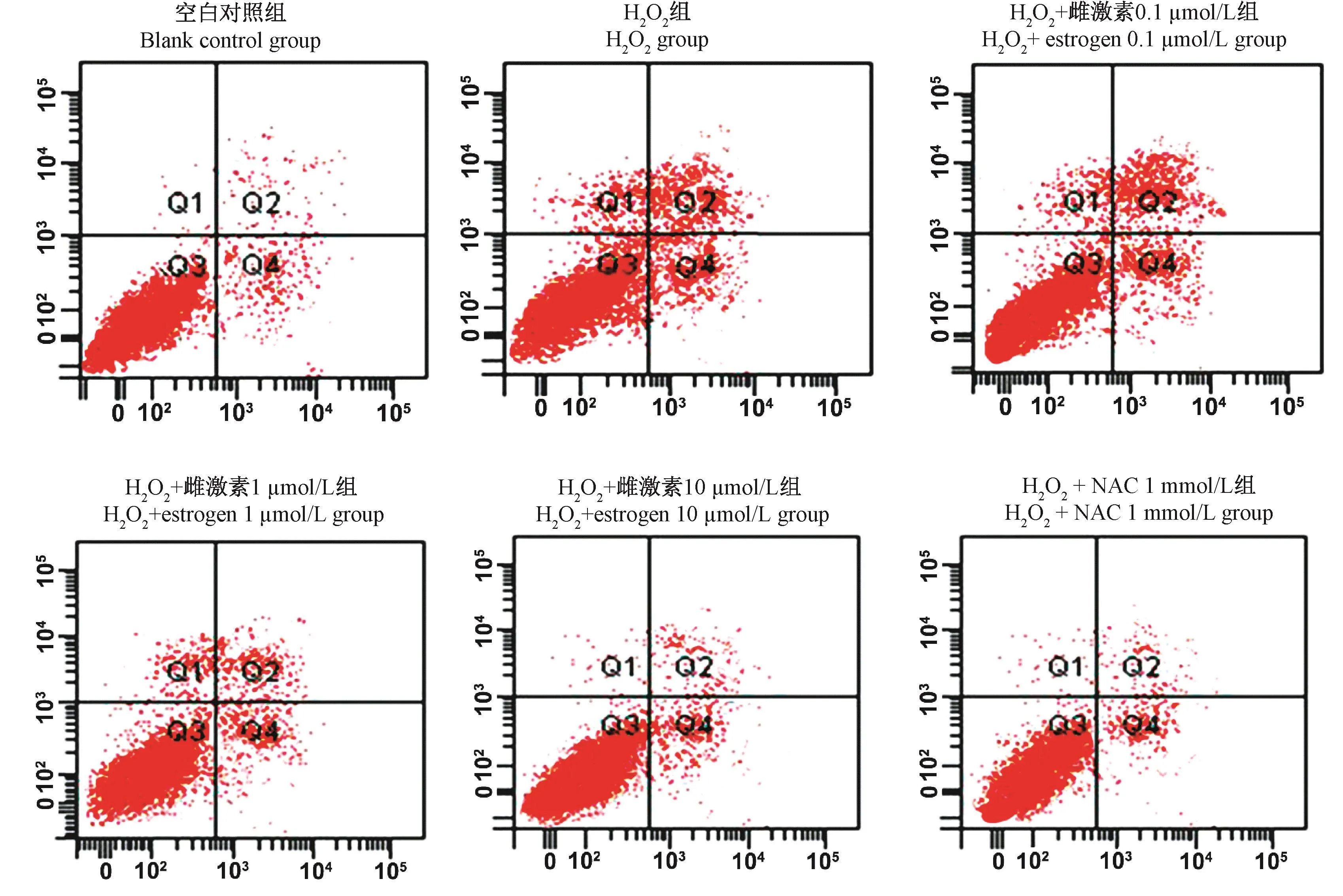
图1 雌激素对MC3T3-E1细胞凋亡水平的影响Figure 1 Effect of estrogen on apoptosis of MC3T3-E1 cells

图2 雌激素对MC3T3-E1细胞线粒体膜电位的影响Figure 2 Effect of estrogen on mitochondrial membrane potential of MC3T3-E1 cells
表2 雌激素对MC3T3-E1细胞氧化应激水平的影响(n=6,)Table 2 Effects of estrogen on oxidative stress in MC3T3-E1 cells(n=6,)

表2 雌激素对MC3T3-E1细胞氧化应激水平的影响(n=6,)Table 2 Effects of estrogen on oxidative stress in MC3T3-E1 cells(n=6,)
images/BZ_102_237_1718_2241_1768.png空白对照组Blank control group 3.45±0.34 27.80±2.13 9.75±0.78 H2O2组H2O2group 6.78±0.68∗ 20.36±2.07∗ 14.48±1.24∗H2O2+ 雌激素 0.1 μmol/L组H2O2+estrogen 0.1 μmol/L group 6.51±0.66∗ 21.07±2.20∗ 13.42±1.25∗H2O2+ 雌激素1 μmol/L组H2O2+estrogen 1 μmol/L group 5.32 ± 0.51∗# 23.65 ± 2.24∗# 12.56 ± 1.21∗#H2O2+ 雌激素10 μmol/L组H2O2+estrogen 10 μmol/L group 4.76 ± 0.43∗# 25.71 ± 2.15∗# 10.61 ± 1.06∗#H2O2+NAC 1 mmol/L组H2O2+NAC 1 mmol/L group 4.51± 0.45∗# 25.89± 2.21∗# 10.74± 1.02∗#F 87.451 26.143 52.695 P<0.001 <0.001 <0.001
表3 MC3T3-E1细胞Smad5、Runx2、Bcl-2、Bax和cleaved Caspase-3表达(n=6,)Table 3 Expression of Smad5,Runx2,bcl-2,Bax and cleaved caspase-3 in MC3T3-E1 cells(n=6,)
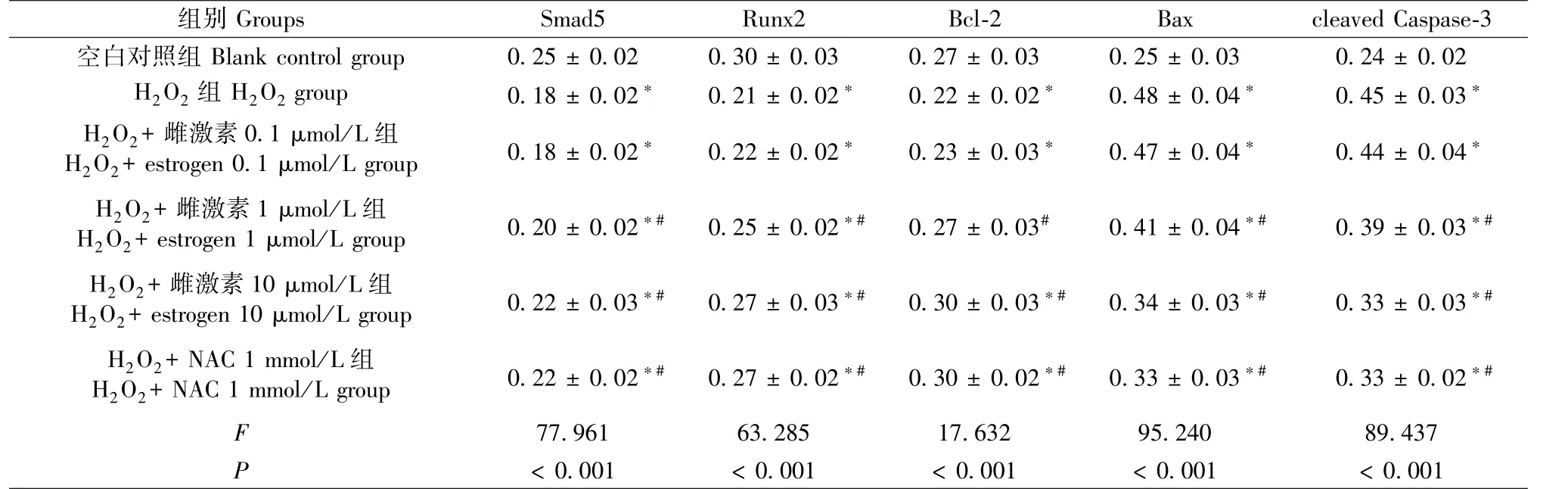
表3 MC3T3-E1细胞Smad5、Runx2、Bcl-2、Bax和cleaved Caspase-3表达(n=6,)Table 3 Expression of Smad5,Runx2,bcl-2,Bax and cleaved caspase-3 in MC3T3-E1 cells(n=6,)
images/BZ_102_237_2489_2241_2539.png空白对照组Blank control group 0.25±0.02 0.30±0.03 0.27±0.03 0.25±0.03 0.24±0.02 H2O2组H2O2group 0.18±0.02∗ 0.21±0.02∗ 0.22±0.02∗ 0.48±0.04∗ 0.45±0.03∗H2O2+ 雌激素0.1 μmol/L组H2O2+estrogen 0.1 μmol/L group 0.18±0.02∗ 0.22±0.02∗ 0.23±0.03∗ 0.47±0.04∗ 0.44±0.04∗H2O2+ 雌激素 1 μmol/L组H2O2+estrogen 1 μmol/L group 0.20± 0.02∗# 0.25 ± 0.02∗# 0.27 ± 0.03# 0.41 ± 0.04∗# 0.39 ± 0.03∗#H2O2+ 雌激素10 μmol/L组H2O2+estrogen 10 μmol/L group 0.22 ± 0.03∗# 0.27 ± 0.03∗# 0.30 ± 0.03∗# 0.34 ± 0.03∗# 0.33 ± 0.03∗#H2O2+NAC 1 mmol/L组H2O2+NAC 1 mmol/L group 0.22± 0.02∗# 0.27± 0.02∗# 0.30± 0.02∗# 0.33± 0.03∗# 0.33± 0.02∗#F 77.961 63.285 17.632 95.240 89.437 P<0.001 <0.001 <0.001 <0.001 <0.001

图 3 MC3T3-E1 细胞 Smad5、Runx2、Bcl-2、Bax和cleaved Caspase-3表达Figure 3 Expression of Smad5, Runx2, bcl-2, Bax,and cleaved caspase-3 in MC3T3-E1 cells
3 讨论
氧化应激是指细胞内氧自由基尤其是ROS的产生与抗氧化能力失衡的一种状态,可以引起多组织细胞的氧化损伤[10]。已有多项研究显示[11-12],氧化应激是导致PMOP发生的主要原因之一,细胞内过多的ROS可以诱导成骨细胞和骨细胞的凋亡,影响骨形成和吸收过程的平衡。雌激素是机体重要的内分泌激素,具有广泛的生物学作用,可以调节骨的形成和吸收,目前已逐步应用于PMOP患者的替代治疗[13]。既往研究显示[14],雌激素可以增加细胞内抗氧化酶的表达,清除细胞内过多的ROS,调节破骨细胞骨吸收和成骨细胞骨形成的平衡,但作用机制尚不清楚。因此,本研究建立了体外成骨细胞氧化应激损伤模型,来分析雌激素成骨细胞氧化应激损伤的作用。H2O2是一种常见的活性氧自由基,可以穿透细胞膜,诱导细胞的氧化应激损伤,与PMOP的发生发展密切相关[15]。因此,本研究采用H2O2诱导MC3T3-E1细胞的氧化应激损伤,来分析雌激素的作用。本研究中,H2O2诱导MC3T3-E1细胞的增殖活性明显下降,细胞凋亡率明显升高,经浓度为1 μmol/L及以上的雌激素作用后,MC3T3-E1细胞的增殖活性明显增加,凋亡率明显下降。周雪娟等[16]的研究显示,雌二醇可以上调成骨细胞内抗氧化酶的表达,减轻骨质疏松大鼠的氧化应激损伤,提示雌激素可以促进氧化应激损伤成骨细胞的增殖,抑制其凋亡,其具体的作用机制有待于进一步深入研究。
本研究中,MC3T3-E1细胞经H2O2诱导后,细胞内Smad5和Runx2蛋白表达明显下降,经浓度为1 μmol/L及以上的雌激素作用后,细胞内Smad5和Runx2蛋白表达明显升高。已有研究显示[17-18],Smad5/Runx2信号轴在成骨细胞的分化中具有重要的调节作用,细胞外信号分子磷酸化Smad5后,可以与Smad4结合形成复合物并进入细胞核,与Runx2相互作用,调节成骨细胞的分化。王慧等[19]的研究显示,雌激素可以通过多种信号通路调节成骨细胞Runx2的表达,提示雌激素可能通过调节Smad5/Runx2信号轴的表达,提高成骨细胞的分化能力。本研究中,MC3T3-E1细胞经H2O2诱导后,细胞内MDA和ROS水平明显升高,SOD活性明显下降,经浓度为1 μmol/L及以上的雌激素作用后,细胞内MDA和ROS水平明显下降,SOD活性明显升高,提示雌激素可以提高细胞内抗氧化酶的表达,降低ROS水平,改善细胞的氧化应激状态。
本研究中,MC3T3-E1细胞经H2O2诱导后,JC-1阳性细胞率明显升高,经浓度为1 μmol/L及以上的雌激素作用后,细胞JC-1阳性细胞率明显下降。JC-1是实验中常用的一种检测线粒体膜电位的荧光探针,在线粒体膜电位降低时,JC-1为单体出现绿色荧光[20],提示雌激素可以升高氧化应激损伤MC3T3-E1细胞的线粒体膜电位。线粒体是细胞内能量代谢的中心,线粒体膜内外的电位差变化可以影响细胞内的能量代谢,影响细胞增殖、分化、凋亡等多种生物学过程[21],提示雌激素可能通过恢复线粒体膜电位,促进H2O2诱导MC3T3-E1细胞的增殖,抑制其凋亡。本研究中,H2O2可以诱导MC3T3-E1细胞Bax和cleaved Caspase-3蛋白的表达上调,Bcl-2蛋白的表达下调,经浓度为1 μmol/L及以上的雌激素作用后,Bax和cleaved Caspase-3蛋白的表达下调,Bcl-2蛋白的表达上调。Bcl-2和Bax为一组调控线粒体凋亡途径的蛋白,cleaved Caspase-3为细胞内凋亡的执行蛋白,可以降解细胞内多种重要蛋白,诱导细胞凋亡[22],提示雌激素可以恢复线粒体膜电位,上调氧化应激损伤MC3T3-E1细胞Bcl-2/Bax的表达,抑制细胞凋亡。
综上所述,雌激素可以调节Smad5/Runx2信号轴的表达,促进H2O2致氧化应激损伤MC3T3-E1细胞的增殖和分化,降低细胞的氧化应激水平,抑制其凋亡,有望应用于临床治疗。但本研究尚处于初步探索阶段,其雌激素保护H2O2致氧化应激损伤MC3T3-E1细胞的具体机制尚需进一步验证。
