乙肝病毒相关肝细胞癌小鼠模型的构建和前沿应用现状
2021-01-14郑海香丁明珠张雨琪施佳健张璐景月娥王星
郑海香,丁明珠,张雨琪,施佳健,张璐,景月娥,王星
(福建医科大学基础医学院消化道恶性肿瘤教育部重点实验室,福州 350108)
全球每年约有200万新发癌症病例与感染相关,占全年新发癌症病例的15.4%。感染相关肿瘤在中国占比约为26.1%,居亚洲之首,积极预防病原体的感染对减轻未来全球癌症负担将产生重大的积极意义[1]。致癌病原体中涵盖了目前公认的7种人类肿瘤病毒:HBV、丙型肝炎病毒(hepatitis C virus,HCV)、EB 病毒(epstein-barr virus,EBV)、人乳头瘤病毒(human papilloma virus,HPV)、人类 T淋巴细胞白血病病毒Ⅰ型(human T lymphocytic leukemia virus type I,HTLV-1)、卡波西肉瘤相关疱疹 病 毒 (kaposi’ s sarcoma-associated herpesvirus,KSHV)和最新的Merkel细胞多瘤病毒(Merkel cell polyomavirus,MCPyV),HBV 是其中临床危害最严重的DNA肿瘤病毒[2]。在我国,HBV或HCV介导的肝炎、肝纤维化和肝硬化是导致肝癌发生的根本原因之一,其中HBV相关的HCC占据所有病例的60%以上[3]。尽管人们对病毒相关肝癌的临床表现和干预手段已经有了相当深入的认识,但HBV致瘤的具体机制仍不是十分清楚,一个重要的限速步骤就是缺乏感染背景下的致瘤动物模型。目前最为广泛使用的HBV相关肝癌动物模型主要集中于模式化小鼠。主要是在联合致癌剂、细胞癌基因或单独使用组织特异性启动子情况下,观察转基因小鼠中病毒癌基因对相应表型的诱导能力,或使用HBV阳性的肿瘤细胞系或者肝癌组织移植到免疫缺陷小鼠身上复制出相关表型。HBV肝癌小鼠不同模型间的功能侧重和适用范围差异巨大,本综述拟详尽梳理并比较它们之间的病毒感染复制特点及致瘤特性,以期为研究者选择正确的模型开展靶向药物或疫苗研究提供参考。
1 基于基因工程的肝癌小鼠模型
1.1 基于HBx转基因小鼠的肝癌模型(HBx transgenic mice,HBx-Tg)
在HBV编码的分子中,x蛋白在HCC的发生发展中起着关键的作用,被认为是主要的病毒癌蛋白。HBx蛋白作为病毒基因转录的反式激活因子,被证实可广泛与细胞增殖和存活的关键信号通路互作,导致肝细胞癌的发生[4]。早在1991年,研究人员就在病毒自身元件调控作用下将HBx基因插入小鼠的基因组中建立了单个病毒基因的转基因小鼠模型。然后观察到该小鼠肝中出现多灶性区域病变,继以良性腺瘤后发展为恶性肿瘤[5]。同时,84%的HBx高表达小鼠被发现于13~24个月内发生HCC。HBx-Tg被认为是研究x蛋白在病毒基因表达调控从而致瘤的分子机制以及临床前药物筛查的良好模型。
但许多报道指出最初建立的HBx转基因小鼠具有如下缺陷:(1)小鼠模型技术要求高、制备周期长。一般在13~24个月产生肝恶性肿瘤,饲养时间长,成本高。(2)肝癌发病率不稳定且受到小鼠性别差异的影响。为弥补此类缺陷,研究人员常将病毒HBx基因与细胞癌基因如c-Myc、c-Met等联合转基因,或与传统的化学诱导方法相结合,以快速制备HBV-HCC小鼠模型并评价病毒-宿主互作在肿瘤发生中的功能机制[6]。
此外,近年来新出现的一种简单的肝特异性转基因方法明显缩短了小鼠模型建立的时间,简化了相应的技术。该方法通过采用Sleeping Beauty(SB)转座酶系统和基于流体动力学的转染(hydrodynamic transfection,HT)方法来创建 HBx-转基因模型。SB转座子是一种高效稳定的基因转移工具,它能通过“剪切-粘贴”的方式将外源目的基因整合入宿主细胞基因组中[7](图1)。以SB转座子作为递送系统,通过流体动力尾静脉注射将HBx基因整合入Fah-/-/Rag2-/-/Il2rγ-/-(FRG)小鼠的肝细胞中。流体动力传递的过程诱导了肝炎症,随后携带HBx转基因的肝细胞进行选择性再繁殖,由此证实了单个HBx突变可以诱导肝细胞增殖[8]。HT模型造模时间短是其优势之一,但两个明显的缺点在于:编码癌基因的转座子随机整合到染色体中,会影响整合位点或附近的细胞基因表达。其次,转座子中的癌基因通常被置于强启动子的控制之下,因此导致基因以极高的水平表达,不符合人体正常生理机制[9]。
针对HBx转基因小鼠模型的研究发展迅速,其应用也较为广泛。虽然HBx-Tg的建模成功率高且表型显著,但其局限性在于小鼠发生肿瘤之后进展过快,这与人类肝癌的缓慢演变大不相同。第二,小鼠肿瘤往往过于同质,无法正确反映人类肝癌的复杂性。特别是HBx-Tg仅能体现过表达x基因后对肝癌的促进作用,无法反映出完整病毒在自然感染状态下的致瘤效应。
1.2 基于HBs转基因小鼠的肝癌模型(HBs transgenic mice,HBs-Tg)
HBV S基因所编码的表面抗原蛋白(HBsAg)也被认为起到促瘤发生的作用。上个世纪末期,已有报道提示年龄为14~16个月的近半数HBs转基因小鼠中可检测到自发形成的HCC[10]。最近,研究者通过纳入CRISPR/Cas9技术靶向HBV的preS1/preS2和S编码序列,特异性敲除肝癌细胞系中的HBsAg,功能上进一步证实HBsAg所介导的细胞体外增殖和体内成瘤能力被显著抑制。机制上则阐明HBsAg缺失可导致炎症通路关键分子白介素IL-6表达量降低,并抑制下游STAT3的信号转导与活化,提示HBsAg参与促发炎症是其可能的致瘤机制之一[11]。
HBs-Tg在自然状态下持续表达HBsAg并表现出系统对该抗原的免疫耐受,因此,常应用于研究病毒相关肿瘤的适应性免疫反应。据此,Zong等[12]通过阻断HBs-Tg小鼠的免疫检查点受体分子TIGIT(T cell immunoglobulin and ITIM domain),同时持续接种乙肝疫苗,观察到这种联合处理所引起的过度免疫反应可诱导肝癌发生。肝癌在9个月龄转基因小鼠中的发生率可达63.64%,由此建立了新的HBV抗原特异性细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)介导的病毒相关肝癌动物模型。值得注意的是,上述结果提示在HBV携带者中开展免疫检查点治疗,可能增加慢性肝炎和癌症的发生风险。此外,还有研究人员在免疫系统完全的Fah-/-小鼠肝中通过脾注射转移HBs-Tg小鼠的肝细胞,同样证实了病毒特异性T细胞的活化是诱导小鼠发生肝癌的关键因素。该模型在6个月时的肿瘤发生率为100%,较强的免疫能力使其成为研究抗HBV适应性免疫和免疫病理学的有效工具[13]。而最近一项研究提示,除了细胞杀伤性T细胞外,自然杀伤细胞(natural killer cell,NK cell)被激活亦利于HBs-Tg小鼠发生肝癌。在该模型小鼠中连续8周使用自然杀伤细胞激活剂后,下游激活的IFN-γ效应分子可通过上调EpCAM-EMT信号轴使得全部小鼠在6个月后均发生肝癌[14]。
现有研究成果表明HBs-Tg转基因小鼠是研究病毒相关HCC的免疫机制和免疫相关疗法的较佳模型。但HBs-Tg与HBx-Tg小鼠具有同样缺点,即均为单个病毒基因的转基因模型,并且往往需要联合其他化学或物理方法进行协同干预,才能快速获得符合研究需要的肝癌表型。
1.3 基于HBV基因组转染小鼠的肝癌模型(HBV transgenic mice,HBV-Tg)
小鼠肝细胞被证实是可以支持HBV的复制与增殖,但不支持病毒自然感染和形成 HBV cccDNA[15]。2011年,Huang等[16]应用腺病毒相关病毒(adenovirus-associated virus,AAV)作为病毒载体,研究HBV在免疫完全小鼠中持续表达是否可导致HCC。通过静脉注射AAV荷载的HBV基因组至C57BL/6小鼠中,发现所有转染小鼠在持续12~16个月后均出现肝肿瘤结节,后续组织病理学分析提示HCC发生率为83%。邻近的癌旁组织也呈现炎症浸润、脂肪变性和局灶性坏死等组织学异常。目前该模型已被广泛用于揭示HBV病毒复制和病毒抗原持续表达对肝癌发生发展的影响(图1)。
CRISPR/Cas9基因组编辑工具的出现克服了腺病毒作为载体的HBV-Tg小鼠中造模周期长的缺点。CRISPR/Cas9系统是一种可以对特定基因组位点进行切割置换的系统[17]。研究者们利用此系统靶向敲除肝癌中关键的细胞抑癌基因,作为辅助手段加速建模过程并研究HBV与宿主分子互作的致瘤机理。但是近年更多是作为新型干预治疗手段尝试性地用于清除HBV病毒蛋白或基因组,研究对于HBV持续感染关键分子cccDNA的表达、慢性炎症乃至肝癌的抑制作用。文献报道,通过CRISPR/Cas9系统向成年C57-HBV-Tg小鼠肝中同时引入p53和Pten突变,可加速发生肝癌,最早可提前至注射后4个月。荷瘤小鼠的血清甲胎蛋白、谷丙转氨酶和HBsAg水平显著高于对照质粒组和野生型组[18]。HBV慢性感染的一个治疗难点即为患者肝细胞中HBV cccDNA高度稳定并难以清除,使得肝和血清中持续表达病毒相关分子,它是HBV体内复制和再复发的根本原因,因此是预防继发恶性肝病的关键靶点[19]。 Greggi等[20]、Ramanan 等[21]在高压尾静脉注射HBV 1.3拷贝的质粒所建立的基因组转染小鼠模型中,同时转导可靶向于HBV各基因型间保守序列的24个向导sgRNA,结果显示病毒表达与复制及cccDNA水平全部被明显抑制,提示CRISPR/Cas9可用于体内模型研究病毒复制。但现有数据未提示其在病毒相关肝炎、肝硬化乃至肝癌的三部曲演进过程中的作用,值得长期关注。尽管目前的CRISPR/Cas9系统已具有强大的靶向性能,但原始的切割式基因编辑方式可能同时诱导细胞基因组双链断裂从而引发重排和损伤。与传统技术不同,最新发展出的CRISPR/Cas9通过联合使用部分失活的Cas9内切酶以及APOBEC脱氨酶,可精准引发C-T/G-A的碱基转换,但同时避免HBV整合位点的宿主基因断裂。在充分抑制HBV基因组的同时保护细胞中不出现脱靶突变。CRISPR/Cas9系统可精准靶向病毒基因组的特性,使其成为将来可能彻底治愈慢性HBV感染和其他肝病的有效办法[22]。作为病毒学领域的热点技术,CRISPR/Cas9干预病毒的功能效应研究目前主要在体外系统中展开,因此需要纳入更多类型体内模型予以精准评价[23]。
与单个基因过表达的HBV转基因小鼠相比,AAV/HBV-Tg小鼠具有易于操作、结果稳定、重现性好的优点。它是在完全免疫小鼠中模拟病毒和宿主互作过程,因此是进一步研究HBV介导慢性肝病和肝癌发生的分子机制的有效工具。
2 基于异种移植或嵌合的HBV肝癌小鼠模型
2.1 应用标准化人肝癌细胞系的小鼠模型(cell line-derived Xenograft,CDX 模型)
目前用于制备人鼠肝嵌合模型的HBV阳性的标准化肝癌细胞系有:HCC LM3细胞、、Hep3B细胞、MHCC97H 细胞、HepG2.2.15细胞、HepAD38等。为成功制备CDX模型,必须满足两个条件:(1)受体小鼠对异种移植物具备可容纳性,不会产生免疫排斥或其他严重不良反应;(2)该细胞系在小鼠中具备可成瘤性。
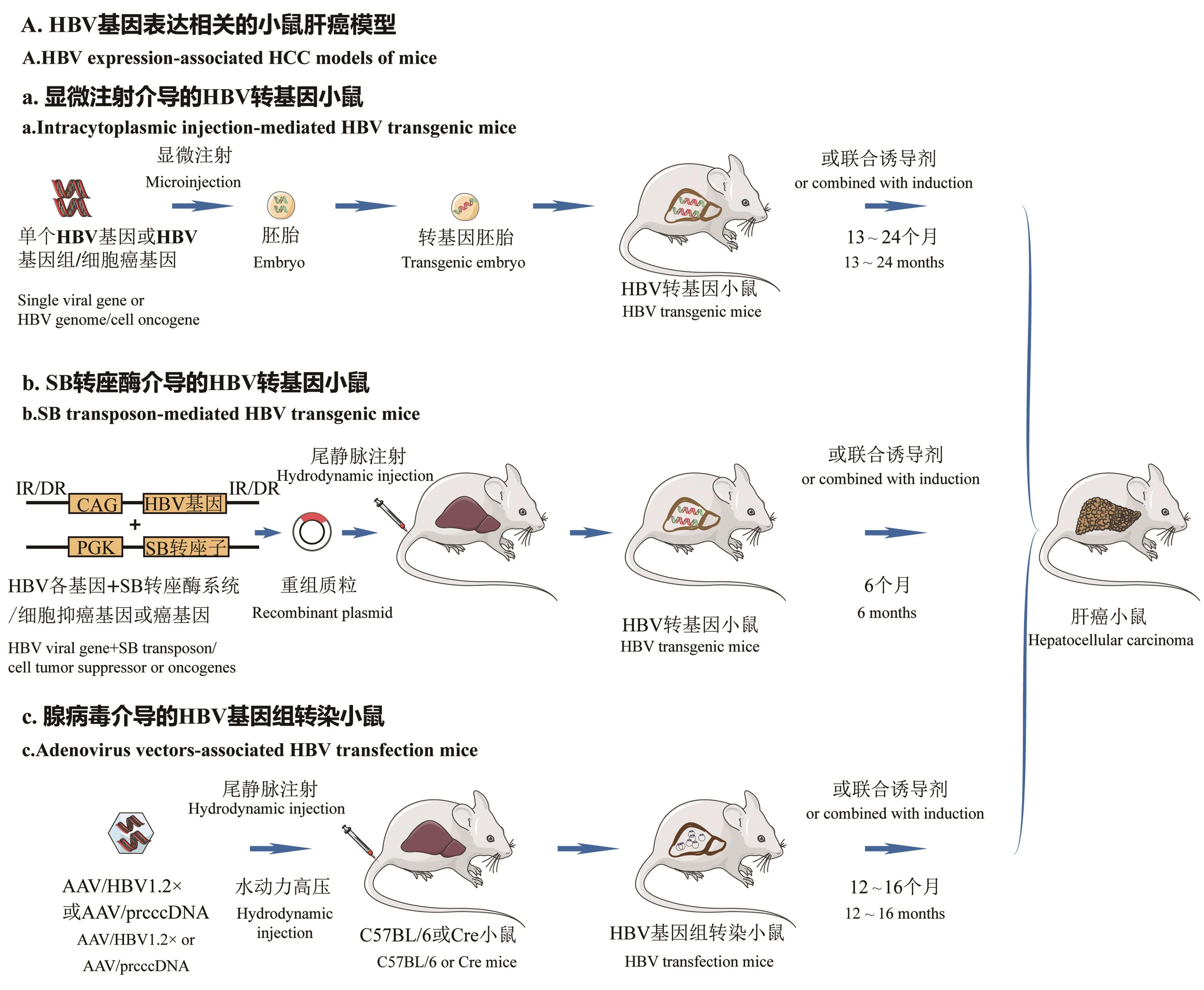
图1 HBV病毒基因过表达相关的肝细胞癌小鼠模型Figure 1 Various HBV-related hepatocellular carcinoma mice model by ectopic viral genes or HBV genome
目前CDX模型主要包括皮下移植、腹腔移植和肝内原位移植(图2)。皮下和腹腔移植模型通常是分别将HBV阳性肝癌细胞混悬液注射于小鼠的腹背侧面皮下,或直接至腹腔中。CDX的肝内原位模型则通常是先构建小鼠皮下肿瘤移植物,然后移植包埋或夹心于小鼠原位肝内[24]。最常见和最简单的模型是皮下移植模型,它可以快速获得肿瘤组织,这对于研究肿瘤细胞的药物反应或细胞-病毒互作分子机制较为便利[25],因此,该模型应用最广泛。但是,它不能提供肝癌发生所需要的各种肝细胞、各种成分相互作用的微环境,所以原位模型在阐明疾病发生发展机制中更具有优势。2019年,Xu等[26]先将HCCLM3细胞悬液皮下注射于五只无胸腺裸小鼠中获得肿瘤包块,未发现转移。但是再次将组织块原位接种于小鼠肝左内侧叶的囊下区域时,却观察到45%的小鼠出现肝癌骨转移。
在病毒性肝癌的治疗策略研究中,抗病毒药物有效抑制HBV阳性肝癌细胞的增殖提示了抗病毒治疗的重要性[27]。研究显示替比夫定、恩替卡韦和干扰素-α2b等处理可下调肝癌细胞中HBx表达并抑制细胞增殖,但在恢复HBx蛋白表达后,三种抗病毒药物均失去了抗增殖作用,以上提示HBx可能是抗HBV药物抑制病毒阳性肝癌细胞增殖的主要靶点。
CDX模型均具有技术简单、操作时间短、成瘤率高的特点。肝内原位移植模型更容易观察到肿瘤的侵袭和转移,皮下模型操作最为便利,腹腔模型因其引发腹腔器官广泛成瘤现象,现已较少使用。此外,由于培养条件单一,标准化细胞系在长期传代过程中往往会获得一些新的永生化表征,且体外培养条件与肝原发环境的显著差异也使得CDX移植物部分丢失原代肝癌细胞的特征。这导致CDX异种移植物缺乏临床前患者肝癌组织中典型的细胞多样性和异质性,同时因为小鼠基质细胞的大量浸润,CDX模型在病理表现上与人类肝癌相似性较低,使得该模型不常用于药物筛选和疗效评估。
2.2 患者来源的异种移植物模型(patient-derived xenograft,PDX 模型)
与CDX模型相比,病毒性肝癌 PDX小鼠(HBV-HCC PDX)模型的移植物来自HBV阳性的肝细胞癌患者的新鲜肿瘤组织或所分离的原代肝癌细胞(图2)。该模型克服了永生化肝癌细胞系在多次传代培养中逐渐丢失肿瘤细胞异质性的缺点,表现出更接近患者组织的临床病毒学和肿瘤细胞学特征。
在该模型中,由于免疫缺陷小鼠的异种移植物在荷瘤传代过程中,其中的人源基质细胞逐渐被小鼠来源所替代,因此仅部分保留了患者原始肿瘤的基因表达模式。但其独特之处是,研究显示胞外基质、细胞黏附分子和免疫通路调节分子等基因的表达在移植物中被下调,而与细胞周期和DNA复制相关的基因表达则显著富集。此外,研究者通过此类皮下模型研究建模过程中HBV抗原表达和定位等病理变化,分析该模型是否可用于肿瘤病毒学研究[28]。结果显示,HBV-HCC PDX模型从宿主和病毒学两方面模拟了患者来源肝癌组织的特点,尤其是HBsAg和HBcAg的表达和细胞定位较好重现了其在患者组织中的特点。HBcAg保留了在原始组织中高水平表达且呈胞质、胞核和全细胞分布的复杂模式,HBsAg也再现了患者癌组织中无法检出的现象。
但是,另有研究者基于7例新加坡HCC病例建立的皮下PDX模型显示,随着异种移植物在小鼠体内持续传代,HBV复制逐渐丢失[29]。比起皮下模型,肝原位模型更贴合原发肝癌的肿瘤微环境。研究者将来自HBV-HCC患者的新鲜肿瘤组织切取为直径2 mm大小的组织块并嵌合于无胸腺小鼠的原位肝中,成功制备了原位PDX模型并观察到广泛的肿瘤自发转移。免疫组化检测结果同样证实HBx蛋白和人甲胎蛋白保持高表达,说明了原位模型对应肿瘤起源的器官保留了必需的微环境,更能观察到肿瘤的远距离广泛转移[30]。
PDX模型基本保留了原始肿瘤的结构和组织学特征,因此对于研究肿瘤基因表达模式、突变状态、转移潜力和药物反应性等个体化精准医学,它更具有临床病理学优势。研发并完善PDX模型将加速精准医学的发展,由于具备和人类原始肿瘤组织高度的相似性,使得该模型可以用于预测患者个体化抗癌和抗病毒治疗的效果[31]。目前HCC PDX模型也已被用于多种药物的临床前药理学测试[32]。
该模型存在的缺点为:(1)建模需要大量的患者肿瘤资源和大量资金,且技术要求高、肝原位移植模型死亡率较高;(2)该模型建立在免疫缺陷的小鼠中,仍无法完全模拟肿瘤在人体中的发生发展过程,对于肝癌免疫疗法和免疫治疗药物研发具有局限性[33]。因此,有研究人员通过将人类造血干细胞(hematopoietic stem cells,HSCs)注射入严重免疫缺陷(NOD-scid Il2rg-/-,NSG)小鼠中以重建人源免疫系统的模型,并进一步原位移植入I型人白细胞抗原匹配的人肝癌组织,由此建立了免疫完全小鼠的人源肝癌PDX模型[34]。人源免疫小鼠可用以研究肿瘤和免疫应答的变化以及免疫检查点抑制剂的作用,其效应可基本还原临床结果。该模型更适用于探索病毒介导的人类癌症与免疫系统之间的相互作用[35]。
3 总结

图2 基于异种移植或嵌合的HBV肝细胞癌小鼠模型Figure 2 Xenograft or chimera-based HBV-related hepatocellular carcinoma mice model
虽然HBV病毒相关肝癌的动物模型类别多种多样,在肿瘤病毒学研究领域居于前列,但是目前仍然没有一种动物模型能够成为广泛使用的代表性模型。该领域小鼠模型作为目前最简便和实惠的选择,在实验室中得以普遍使用,但仍存在着一些缺点。转基因小鼠模型仅选择性在小鼠基因组中插入一个或几个病毒基因,不能完全拟合HBV正常感染和致病过程中完整病毒各分子间复杂的时空协同作用。此外,全基因转染小鼠中则因为小鼠肝细胞不表达HBV感染的功能性受体钠离子牛磺胆酸共转运蛋白(sodium taurocholate cotransporting polypeptide,NTCP),因此缺乏野生型HBV的自然感染过程。这两种模型有其优势和特色之处,但在病毒相关肝癌中的研究还需审慎解释相关数据。传统的人源化小鼠因其缺少免疫系统,在研究抗病毒和抗肿瘤免疫治疗方面受到极大限制,限制了目前最前沿的免疫治疗研究。综上,现有的病毒相关肝癌模式动物模型存在其各自优缺点和适用范围,需要我们在实际应用中根据具体目的针对性的选择使用。同时,为了进一步剖析病毒和肿瘤在免疫学方面的互作机制,需要我们继续研发能够完全还原人类免疫系统的病毒相关肝癌的体内模型。建立可真实反映病毒感染和致病特征的体内模型,将为研究肿瘤病毒的致病机制提供平台,具备突出的临床意义和科学价值。