Oct4和Cdx2对牛胚胎内细胞团和滋养外胚层分化的影响
2021-01-14赵楠楠王艳郭艳娟高杰袁金灵陈燕
赵楠楠,王艳,郭艳娟,高杰,袁金灵,陈燕
(华北理工大学附属医院,河北唐山 063000)
哺乳动物胚胎发育过程中第一个可见的分化事件是内细胞团(inner cell mass,ICM)和滋养外胚层(trophoectoderm,TE)的分离。ICM是一群多能细胞,附着在TE的内部,形成胎儿和胚胎外组织。相反,TE是围绕囊胚腔发育成胎盘的单层极化细胞[1]。ICM和TE的分离由涉及多个基因相互作用的单独的发育程序调节。
Oct4和Cdx2两种转录因子对ICM和TE谱系的分离和功能发挥是必需的。Oct4(Pou5f1)是POU转录因子家族的一员,在囊胚腔形成后仅在ICM中表达,对维持细胞多能性和正常分化为表皮细胞的过程不可或缺[2]。Cdx2是正确的细胞命运决定和TE分化所需的TE特异性转录因子[3]。Cdx2、Sox2和Nanog是Oct4的已知靶点,三者通常形成网络共同调控其他靶点基因。Oct4基因与Sox2、Nanog共同形成和维持胚胎干细胞的多能性和自我更新。缺乏Oct4或Cdx2表达的小鼠胚胎仍分别形成ICM或TE[3-5]。这些结果表明,Oct4和Cdx2在囊胚形成后ICM和TE的分化中都发挥了作用。然而,关于Cdx2调节Oct4在牛胚胎中的作用,还未有统一的说法。Schiffmacher等[6]指出Cdx2在牛胚胎中负调节 Oct4。而其他研究表明,牛胚胎Cdx2的下调并不影响Oct4的表达[7-8]。目前对牛ICM和TE分化的分子机制研究有限。本研究希望通过Oct4和Cdx2敲低对牛ICM和TE分化相关基因表达的影响,解释Oct4和Cdx2在牛胚胎早期发育中的作用。
1 材料与方法
1.1 材料
1.1.1 细胞
牛卵母细胞由本院研究室采集并培养。
1.1.2 主要试剂与仪器
QuantiTect反转录试剂盒购自 Qiagen公司;VECTASHIELD with DAPI防荧光萃灭封片剂购自Vector Labs;Oct4、Cdx2、β-actin 抗体购自 Santa Cruz Biotechnology;新生牛血清、RNA提取试剂盒购自生工生物工程有限公司。
多管架自动平衡离心机L530;电热恒温水槽SSW-420-2S型;二氧化碳培养箱MCO-20AIC-SC;显微操作仪 Nikon Eclipse Ti;荧光显微镜;博日qPCR仪。
1.2 方法
1.2.1 体外受精和胚胎培养
采集牛卵巢抽取卵母细胞,捡取卵丘-卵母细胞复合体(cumulus-oocyte complexes,COCs)。 COCs经洗卵液和成熟液分别洗涤3~5次,微滴成熟液培养22 h,培养条件为39℃、5%CO2、饱和湿度,无菌矿物油覆盖微滴。成熟后转移至IVF-100培养液。解冻的精液在IVF-100培养基中2000 r/min离心5 min,共两次。将精子加入COCs,终浓度为每毫升5×106个,在39℃、5%CO2的湿润环境中孵育6 h。受精后,去除卵丘细胞和多余的精子。显微注射siRNA,使用含 1%BSA的改良 TALP培养基(mTALP),39℃、5%CO2、5%O2和 90%N2的湿润环境下培养胚胎。第2天转移至含3%新生牛血清的mTALP培养基中,相同条件培养至第7天。培养期间统计胚胎发育情况。
1.2.2 siRNA设计和显微注射
根据Oct4和Cdx2的基因序列分析和设计原则,确定 Oct4 siRNA的 Sense Strand和 Antisense Strand分别为:5’-GGAAAGGUGUUCAGCCAAATT-3’, 5’-UUUGGCUGAACACCUUUCCTT-3’; Cdx2 siRNA的Sense Strand和Antisense Strand分别为:5 ’-ACGUGAGCAUGUAUCCCAGTT-3 ’, 5 ’-CUGGGAUACAUGCUCACGUTT-3’。 siRNA 序列由上海吉玛制药技术公司合成。受精后,根据说明将裸露的胚胎转移至含1 mg/mL BSA的mTALP培养基微滴液中进行显微注射。洗涤胚胎并按上述条件进行培养。
根据注射情况将实验对象分为:空白对照(Ctrl)组;阴性对照siRNA(siCtrl)组;注射Oct4特异性 siRNA(siOct4)组和 Cdx2特异性 siRNA(siCdx2)组。
1.2.3 实时定量荧光PCR(qPCR)
收集桑椹胚和囊胚,蛋白酶去除囊胚透明带。根据说明进行RNA提取、反转录及实时荧光定量PCR,所用引物为:Oct4 F:5’-GGTTCTCTTTGG AAAGGTGTTC-3’,R:5’-ACACTCGGACCACGTCTT TC-3’;Cdx2 F:5’-GCCACCATGTACGTGAGCTACC-3’, R: 5’-ACATGGTATCCGCCGTAGTCCGG-3’;Nanog F:5’-AATTCCCAGCAGCAAATCAC-3’, R:5’-CCCTTCCCTCAAATTGACAC-3’。 β-actin作为内参,SYBR Green检测产物并计算相对表达量。
1.2.4 免疫荧光染色
4%多聚甲醛室温固定桑椹胚20 min;含0.1%Triton X-100的PBS(TXPBS)清洗2次,每次10 min;清洗过的样品用含0.2%Triton X-100的PBS通透30 min,再清洗2次;7%山羊血清封闭1.5 h用于Oct4染色,0.5%BSA+1% 脱脂奶粉封闭1.5 h用于Cdx2染色;TXPBS清洗5 min,一抗4℃孵育过夜;TXPBS清洗一抗4次,每次15 min;二抗室温孵育1 h;TXPBS清洗4次,每次20 min;DAPI染色,VECTASHIELD封片。倒置荧光显微镜观察实验结果。
1.3 统计学分析
使用SPSS 20.0软件对实验数据进行统计分析。所有数据均以平均值±标准差()表示,多组间比较采用单因素方差分析,两组间比较采用LSD检验。P<0.05,差异具有显著性。
2 结果
2.1 Oct4 siRNA干扰对Oct4 mRNA和蛋白表达的影响
qPCR结果显示,siOct4组胚胎Oct4 mRNA表达水平显著低于Ctrl组和siCtrl组(P<0.05)。免疫荧光染色结果显示,siOct4组胚胎Oct4信号强度显著低于Ctrl组和siCtrl组。说明RNA干扰成功敲低牛胚胎Oct4基因(见图1)。
2.2 Cdx2 siRNA干扰对Cdx2 mRNA和蛋白表达的影响
与 Ctrl组和 siCtrl组比较,siOct4组胚胎中Cdx2的mRNA和蛋白质表达水平均显著降低(P<0.05)。说明通过RNA干扰成功对牛胚胎的Cdx2基因进行了敲低(见图2)。
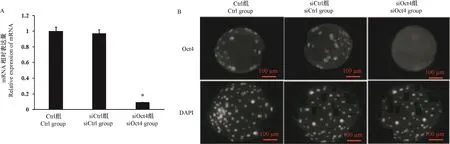
图1 Oct4 siRNA干扰对Oct4 mRNA和蛋白表达的影响Note.A.Relative expression of Oct4 mRNA.B.immunofluorescence results of Oct4.Compared with Ctrl group and siCtrl group,∗P<0.05.(The same in the following figures and tables)Figure 1 Effect of Oct4 siRNA interference on the expression of Oct4 mRNA and protein
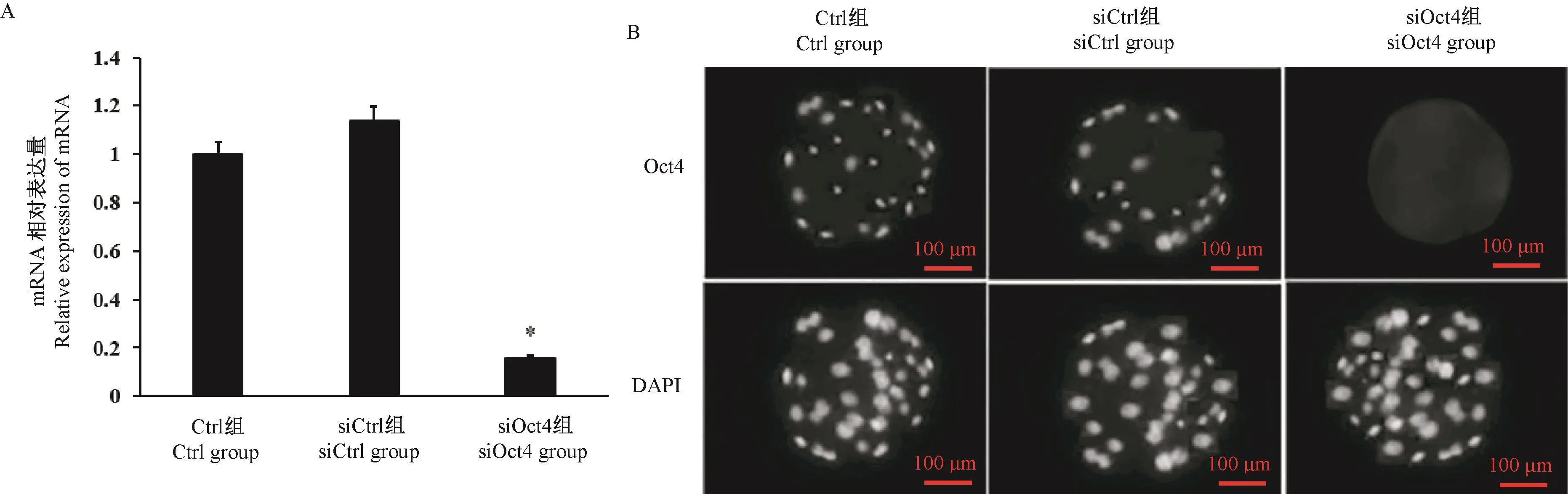
图2 Cdx2 siRNA干扰对Cdx2 mRNA和蛋白表达的影响Note.A.Relative expression of Cdx2 mRNA.B.immunofluorescence results of Cdx2.Figure 2 Effect of Cdx2 siRNA interference on the expression of Cdx2 mRNA and protein
2.3 siRNA干扰对牛胚胎早期发育的影响
与Ctrl组和siCtrl组比较,Oct4敲低的胚胎卵裂率及8-细胞期比例无差异(P>0.05),囊胚率显著降低(P<0.05)(表1)。Cdx2敲低的胚胎卵裂率、8-细胞率及囊胚率与Ctrl组和siRNA组均无差异(表2)。说明Oct4基因影响胚胎早期发育过程中的囊胚形成,Cdx2对胚胎发育到囊胚阶段无影响。
2.4 Oct4 siRNA干扰对 Cdx2、Sox2和 Nanog mRNA水平的影响
与Ctrl组和siCtrl组相比,siOct4组的胚胎Cdx2、Sox2和Nanog mRNA在囊胚阶段表达水平均显著下降(图3,P<0.05)。 说明在牛胚胎早期发育中,Cdx2、Sox2和Nanog mRNA表达水平与Oct4基因有关。
2.5 Cdx2 siRNA干扰对 Oct4、Sox2和 Nanog mRNA水平的影响
与Ctrl组和siCtrl组相比,siCdx2组胚胎在囊胚阶段 Oct4 mRNA表达水平显著降低(图 4,P<0.05),Sox2 mRNA和Nanog mRNA无差异(图4B和图4C,P>0.05)。说明在牛胚胎早期发育中,Cdx2基因主要影响Oct4基因的表达,对Sox2和Nanog基因则无影响。

表1 敲低Oct4后牛胚胎早期的发育Table 1 Embryos early development after Oct4 knockdown

表2 敲低Cdx2后牛胚胎早期的发育Table 2 Embryos early development after Cdx2 knockdown
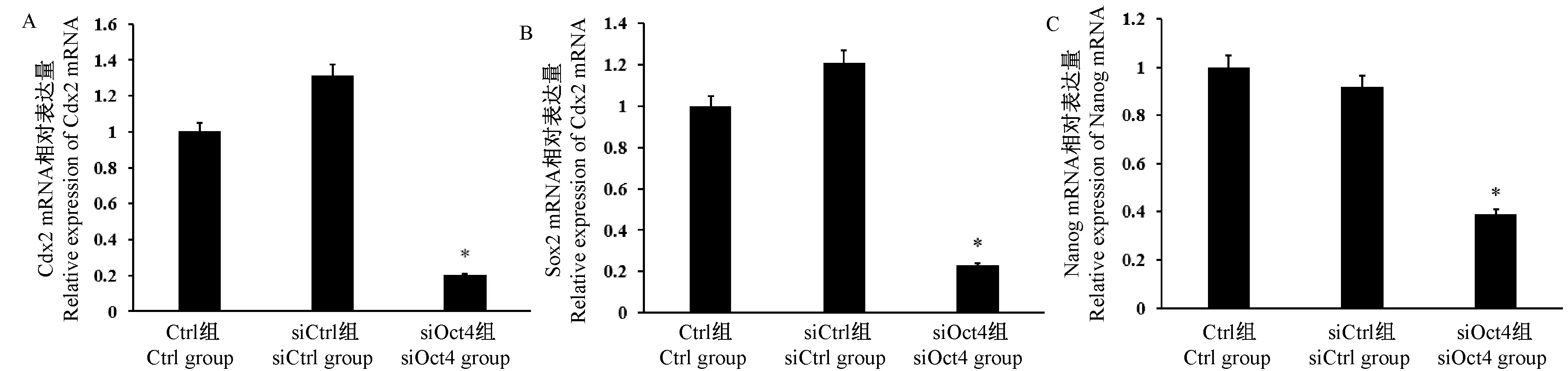
图3 Oct4 siRNA干扰对Cdx2、Sox2和Nanog mRNA水平的影响Figure 3 Effect of Oct4 siRNA interference on levels of Cdx2,Sox2 and Nanog mRNA
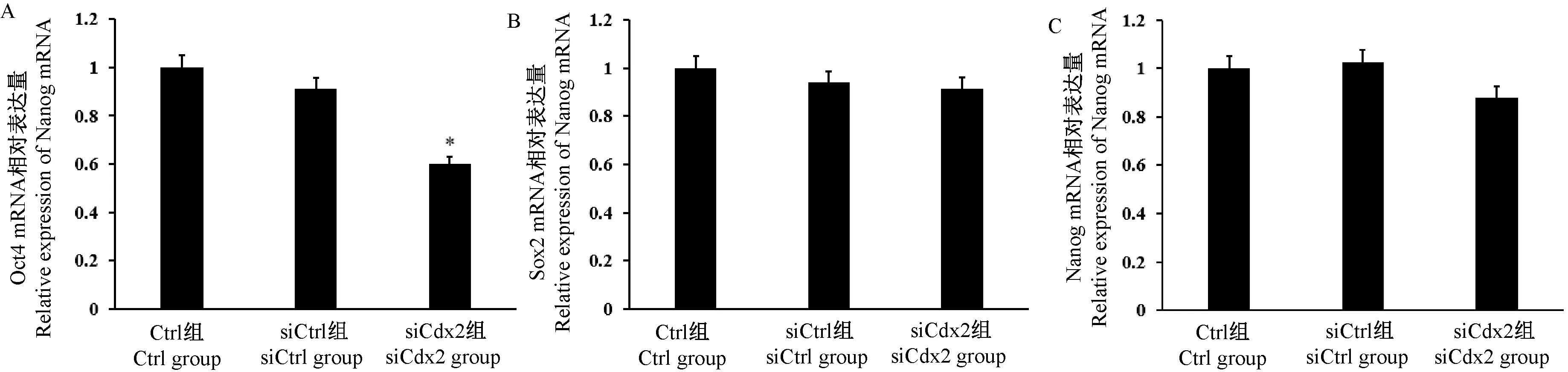
图4 Cdx2 siRNA干扰对Oct4、Sox2和Nanog mRNA水平的影响Figure 4 Effect of Cdx2 siRNA interference on levels of Cdx2,Sox2 and Nanog mRNA
3 讨论
Oct4和Cdx2是小鼠胚胎中ICM和TE分化的中心调节因子[2-4]。Oct4仅在囊胚的滋养层中表达,Oct4主要高表达于内细胞团[4]。Oct4可调节ICM的分化,指导胚胎干细胞的命运决定[2,9],且对于诱导分化细胞的多能性至关重要[10]。Cdx2能够通过上调各种TE特异性基因和下调Oct4与Nanog基因促进TE谱系的分化[3]。Cdx2基因缺失的囊胚不能维持囊胚腔,无法形成完整的上皮,且异常调节ICM特异性转录因子Oct4及Nanog,细胞死亡率高。但Cdx2基因缺失的囊胚能够形成ICM,且能在体外培养得到胚胎干细胞[11]。
本项研究中,我们利用RNA干扰技术探究了Oct4和Cdx2在牛胚胎早期发育中的作用。结果表明,二者对于牛ICM和TE的正常分化和健全的囊胚形成至关重要。与小鼠胚胎相比,Oct4下调对牛胚胎发育的影响更为严重。不同于小鼠胚胎,Oct4在牛TE中的表达不会消失,即使在完全扩张的囊胚阶段也是如此[12]。Oct4可能在牛胚胎的囊胚阶段发挥不同的作用,如将增殖的TE细胞保持在分化延迟状态[13]。然而,Nganvongpanit等[14]表示注射Oct4 dsRNA与否对牛胚胎在囊胚阶段的发育率没有显著影响。在本研究中,Oct4敲低对牛胚胎发育到桑椹胚阶段无影响,但囊胚的形成显著低于对照组的胚胎。关于注射Oct4 dsRNA与siRNA的胚胎发育能力不同的原因尚未明确,注射Oct4 dsRNA的胚胎需要相对更长的培养时间才能形成囊胚腔,ICM细胞的数量也明显较低[14]。这表明在囊胚形成过程中,Oct4在不同物种间可能发挥了共同或独特的作用。与Oct4不同的是,本研究发现siRNA敲低Cdx2后的胚胎,卵裂率、8-细胞期比例及囊胚率均与对照组胚胎无差别。一方面,Oct4基因可能影响了胚胎早期发育过程中的囊胚形成。另一方面,也有可能由于siRNA敲低效果减弱或消失,从而导致注射了特异性siRNA的胚胎形成囊胚。
虽然对胎盘早期发育无直接影响,敲低Oct4或Cdx2基因对早期发育相关基因的影响却是显著的。Oct4和Cdx2在小鼠胚胎干细胞中抑制彼此的表达[4]。敲低或敲除Cdx2导致Oct4在小鼠胚胎中异位表达和过度表达[3,5]。但本研究发现,单独敲低牛胚胎中的 Oct4或 Cdx2基因,另一种基因在mRNA水平上的表达受到抑制。因此,在牛胚胎中可能不存在Cdx2与Oct4相互抑制的机制。Nanog基因是Oct4的另一个靶基因,编码一种同源异型蛋白转录因子,对于维持ICM和胚胎干细胞的多能性必不可少。与Oct4不同,Nanog在形成外胚层和内胚层中起决定性作用。小鼠Nanog mRNA在致密桑椹胚阶段才表达,在ICM中维持,而在TE中迅速下降。发育中的胚胎多能性的维持还需要转录因子Sox2的活性,Sox2在调控不同细胞系中具有多种功能。小鼠Sox2转录产物在桑椹胚阶段开始表达,在ICM中维持,直至外胚层阶段。多项研究证实了Sox2在限定ICM分化中的作用[11]。本研究发现,Oct4敲低导致Sox2和Nanog mRNA水平显著下降,Cdx2敲低对Sox2和Nanog mRNA水平无影响。这说明Oct4通过调节各种基因控制牛胚胎的分化,而Cdx2在牛胚胎的分化中可能是通过调控Oct4或其他基因发挥作用。