油松组织培养及再生体系建立研究
2021-01-16费昭雪刘莉丽彭少兵
费昭雪, 刘莉丽, 侯 娜, 彭少兵
(1.西北农林科技大学林学院, 杨凌 712100; 2.贵州省林业科学研究院, 贵阳 550005)
油松(PinustabulaeformisCarriere.)为松科松属常绿乔木,树高可达30 m以上,胸径可达1 m[1]。油松适应性强,广泛分布于我国东北、西北、华中、西南等地区[2-4]。油松材质致密耐用,是建筑、造船及家具等的良好用材[5-8]。油松的用途广泛,市场需求量逐年增加,野生资源已经难以满足需求,主要依靠人工种植,因此,油松苗木供应亟待一种快速繁殖的方法。植物组织培养技术具有高效快速、遗传稳定的优点成为了油松繁殖的有效途径[9-11]。试验以油松组织培养关键技术为核心进行研究,旨在为相关的生产研究提供一定的依据。
1 实验材料与方法
1.1 实验材料
于2018年春季采集一年生健壮、无病虫害的油松嫩枝作为外植体,在洗洁精水中漂洗3~5 min,洗去材料表面的泥土和灰尘,然后用自来水进行流动冲洗,时间30 min[12]。清洗中修剪过长或过大枝条,随后用75%酒精消毒30 s,0.1%升汞消毒10 min,最后用无菌水冲洗3~5次。
1.2 实验方法
1.2.1外植体预处理1.2.2油松外植体的芽分化培养
研究油松的分化,可以为遗传体系建立和多倍体等实验做铺垫,另外,快速繁殖还能够缩短育种周期,提高药用成分的含量。实验以MS为基本培养基,加入30.0 g·L-1蔗糖,5.0 g·L-1琼脂,采用正交实验法设计6-BA、TDZ和NAA 三种激素的不同浓度和配比,添加到培养基中[13-16]。分裂素(6-BA)设置浓度分别为1.0、2.0、3.0 mg·L-1,TDZ设置浓度分别为0.01、0.05、0.10 mg·L-1,生长素(NAA)设置浓度分别为0.05、0.1、0.2 mg·L-1。按照正交试验设计9组不同激素浓度配比和1组空白对照处理。实验所用材料为健壮无菌苗,茎段(不带叶腋)切成长约1 cm,平铺于培养基中,每瓶4枚,每组10瓶,重复3次。培养条件同上。在培养期间定期观察并做好分化率和生长情况的记录。
1.2.3油松外植体的芽增殖培养
实验在MS培养基的基础上,辅以蔗糖(30.0 g·L-1),琼脂(5.0 g·L-1),以6-BA、TDZ和NAA三种激素浓度及配比为影响因素,采用正交实验进行设计。分裂素6-BA设0.1、0.3、0.5 mg·L-1等3个浓度,TDZ设0.01、0.05、0.10 mg·L-1等3个浓度,生长素NAA设0.01、0.05、0.10 mg·L-1等3个浓度。选取消毒备用的材料,切取长约1 cm带叶腋的茎段和长约2 cm的顶芽。茎段平铺于培养基表面,每瓶4枚,每组10瓶,重复3次;顶芽插入培养基,每瓶4株,每组10瓶,重复3次。培养条件同上。在培养期间定期观察并做好增殖情况、平均苗高和生长情况的记录。
1.2.4油松不定芽生根培养
以1/2 MS(大量元素及钙盐用量减半,其余母液用量不变)为基本培养基,附加30.0 g·L-1蔗糖,5.0 g·L-1琼脂,采用正交实验设计研究IBA、NAA 2种激素的不同浓度和活性炭添加量对油松生根的影响。生长素(IBA)和NAA浓度梯度均为0.1、0.2、0.3 mg·L-1,活性炭设0.1、0.2、0.3 g·L-1等3个浓度。实验选取健壮的无菌苗为材料,切取长约2 cm的顶芽接入培养基中,每瓶4株,每组10瓶,重复3次。培养条件同上。在生根培养期间定期观察并记录生根情况,统计生根数和测量根长。
1.3 数据分析
试验数据采用SPSS 19.0、Excel 2007软件进行统计分析。
2 结果与分析
2.1 不同培养基对油松芽分化的影响
不同培养基对油松茎段的分化有明显影响。从表1可以看出,用油松的茎段来分化,对照组处理(ck)分化芽数最低,为0;8号组合的分化芽数最高,为3.67。但是8号处理组合的油松长势欠佳,有的出现玻璃化现象,不利于后期的继代繁殖。其中4号处理组合和6号处理组合虽然不是分化芽数最高的,但是其苗高和生长情况在本实验中是最好的,且无玻璃化现象。4号处理组合的分化芽数(3.49)比6号组合的分化芽数(3.15)高。综上所述,4号处理组合为油松茎段最佳分化培养基,即MS+2.0 mg·L-16-BA+0.05 mg·L-1TDZ+0.05 mg·L-1NAA。

表1 不同培养基对油松茎段分化的影响
2.2 不同培养基对油松芽增殖的影响
2.2.1不同培养基对油松茎段芽增殖的影响
不同种类激素浓度的配比对油松茎段的增殖效率有明显影响(图1)。从表2可以看出,没有添加激素的组合(ck)增殖系数最低,为1.75。A 2号处理组合的增殖系数为5.33,是实验组合中增殖系数最高的,并且增殖的植株长势粗壮。虽然A 4号处理组合培养基增殖的植株长势粗壮,且增殖系数达4.00,但其平均苗高为3.0 cm,较A 2号处理组合的低。A 1号和A 6号处理组合增殖系数也到达了4.00,但是长势不如A 2号处理组合,且存在一定的玻璃化现象。综合评定,A 2号处理组合的增殖系数、平均苗高、生长情况是实验组合中最好的,综上所述,油松带叶腋茎段的最佳增殖培养基为A 2号处理组合MS+0.1 mg·L-16-BA+0.05 mg·L-1TDZ+0.05 mg·L-1NAA。

注:A为外植体;B、C为愈伤组织;D为油松芽。

表2 不同培养基对油松茎段增殖的影响
2.2.2不同培养基对油松顶芽增殖的影响
不同种类激素浓度的配比对油松顶芽的增殖有明显影响。从表3可知,以油松顶芽进行增殖,对照处理(ck)增殖系数最低,为1.33。A 8号组合的增殖系数最高,为4.67。但是A 8号组合的油松长势欠佳,存在一定比例的玻璃化现象,不利于后期的继代繁殖。其中A 4号组合和A 6号组合虽然不是增殖系数最高的,但是其苗高和生长情况在本实验中均是最好的,且无玻璃化现象。A 4号组合的增殖系数(4.29)比A 6号组合的增殖系数(4.00)高,综上所述,油松顶芽的最佳增殖培养基为A 4号组合MS+0.3 mg·L-16-BA+0.05 mg·L-1TDZ+0.01 mg·L-1NAA。
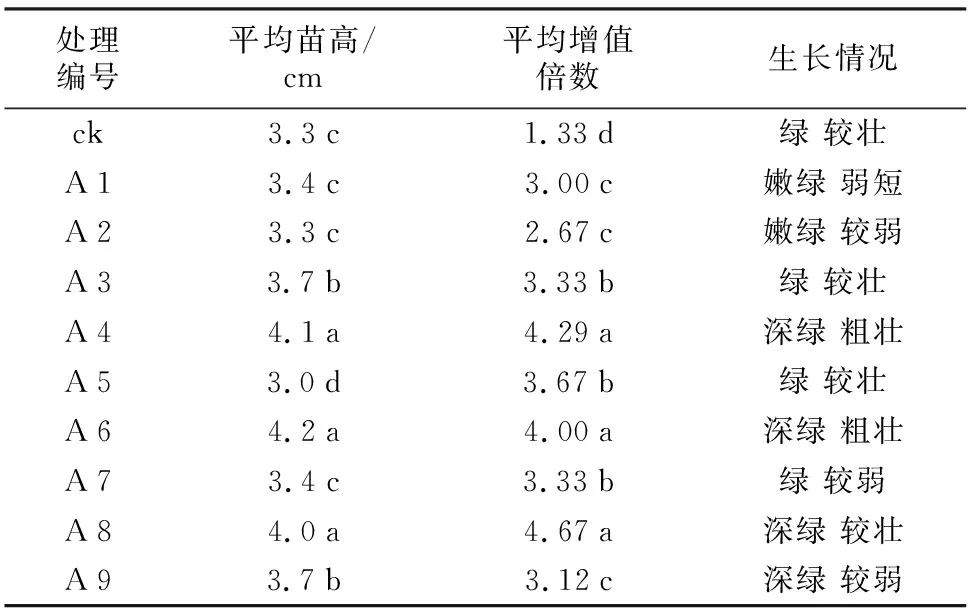
表3 不同培养基对油松顶芽增殖的影响
2.3 生根培养
在生根培养的30 d里,不同时间段植株生根株数不同,在第10~15天生根植株增加得最多,平均为11株,第15天后生根的株数逐渐减少。分析其原因为油松需要萌发根原基才能顺利完成生根,其生根方式为愈伤组织生根。不同的单株所需形成愈伤组织的需求不同,导致某些植株会优先长出根,导致植株生根株数出现不规则递增的现象。
试验的总平均生根率为66.7%,由表4可看出,对照组(ck)的生根率最低,而B 1~B 9号处理组合的生根率为58.3%~91.7%,可以得出油松在激素的诱导下易于生根,无激素生根较困难。B 1~B 3,B 4~B 6,B 7~B 9号处理组合中生根率有下降的趋势,以3个编号为一组进行分析,可以发现, 在IBA浓度保持不变的情况下,生根率随NAA浓度升高呈下降趋势,生根率最高的是B 7号处理组合(91.7%),平均根长最长,为0.6 cm,然其苗高最低,为3.1 cm。分析原因为较高浓度的IBA和较低浓度的NAA对油松生根有良好的促进作用,因其有良好的诱导生根效果,但对植株营养器官的生长效果有所减弱,导致植株高度总体偏低。就活性炭添加量而言,B 1、B 6、B 8号处理组合活性炭添加量为0.1 g·L-1,其平均生根率最低,为66.7%;B 2、B 4、B 9号处理组合活性炭添加量为0.2 g·L-1,其平均生根率为77.8%; B 3、B 5、B 7号处理组合活性炭添加量为0.3 g·L-1,其平均生根率为77.8%。因此,活性炭添加量在0.2~0.3 g·L-1范围内时可促进生根。综上,活性炭作为油松最佳生根培养基为B 7号处理组合。即1/2 MS+0.3 mg·L-1IBA+0.1 mg·L-1NAA+0.3 g·L-1。

表4 油松生根数据统计
3 结论与讨论
3.1 结 论
油松嫩枝优化后的分化培养基是MS+2.0 mg·L-16-BA+0.05 mg·L-1TDZ+0.05 mg·L-1NAA。其诱导分化率达4.49%,诱导分化的不定芽颜色浓绿,长势较粗壮。
带腋芽油松茎段组织培养增殖生长最佳培养基为MS+0.1 mg·L-16-BA+0.05 mg·L-1TDZ+0.05 mg·L-1NAA。增殖植株生长粗壮,颜色浓绿,增殖系数达5.33;油松顶芽组织培养增殖生长最佳培养基为MS+0.3 mg·L-16-BA+0.05 mg·L-1TDZ+0.01 mg·L-1NAA。在此条件下增殖植株生长粗壮,颜色浓绿,增殖系数达4.29。1/2 MS+0.3 mg·L-1IBA+0.1 mg·L-1NAA+0.3 g·L-1活性炭为油松生根的最佳培养基。此条件下植株生长粗壮,生根条数在5条左右,生根率达91.7%。
3.2 讨 论
MS+0.3 mg·L-16-BA+0.05 mg·L-1TDZ+0.01 mg·L-1NAA培养基能够较好地呈现油松组织生长情况,可作为增殖生长的最佳培养基,在此条件下增殖植株生长粗壮,颜色浓绿,增殖系数为4.29。实验中也对B 5培养基对油松的增殖效果进行了研究,结果显示,在MS培养基的增殖效果普遍好于B 5培养基。试验中还发现,选用油松茎段为材料进行增殖时,会逐渐膨大产生愈伤组织,培养一段时间后,愈伤组织开始分化出绿色的芽点,随后分化出芽,因此认为,油松更适合于通过产生愈伤组织来增殖扩繁。
实验还发现,适宜的培养基种类和激素配比对组织培养过程中诱导分化、增殖培养和生根培养均有促进作用。有学者也得到类似的结论[16]。在试验中也证明了这一点,加激素的处理组明显比未加激素的对照组的效果好。此外,在培养过程中,会出现增殖植株玻璃化的现象。引起试验材料玻璃化是由于渗透势不均衡造成的,当植物体内的渗透势低于培养基较多时,植物组织会从培养基中大量吸水,来促使两侧的渗透势接近。结果导致培养的材料水分含量较高,呈现一种透明或半透明的状态,称之为玻璃化现象[17]。玻璃化的植株长势弱,不能用作进一步增殖和生根的材料,对实验结果也有一定的影响。在培养过程中发现,不能完全凝固的培养基中容易出现玻璃化现象,一些激素浓度的配比也会导致一定程度的玻璃化。综合分析来看,导致玻璃化现象的因素较多,比如培养材料、培养环境、培养基成分、继代次数、植物激素等,但是在所查阅的文献中未见到对油松组织培养实验中玻璃化现象的讲述。
