不同基因型冬小麦穗粒数与粒重生理差异分析
2021-01-14刘雨晴孙娜娜高艳梅姚春生王志敏张英华
刘雨晴 孙娜娜 高艳梅 张 震 刘 洋 姚春生 王志敏 张英华
(中国农业大学 农学院,北京 100193)
小麦是重要的粮食作物,其全球消费量占禾谷类作物产量的30%左右[1]。提高小麦产量对于满足人类需求和确保粮食安全具有重要意义。小麦的产量可以表示为穗数、穗粒数和粒重三因素的乘积,穗数对产量起主导作用。通过提高密度进而增加穗数已被证明是提高小麦产量的有效途径[2]。长期以来的品种改良和高产栽培实践主要依靠单位面积粒数的增加[3],未来进一步挖掘和提高产量潜力需要继续增加穗粒数并打破粒数与粒重的负相关。已有研究表明,培育穗粒数高的品种、或者延长籽粒建成期[4-5]、或者促进穗部对积累同化物的利用可以提高产量[6]。因此,阐明穗粒数的形成过程及粒重增重机理及其影响因素具有重要意义。
小麦的实际穗粒数与潜在穗粒数(可分化的小花总数)相差甚大,主要决定于已分化小花的结实粒数,而一个小花能否形成种子主要取决于小花自身的质量与其接收、储存的有效同化物量,即同化物的供给和库的活性。王志敏等[7]研究表明,小麦开花期穗部干重与最终的穗粒数呈极显著正相关。开花期的穗干重取决于开花前穗部生长持续期及穗重增长率。开花前约20 d是决定开花期穗干重的关键时期,也是调控穗粒数的“敏感期”,此时期的物质积累量占开花期穗重的90%左右[7]。因此,增加此时期穗的同化物积累量对于提高穗粒数具有十分重要的意义。
在许多植物中,花的分化、发育与碳水化合物的积累紧密联系[8-9],而且开花数量受花器官接受同化物量的控制[10]。为进一步了解碳水化合物供给对穗粒数的直接作用,在离体培养条件下研究了不同蔗糖浓度处理对穗粒数的影响,结果表明开花前后不同时期降低蔗糖浓度均会降低穗粒数[11-15],使穗中果聚糖积累量大为减少,且还原糖浓度也随之下降,而蔗糖浓度变化相对较小[16]。这说明,在供源受限制条件下,穗库组织对同化物的利用速率也同时受到抑制。
一般认为,开花前同化物在穗、茎间的分配比例决定于穗、茎的相对库强度,而库器官蔗糖降解酶活性与库器官生长、物质积累有密切关系[17-18],可作为库强度的指标。正在生长的小麦上部节间对蔗糖的降解主要依赖转化酶的作用,在开花前不同时期上部节间的转化酶活性均显著高于幼穗[19]。如果说开花前的“敏感期”是穗与节间对同化物强烈竞争的时期,那么在这种竞争中,节间明显具有优势。因此,提高穗库器官蔗糖降解酶活性有利于同化物输入和调节穗粒数形成。
小麦的产量除了与穗粒数密切相关外还与粒重密切相关,粒重增加的过程即籽粒灌浆的过程。小麦籽粒灌浆的物质来源主要有两个方面:一是花前营养器官贮藏同化物的再转运,二是花后光合作用积累的同化物向籽粒的转运[20]。叶片是小麦的主要光合器官,其中以旗叶的贡献率最大,旗叶对籽粒产量的贡献率达41%~43%[21]。叶片作为光合产物的生成和暂存器官,能够较为迅速地将光合产物主要以蔗糖的形式向外运输。茎杆是小麦贮藏光合同化物的主要器官,在适宜生长条件下,光合作用形成碳水化合物的能力强,较多的光合同化物以能被再利用的非结构性碳水化合物的形式暂时贮积于茎秆中,其积累量最高可达小麦茎秆干重的40%[22-23]。茎鞘的可溶性碳水化合物(WSC)能为产量形成持续提供同化物,贡献率在20%左右[24]。在逆境条件下,小麦叶片光合减弱,同化物输出受阻,茎鞘WSC将成为籽粒主要同化物来源,其贡献率达到50%以上[25]。因此,提高花前茎秆同化物的贮藏能力和花后转运能力有利于提高冬小麦籽粒产量[26-27]。
小麦茎鞘可溶性碳水化合物主要包括果聚糖、蔗糖、葡萄糖和果糖,其中果聚糖是小麦茎鞘WSC主要的贮藏形式,最高可达茎鞘WSC的85%,蔗糖是碳水化合物运输的主要形式,占茎鞘WSC的10%[28]。当干旱发生时,叶片光合能力下降,茎鞘中贮存的果聚糖会加快分解,蔗糖浓度提高,向籽粒的运转增加,从而加快籽粒灌浆,提高籽粒灌浆强度[29-30],有利于稳定产量。蔗糖主要通过可溶性酸性蔗糖转化酶(SAI)和蔗糖合酶(SS)被分解利用。转化酶催化蔗糖水解生成果糖和葡萄糖,是不可逆酶;蔗糖合酶是存在于细胞质中的可溶性酶,既可催化蔗糖合成又可催化蔗糖分解,但在茎鞘中主要起分解蔗糖的作用[31]。Gupta等[32]研究发现,干旱条件下抗旱品种的茎鞘同化物转运率高,蔗糖合酶的活性较高,通过库积累物的卸载促进库的强度,进而增加同化物向籽粒的转运,维持籽粒灌浆强度。
已有研究多是关于籽粒建成期和籽粒灌浆期干物质积累与糖代谢酶活性与穗粒数[7-19]和粒重[20-32]的关系,但关于不同穗型冬小麦穗粒数和粒重生理机制的研究鲜有报道。本研究以不同穗型冬小麦为材料,测定穗粒数决定时期器官干物质积累、蔗糖含量以及蔗糖相关代谢酶活性的差异以揭示不同穗型冬小麦籽粒建成生理差异;同时考察不同穗型冬小麦籽粒灌浆特性,旨在探讨冬小麦籽粒增重的影响因素,以期为提高冬小麦产量提供参考。
1 材料与方法
1.1 试验材料及处理
试验在中国农业大学科学园进行,选用大穗基因型(JS)、中穗基因型(JM22)和小穗基因型(XS)冬小麦品种为材料,于2013年10月3日播种,正常水肥管理。在开花前15 d(四分体时期,旗叶与倒二叶叶耳间距4~6 cm,)、开花前8 d(花粉粒形成期)、开花期、花后10、15、20、25和35 d(成熟期)测定植株干物重,植株分为旗叶、倒二叶、倒三叶、余叶、上二茎(穗下茎和倒数第二茎)、余茎和穗。干样粉碎后用于测定各器官糖含量。在四分体时期、花粉粒形成期、开花期、花后5、10、15和20 d取不同穗型冬小麦上二茎、余茎、中部小穗的穗颖、强势籽粒(每小穗第1和第2花位粒)和弱势籽粒(每小穗除了第1和第2花位的花位粒),测定可溶性酸性蔗糖转化酶(SAI)(简称转化酶)和蔗糖合酶(SS)活性。取样时需用锡箔纸包裹植株,并迅速置于液氮中冷冻,保存在-80 ℃ 超低温冰箱中待测酶活性。
籽粒灌浆分强势粒和弱势粒,于花后10、15、20、25和35 d进行取样,测定籽粒干重。成熟期考察不同穗位强势粒、弱势粒粒数和粒重以及穗粒重。
1.2 测定指标与方法
1.2.1干物质测定
取回的样品分叶片、茎杆和小穗置于牛皮纸袋中,105 ℃杀青30 min,80 ℃烘干48 h至恒重。计算器官同化物转运效率和对籽粒产量的贡献率。
器官同化物转运效率=(开花期干物质量-成熟期干物质量)×100%/开花期干物质量;器官同化物转运对籽粒产量的贡献率=(开花期干物质量-成熟期干物质量)×100%/籽粒产量。
1.2.2蔗糖含量测定
蔗糖含量测定采用间苯二酚法测定[33]:准确吸取1.0 mL待测液,加入0.2 mL 2 mol/L NaOH溶液,沸水浴10 min分解果糖和葡萄糖等还原糖(主要包括葡萄糖、果糖、半乳糖、乳糖和麦芽糖)。冷却后,加入2.0 mL 30% HCl 混匀后80 ℃水浴 10 min,加入1.0 mL 1% 间苯二酚,轻轻摇匀后 80 ℃ 水浴显色10 min,在480 nm波长下测定样品OD值。
钾肥市场挺价心态持续,市场供应量较少,价格将维持坚挺。硫酸钾烟草招标需求仍待释放,后期将对市场需求及价格起到一定利好,价格将维持坚挺,并伴有上行可能。
1.2.3蔗糖代谢酶活性测定
参考Nakamura[34]和Zinselmeier[35]的配方。称取保存于超低温冰箱中的样品0.5 g,加3.0 mL提取液,在研钵中用液氮研磨,转入10 mL离心管中,再用2.0 mL提取液润洗研钵,继续转入离心管中,低温环境中静置20 min后在4 ℃低温离心机中以15 000 r/min离心10 min,取上清液低温保存,可用于测定转化酶和蔗糖合酶。
1.3 数据处理及统计分析
试验数据采用Excel 2010进行原始数据的处理并制作图表,用SPSS 17.0软件进行统计分析,差异显著性分析采用多重比较法(通过不同水平均值之间的两两配对比较,来检验各个总体均值之间是否存在显著差异的假设检验方法)。
2 结果与分析
2.1 不同基因型冬小麦植株形态特征与产量构成
由表1可知,除穗宽在基因型间差异不显著,其他各形态指标均存在差异显著。株高变化范围在85.5~94.8 cm,JM22显著低于JS和XS;JS的穗长和穗面积显著高于XS和JM22。JS的强势粒数、弱势粒数和单穗总粒数均显著高于XS和JM22,JS单穗总粒数显著高于其他基因型的主要原因是其具有更多的弱势粒。各基因型粒重均以强势粒高于弱势粒,JS的强势粒重和平均粒重分别显著高于XS和JM22,穗粒重以JS显著高于XS和JM22,而XS和JM22之间无显著差异。JS具有更高的单穗粒重优势,与其较大的穗长、穗面积、穗粒数和强势粒重显著相关。
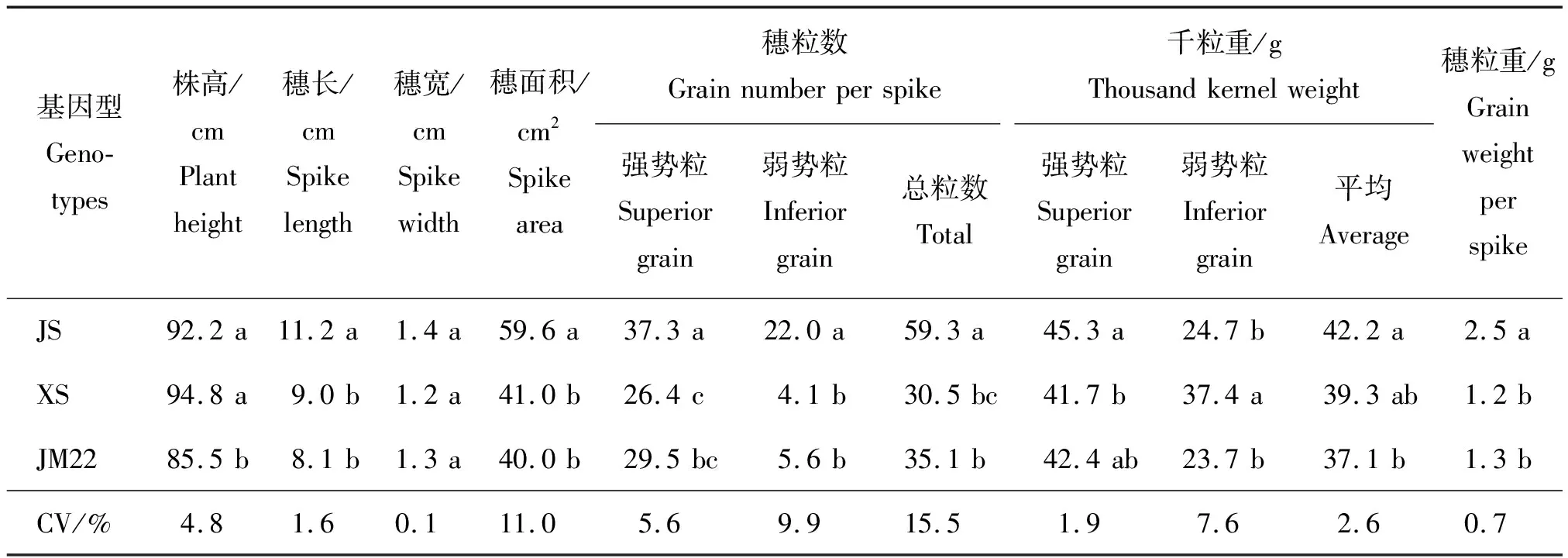
表1 不同基因型冬小麦成熟期形态特征及粒重与穗粒数
2.1.2不同基因型冬小麦不同穗位强、弱势粒粒数和粒重的变化
由图1可知,各基因型的强势粒和弱势粒粒数总体表现为中间穗位(第8~15小穗)多,两边穗位(下部第1~7,顶部第16~22小穗)少的趋势;粒重总体表现为中下部穗位高、两边穗位低的趋势。由表2可知,各基因型冬小麦强势粒的中间穗位粒数差异不显著,而JS中部穗位弱势粒的粒数显著高于XS和JS,顶部穗位仅JS存在弱势粒。JS的总粒数显著高于XS与JM22,主要是由于JM22和XS顶部强势粒的粒数少且整体弱势粒发育不良且顶部弱势粒完全败育。各基因型冬小麦的强势粒重从第9小穗开始随着穗位的增高而降低,JS相比XS和JM22下降速度相对较慢;各基因型弱势粒的粒重波动较大,JM22和XS分别从中部第14和第13小穗位籽粒已经完全败育,而JS直至第21小穗位仍存在有效籽粒。JS的穗粒重显著高于JM22和XS,主要由于JS顶部强势粒的粒数较多、粒重较高以及不同部位弱势粒的粒数均较多且顶部弱势粒粒重更大。
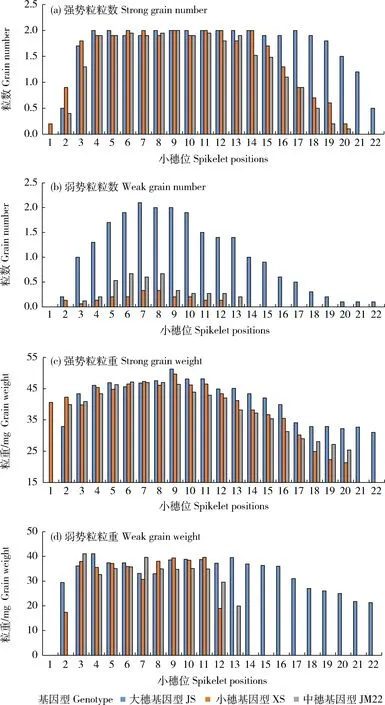
图1 不同基因型冬小麦不同穗位强、弱势粒单株粒数和单株粒重的变化
2.2 不同基因型冬小麦干物质积累变化
2.2.1干物质积累的空间动态分布
由图2可知,JS各时期的单株干物质积累量都显著高于XS和JM22,且XS和JM22之间差异不显著。通过分析不同时期干物质分配特征可以看出,3个不同基因型的冬小麦从四分体时期(花前 15 d 左右)营养器官的干物质所占比例逐渐降低,而穗的干物质所占比例在逐渐增高,且成为整株干物质所占比例最大部分。花粉粒形成期(花前8 d左右)各基因型倒三叶和余叶干物质分配比例下降幅度大于旗叶和倒二叶,花后开始旗叶和倒二叶干物质比例也开始下降,说明叶片同化物输出优先从中下部叶片开始,生育后期旗叶和倒二叶光合作用维持时间较长,同化物转运最晚。花前8 d后上二茎干物质比例仍在增加,花后10 d左右达最高,花后25 d开始显著下降,而余茎干物质比例从花前15 d后不断下降,说明中下部茎鞘同化物转运较早。
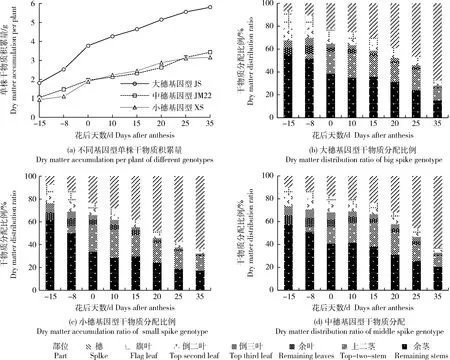
图2 不同基因型冬小麦单株干物质积累动态变化及不同时期各器官干物质分配比例
2.2.2同化物转运特征
由表2可知,营养器官中JM22的上二茎同化物没有转运,其他基因型的上二茎和各基因型的余茎和各部位叶片同化物都发生一定程度的转运,且叶片的同化物向籽粒的转运率高于茎鞘,除JM22的倒二叶的转运率略低于旗叶,其他中下部叶片的转运率都高于旗叶。营养器官同化物转运对籽粒产量的贡献中,JS的旗叶、上二茎和余茎对籽粒的贡献率显著高于XS,JM22的倒三叶和余叶贡献率显著高于JS,但其上二茎对籽粒产量没有贡献,而上二茎积累的同化物多,若不向籽粒转运,则是一个强的竞争库,对提高产量不利。在JS中,各叶层和茎鞘同化物转运对籽粒都有一定贡献,以茎鞘、旗叶和倒二叶贡献较大,余茎同化物转运率和贡献率都显著高于XS和JM22,可能是其单穗粒重较高的一个原因。综合来看,营养器官同化物转运对籽粒产量的贡献由高到低为JS>JM22>XS。

表2 不同基因型冬小麦不同穗位强、弱势粒的粒数

表3 不同基因型冬小麦营养器官同化物向籽粒的转运率与贡献率
2.3 不同基因型冬小麦籽粒灌浆特性
如图3所示,3个基因型冬小麦花后强势粒重和弱势粒重都呈现先缓慢增加,后快速增加,在灌浆后期再缓慢增加的“慢-快-慢”的增重趋势。整个灌浆期强势和弱势的粒重由高到低均为JS>JM22>XS,且各时期强势粒重均高于弱势粒重。各基因型冬小麦强、弱势籽粒灌浆速率呈现单峰抛物线的变化趋势,先升高后降低,且强势粒灌浆速率高于弱势粒的灌浆速率。强势籽粒灌浆速率由高到低为JS>JM22>XS;此外,JS强势粒灌浆速率高峰出现在花后20 d左右,而JM22和XS强势粒灌浆高峰出现在花后25 d左右,可见,大穗基因型灌浆高峰出现早于中、小穗基因型。弱势粒灌浆速率也表现为JS>JM22>XS,最大灌浆速率出现的时间相差不大,都出现在花后25 d左右。

图3 不同基因型冬小麦强、弱势粒籽粒增重以及灌浆速率变化
2.4 不同基因型冬小麦蔗糖积累与转运特征
2.4.1蔗糖积累量的空间动态变化
由图4可知,不同基因型冬小麦在四分体时期后蔗糖积累量是先升高后降低的过程,但各器官蔗糖积累变化时间各不相同。JS的叶片和茎鞘蔗糖积累量在花后20 d达峰值,之后下降,穗蔗糖积累量从花后10 d开始逐渐下降。XS的叶片和茎鞘蔗糖积累量都于花后10 d达高峰,之后下降,穗蔗糖积累量也于花后10 d开始逐渐下降。JM22的余茎蔗糖积累量于花后10 d达高峰,上二茎于花后 20 d 达高峰,穗蔗糖积累量从花后10 d开始呈波动式下降。

图4 不同基因型冬小麦各器官蔗糖积累量以及分配比例的动态变化
2.4.2蔗糖的分配特征
由图5可知,穗器官蔗糖分配比例呈先降低后升高趋势,茎鞘和叶片蔗糖分配比例呈降低趋势,且茎鞘分配比例显著高于叶片。不同基因型间各器官蔗糖分配特征有一定差异。JS从花后10~25 d上二茎和余茎蔗糖分配比例逐渐增加,而穗分配比例逐渐减少,花后35 d茎鞘蔗糖分配比例降低50.81%,穗分配比例提高51.24%。XS上二茎蔗糖分配比例花后逐渐下降,但降幅较小,余茎蔗糖分配比例先升高后降低,峰值出现在花后25 d,穗分配比例花后25 d前变化不大,花后35 d增加23.59%。JM22花后上二茎和余茎蔗糖分配比例都呈现先升后降的趋势,峰值出现在花后25 d,穗分配比例呈先降后升趋势,花后35 d增加47.10%。成熟期穗蔗糖分配比例由高到低为JS>JM22>XS,茎鞘则相反,说明大穗基因型茎鞘蔗糖向籽粒运输更多。

图5 不同基因型冬小麦各器官蔗糖分配比例的动态变化
2.5 不同基因型冬小麦蔗糖合酶和转化酶活性的空间动态特征
由表4可知,JS和XS上二茎蔗糖合酶活性在花粉粒形成期达高峰,而JM22在四分体时期为高峰,开花期上二茎蔗糖合酶活性大幅度降低,开花期后各基因型冬小麦的上二茎蔗糖合酶活性呈先降低后升高再降低的趋势,且在灌浆前期(开花期至花后15 d)JS的上二茎蔗糖合酶活性显著高于XS和JM22。各基因型冬小麦余茎蔗糖合酶活性从四分体时期到开花期呈降低趋势,开花期后先升高再降低,且开花期后JS的余茎蔗糖酶活性除花后15 d,均显著高于XS和JM22,且稳定维持在20 mg/(g·h)以上的活性水平。开花后JS和XS的穗颖蔗糖合酶活性呈先上升后下降的趋势,而JM22呈持续下降的趋势。在花后10 d各基因型强、弱势粒蔗糖合酶活性均达高峰,且弱势粒活性高于强势粒,XS和JM22从花后10 d到花后20 d强、弱势粒蔗糖合酶活性持续下降,花后25 d有所回升,而JS从花后 10 d 到花后15 d强、弱势粒蔗糖合酶活性下降,花后20 d即开始回升且回升幅度较大,花后25 d又下降,但花后20 d和花后25 d JS蔗糖合酶活性均显著高于XS和JM22。由此可见,JS在灌浆前期拥有更强的上二茎蔗糖合酶活性,在灌浆后期拥有更强更稳定的余茎和籽粒蔗糖合酶活性,为提高籽粒的灌浆速率奠定了基础。

表4 不同基因型冬小麦各器官蔗糖合酶活性
由表5可知,各基因型冬小麦上二茎蔗糖转化酶活性开花期前显著高于开花期后,且花粉粒形成期达高峰,开花期后蔗糖转化酶活性变化趋势与蔗糖合酶活性相同,亦呈先降后升再降的趋势,且JS在花后10 d和花后15 d上二茎蔗糖转化酶活性显著高于XS和JS,花后20 d和花后25 d的JS和XS上二茎转化酶活性都显著高于JM22。四分体时期JS余茎蔗糖转化酶活性显著高于XS和JM22,且达高峰,之后随着生长发育进程呈波动下降趋势,花后20 d和花后25 d的JS余茎蔗糖合酶活性显著高于XS和JM22。穗颖蔗糖转化酶活性在整个测定时期呈先升高后波动下降趋势,其中JM22在开花期后穗颖蔗糖转化酶活性显著高于JS和XS且稳定在相对较高趋势。籽粒蔗糖转化酶活性呈下降趋势且下降幅度由大到小为XS>JM22>JS,JS在花后10 d显著低于XS和JM22,花后15 d和20 d显著低于JM22,但在花后25 d显著高于XS和JM22。由此可见,JS在灌浆后期上二茎、余茎和籽粒具有更强的蔗糖转化酶活性,可能有利于籽粒灌浆速度的维持。

表5 不同基因型冬小麦各器官蔗糖转化酶活性
2.6 干物质、蔗糖含量和蔗糖代谢酶活性与穗粒数和粒重的相关性
由表6可知,四分体时期和开花期旗叶、倒二叶和茎的干物质量与成熟期穗粒数呈正相关,未达显著水平,开花期上二茎和穗部干物质量与穗粒数呈正相关,未达显著水平,而花前除了四分体时期的茎、开花期的上二茎和穗,其他器官的干物质与粒重的相关系数都不如穗粒数高。开花前旗叶、倒二叶、余叶蔗糖含量与穗粒数和粒重都呈负相关,余茎和上二茎蔗糖含量与穗粒数和粒重呈正相关,未达显著水平。在四分体时期茎鞘蔗糖合酶活性和转化酶活性与穗粒数和粒重呈显著正相关。开花期上二茎蔗糖合酶活性与穗粒数和粒重都呈显著正相关,而转化酶活性与粒重呈显著负相关。穗部蔗糖合酶活性和转化酶活性在四分体时期与穗粒数和粒重呈显著正相关,在开花期与穗粒数和粒重都呈显著负相关。
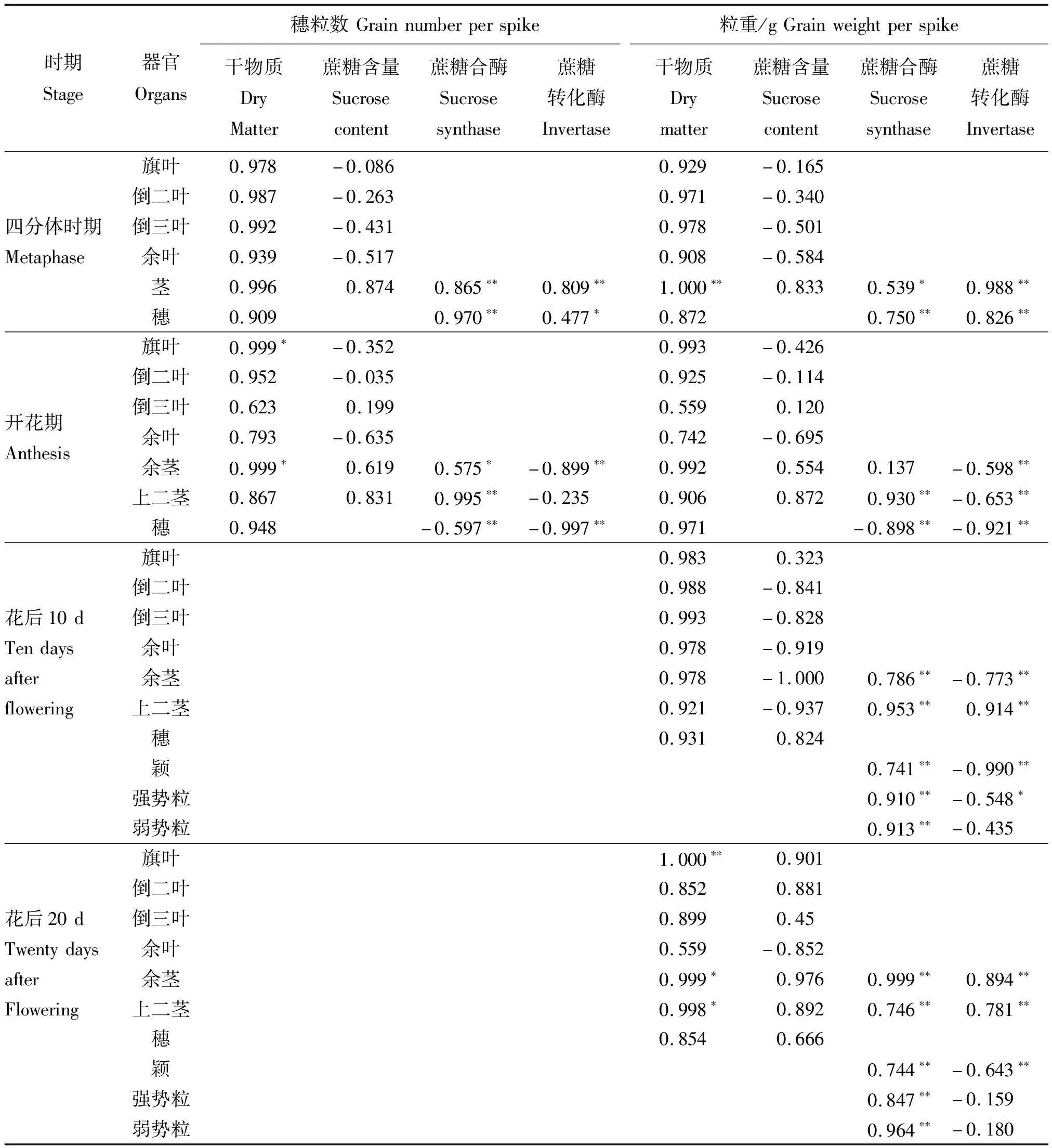
表6 开花前后干物质、蔗糖含量、蔗糖代谢酶活性与穗粒数和粒重的相关分析
花后10 d除旗叶和穗,其他器官蔗糖含量都与粒重呈负相关,未达显著水平,花后20 d仅有余叶蔗糖含量与粒重呈负相关,其他器官都呈正相关,未达显著水平。花后各器官蔗糖合酶活性都与粒重呈显著正相关。花后10和20 d上二茎和花后20 d余茎转化酶活性与粒重呈显著正相关,花后10 d余茎、穗颖和花后强势粒转化酶活性与粒重呈显著负相关。
3 讨 论
3.1 开花前干物质积累与分配对穗粒数的影响
穗粒数是小麦重要的产量构成因素,探明小麦穗粒数形成机理及关键影响因素对于提高小麦产量潜力具有重要意义。小麦小穗数通常有16~18个,每个小穗大约有11个小花,每个穗中有140多个小花,但最终发育的不超过40个[36]。研究发现,所有小花在抽穗前起始[37],只有穗抽出时完成所有花器官发育的小花能进一步发育。有研究表明大穗基因型分化小穗和小花数多,穗粒数高,多穗基因型不孕小穗数多,穗粒数相对低些,主要由于大穗基因型每穗发育小花数多于多穗型,除下部第一小穗外,各小穗之间下位小花发育较为均衡,每穗成粒数多,而多穗基因型下部小穗小花发育速度显著地慢于中部小穗小花,发育差距的逐渐加大是导致多穗基因型小花退化多和不孕小穗多的重要原因[38]。
旗叶抽出到开花这段时期,茎秆伸长与小花发育对同化物竞争激烈,这段时期内穗干重越大,小花死亡率越低,开花期可育小花数越多,成熟期籽粒数也越多[39]。有研究表明,开花期的穗干重与最终的穗粒数存在极显著正相关[39]。从开花期穗部同化物在穗器官中的分配看,小花器官(子房、雄蕊和内外颖)重占穗重比率为60%~70%,随穗重增加,此比率也相应增加,从而导致较多的可育小花数[40]。显然,植株向穗器官投入的同化物量决定小花的成粒数。因此,提高小花的营养供应,是增加可育小花数和提高穗粒数的关键。本研究发现,大穗基因型(JS)强势粒和弱势粒都较多,尤其弱势粒数显著高于小穗基因型。从同化物积累分配来看,四分体时期和花粉粒形成期大穗基因型上二茎同化物分配比例小于中、小穗基因型,而开花期穗同化物分配比例高于中、小穗基因型。开花期穗和上二茎是主要生长器官,对同化物竞争激烈,大穗基因型相对较低的茎鞘分配比例和相对较高的穗分配比例,可能对于更多的小穗分化和小花结实有重要影响。
3.2 开花前碳水化合物代谢对穗粒数的影响
在有效的同化物资源中,碳水化合物是主要物质成分。因此,麦穗的生长必然与碳水化合物的代谢有密切的关系。在旗叶伸出以后,作为库器官的茎秆,其节间处于不同的生长阶段,可区分为2种不同类型的“库”:上部2个节间正处于伸长期,可称为“生长库”;基部2个节间已停止伸长,输入其中的同化物主要用于贮藏,可作为“贮藏库”;第3节间正由“生长库”向“贮藏库”过渡。对正在生长的穗下第2节间的碳水化合物分析表明,其中的水溶性碳水化合物(WSC)主要是还原糖(最高可占总WSC的80%以上),其次是蔗糖,果聚糖很少积累。但随伸长生长临近结束,果聚糖的积累开始增加,而还原糖浓度下降。测定节间的蔗糖降解酶活性表明,正在伸长的节间可溶性酸性转化酶(SAI)活性很高,其活性最高值达同期幼穗SAI活性的1.5倍以上;蔗糖合酶活性很小[19]。因此可认为,正在生长的节间对蔗糖的降解主要依赖于转化酶,较高的转化酶活性促进节间还原糖浓度的上升,为节间的迅速生长提供大量还原糖基质。
本研究发现,开花期大穗基因型茎鞘的蔗糖积累量高于中、小穗基因型;相关分析显示,四分体时期到开花期蔗糖合酶活性与穗粒数呈显著正相关,随着生育进程推进相关系数有所下降。四分体时期茎鞘转化酶活性与穗粒数也呈显著正相关,但相关系数低于蔗糖合酶。可见,开花前茎鞘一方面与穗争夺物质,另一方面对籽粒建成也有正向调控作用。
3.3 开花后干物质积累与花前同化物转运对粒重的影响
已有研究表明,花前茎鞘同化物对最终籽粒贡献为25%~33%[41-42],干旱后贡献率会提高到80%以上[43-44]。本研究发现,大穗基因型的强、弱势粒灌浆速率都高于中、小穗基因型,成熟期粒重也较高。开花后各基因型倒三叶和余叶干物质分配比例下降幅度大于旗叶和倒二叶,花后25 d旗叶和倒二叶干物质分配比例才开始显著下降,说明叶片同化物输出优先从中下部叶片开始,但从同化物运转对籽粒产量的贡献来看,旗叶和倒二叶贡献率高于中下部叶片。茎鞘同化物输出也优先从中下部开始,上二茎同化物转运量在基因型间也有显著差异,JS上二茎同化物向籽粒转运量最大,JM22的上二茎同化物没有向籽粒转运。从茎鞘同化物转运时期来看,花后25 d转运速率加快,且大穗基因型茎鞘同化物输出量大于中、小穗基因型,营养器官同化物运转对籽粒产量的贡献由大到小为大穗基因型>中穗基因型>小穗基因型。这可能是大穗基因型能维持较高灌浆速率和较大粒重的一个重要原因。
3.4 开花后碳水化合物代谢对粒重的影响
茎杆是小麦贮藏光合同化物的主要器官。本研究发现,开花后茎鞘蔗糖积累量显著高于叶片,随着生长发育的需要,蔗糖不断转化为其他的可溶性糖,其含量不断地降低。大穗基因型茎鞘蔗糖积累量在花后20 d达到峰值之后下降,中穗和小穗基因型茎鞘蔗糖积累量在花后10 d达峰值,之后下降。大穗基因型蔗糖积累量峰值出现较晚可能与库的需求有关,由于大穗基因型穗粒数较多,对同化物的需求也相对较多。从蔗糖合酶和转化酶活性来看,大穗基因型JS生育后期茎鞘蔗糖合酶活性较高,且保持较高水平,籽粒蔗糖合酶活性也高于其他2个基因型,茎鞘和籽粒转化酶活性也相对较高,说明JS茎鞘和籽粒蔗糖代谢活性都较高,为高籽粒灌浆速率的维持奠定了基础。相关分析表明,花后茎鞘、穗颖和籽粒蔗糖合酶活性与粒重显著正相关,灌浆后期茎鞘转化酶活性与粒重也呈显著正相关,说明后期茎鞘碳水化合物分解及其向籽粒的转运对于维持籽粒灌浆具有重要作用。
4 结 论
本研究对不同穗型冬小麦籽粒建成和籽粒灌浆过程中干物质积累、分配、同化物转运和碳水化合物代谢活性以及产量构成的考察发现,这些指标在基因型间差异显著,与中小穗基因型相比,大穗基因型具有更多的穗粒数、更快的籽粒灌浆速率,更高的粒重。穗粒数更多主要由于大穗基因型开花期穗干物质分配比例更高,开花期茎鞘蔗糖积累量、蔗糖合酶活性更高,四分体时期茎鞘的转化酶活性更高;而籽粒灌浆速率更快和粒重更高则是由于大穗基因型灌浆前期上二茎和籽粒蔗糖合酶活性更高,灌浆后期茎鞘和籽粒转化酶活性更高,茎鞘和籽粒蔗糖代谢旺盛,同时茎叶同化物向籽粒的转运率和贡献率更高。说明大穗基因型冬小麦相比中、小穗基因型冬小麦拥有更强的同化物贮藏能力、供给能力以及花后转运能力和库活性。
