双能CT鉴别诊断卵巢良性和恶性肿瘤的价值
2021-01-14姜明瀚黄松盛伟华张兰花宋黎涛
姜明瀚,黄松,盛伟华,张兰花,宋黎涛
上海中医药大学附属第七人民医院医学影像科,上海 200137
卵巢癌的早期诊断仍然是改善整体预后的最关键和最具挑战性的策略之一。卵巢肿瘤新生血管的准确评估对于恶性卵巢肿瘤的有效诊断至关重要。超声检查是评估卵巢肿瘤的有效影像技术[1-2]。但单独使用超声检查进行术前诊断,其准确性尚不尽人意。MRI和CT可进一步检查不确定的附件肿块,确定病变的范围以及评估最佳手术方式的可能性。双能CT(Dual-energy CT,DECT)使用两个不同的能谱来采集数据,已开发了利用DECT对组织进行全面定量的各种应用,包括将其用作CT灌注成像的替代品。DECT可用于区分良性和恶性卵巢肿瘤[3]。然而,文献中较少有研究评估DECT的效用及其参数,包括不同能级的CT值、碘含量(IC)、水含量(WC)、有效原子序数(Zeff)以及能谱曲线斜率。有研究指出,在动脉期DECT鉴别恶性和良性卵巢肿瘤中,IC阈值为10.92(100µg/cm3),敏感性为88.9%、特异性为94.7%、曲线下面积为0.90。但该研究由于病例数较少,统计效能可能受到限制,其中两个恶性卵巢肿瘤是转移瘤,并且该研究未评估Zeff在卵巢肿瘤特征中的作用或DECT预测恶性程度的作用[4]。故此,本研究使用物质分解算法评估DECT区分良性和恶性卵巢肿瘤的能力,并预测肿瘤的级别。
1 资料与方法
1.1 一般资料 选取2017年5月至2020年3月期间在上海中医药大学附属第七人民医院接受过卵巢肿瘤初次手术切除的患者,年龄34~82岁。所有患者具有完整的DECT检查数据及组织病理学结果。记录患者年龄、术后诊断、肿瘤等级和癌抗原125(CA-125)情况。排除标准包括既往卵巢肿瘤治疗史、未进行术前DECT检查、缺乏组织病理学结果。最后,符合入组要求的患者共56例,根据病理结果分为良性卵巢肿瘤组21例,其中浆液性囊腺瘤7例、黏液性囊腺瘤4例、子宫内膜异位症4例、纤维瘤3例、成熟囊性畸胎瘤2例、浆液性腺纤维瘤1例;恶性卵巢肿瘤组35例,其中高级别26例(23例高级别浆液性癌、2例子宫内膜样癌、1例透明细胞癌)、低级别9例(5例低级别浆液性癌、2例低度恶性潜能卵巢浆液性肿瘤、1例粒层细胞瘤、1例低级别黏液性癌)。本研究为回顾性分析,豁免患者知情同意权。
1.2 CT成像 使用德国西门子公司SOMATOM Definition Flash CT对患者的盆腔进行平扫、增强扫描,扫描范围为髂嵴到耻骨联合下缘水平。患者仰卧位,足先进体位,双臂抱头。扫描参数:双源球管电压在80 kVp和140 kVp之间快速切换,开启自动管电流调节及迭代重建技术,旋转时间0.5 s,螺距0.9 mm,准直32×0.6 mm,层厚0.625 mm,视野FOV为36 cm。高压注射器注射100 mL静脉造影剂碘佛醇(恒瑞医药股份有限公司),注射速率3 mL/s。造影剂注射后,以65 s的延迟在门静脉期获得CT图像。扫描前4~6 h内口服对比剂,以充盈患者消化道,可避免束硬化伪影。评估并记录CT图像上的疾病特征,包括腹膜种植转移、腹水、胸腔积液和膈上淋巴结等情况。
1.3 CT图像后处理 参考THOMASSIN-NAGGARA等[5]的方法,对卵巢肿块进行评价。由放射科住院医师在工作站上绘制肿瘤实性部分强化最明显的部分作为感兴趣区域(ROI),ROI大小取决于肿瘤软组织成分的大小和增强部位最大的面积,避开出血或囊变区域。记录50 keV、70 keV和120 keV时的CT值和Zeff值,并记录100 µg/cm3的IC和WC(mg/cm3),结果生成Zeff直方图(用腰肌作为对照),提取的像素级数据都存储在Excel文件中以做统计分析。
1.4 统计学方法 SPSS 21.0统计软件包,计数资料用率表示。符合正态分布的计量数据以均数±标准差()表示,组间比较使用独立样本t检验,不符合正态分布则用M(P25,P75)表示,组间比较采用Wilcoxon秩和检验。Logistic回归分析影像学特征与恶性状态和肿瘤病理等级相关联。绘制受试者工作特征曲线(ROC)、曲线下面积(AUC)用于评估预测恶性卵巢肿瘤的效能,敏感性和特异性的约登指数用于预测恶性程度和等级的最佳临界值。以P<0.05为差异具有统计学意义。
2 结果
2.1 卵巢肿瘤的临床特征 52.4%的良性卵巢肿瘤患者血清CA-125水平升高>35 U/mL,85.7%的恶性卵巢肿瘤患者CA-125水平升高>35 U/mL。与恶性卵巢肿瘤比较,良性肿瘤未见腹膜种植转移、无胸腔积液、未见肿大淋巴结,见表1。

表1 卵巢肿瘤的临床特征[例(%)]
2.2 良恶性卵巢肿瘤DECT参数比较 恶性卵巢肿瘤在50 keV和70 keV的CT值、Zeff和IC方面明显高于良性卵巢肿瘤,差异均有统计学意义(P<0.05)。良性与恶性卵巢肿瘤在120 keV的CT值和WC方面比较差异均无统计学意义(P>0.05)。高级别恶性卵巢肿瘤在70 keV及120 keV的CT值和WC方面明显高于低级别恶性卵巢肿瘤,差异均具有统计学意义(P<0.05),但在50 keV CT值、Zeff和IC方面比较差异均无统计学意义(P>0.05),见表2、图1~3。
2.3 DECT参数诊断良恶性卵巢肿瘤的效能 各种参数ROC分析诊断效能见图4。与良性卵巢肿瘤相比,恶性卵巢肿瘤的Zeff和IC值更高,差异有统计学意义(P<0.05),在预测恶性卵巢肿瘤中显示出较高的诊断效率。Zeff阈值为8.19,可区分恶性和良性卵巢肿瘤,敏感性为84%、特异性为75%、AUC为0.80。IC阈值为9.81(100µg/cm3)区分恶性和良性卵巢肿瘤,敏感性为83%,特异性为75%,AUC为0.79。高级别恶性卵巢肿瘤的WC高于低级别恶性卵巢肿瘤,差异有统计学意义(P=0.015)。WC阈值为1 021.13 mg/cm3,区分高低级别恶性卵巢肿瘤,敏感性为82%、特异性为85%、AUC为0.88。
表2 良恶性卵巢肿瘤DECT参数比较[,M(P25,P75)]

表2 良恶性卵巢肿瘤DECT参数比较[,M(P25,P75)]
images/BZ_94_207_1502_2273_1559.pngZeff IC(100µg/cm3)WC(mg/cm3)50 keV CT值(Hu)70 keV CT值(Hu)120 keV CT值(Hu)8.0±0.5 7.6(3.5,11.9)1 010.5±20.3 52.3(20.1,72.5)31.7(18.8,43.5)17.3(7.1,25.2)8.6±0.4 15.9(7.8,20.4)1 019.2±22.0 98.6(59.3,120.9)50.9(35.2,68.7)26.0(9.9,32.3)3.784 3.326 0.910 1.793 1.684 1.007 0.008 0.010 0.435 0.021 0.023 0.285 8.7±0.4 16.3(10.2,21.3)1 023.7±12.8 110.3(70.2,138.5)64.2(44.1,75.3)35.1(17.2,45.3)8.4±0.5 13.4(8.9,19.6)1 001.9±13.5 73.2(52.1,113.4)37.4(30.0,55.7)13.3(8.1,28.4)0.975 0.932 3.014 1.352 2.925 3.821 0.299 0.317 0.015 0.061 0.016 0.005

图1 恶性卵巢肿瘤(高级别浆液性卵巢癌)

图2 恶性卵巢肿瘤(低度恶性潜能卵巢浆液性肿瘤)
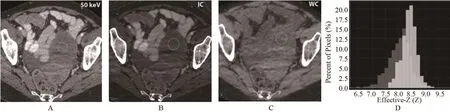
图3 良性卵巢肿瘤(纤维瘤)

图4 受试者工作特征曲线
3 讨论
良性和恶性卵巢肿瘤的分子生物学、临床过程和对治疗的反应各不相同[6]。与良性卵巢肿瘤相比,恶性卵巢肿瘤在50 keV和70 keV单能量图CT值、Zeff和IC更高。Zeff=8.19、IC=9.81(100µg/cm3)是区分良性与恶性卵巢肿瘤的最佳阈值,而WC≥1 021.13 mg/cm3是区分高/低级别恶性卵巢肿瘤的最佳阈值。即DECT参数IC、WC和Zeff可作为区分良性和恶性卵巢肿瘤的定量成像生物标志物,从而能够对这些患者进行更有效的分诊和治疗。
卵巢肿瘤的诊断评估取决于诸如大小、分隔、乳头状突起、淋巴结增大、腹水或腹膜结节以及CT或MRI上增强的程度和模式[1-2,7]。有研究提出DECT可区分恶性与良性卵巢肿瘤[6,8-9],低keV单能量图像比传统的CT更好地描绘了卵巢肿块的内部结构细节。良性卵巢肿瘤的能谱曲线通常与膀胱中的液体能谱曲线重叠,这与恶性卵巢肿瘤不同[6],因此,能谱曲线可用于区分良性与恶性卵巢肿瘤。
DECT可以对物质成分进行定量分析,从而可以在卵巢肿瘤中对碘增强的图像进行碘定量。已证明DECT可根据CT值和定量IC将肺、肝和肾肿块表征为良性或恶性肿块[8]。影像学上恶性肿瘤更强的增强模式与更丰富的血管有关[10]。IC已被用作CT灌注参数的替代物,并被用作生物标记物将乳头状肾细胞癌与透明细胞癌区分开来,或者将乳头状肾细胞癌与复杂性肾囊肿区分开来[11-12]。同样,在肝细胞癌中,DECT动脉期IC阈值为2.95(100µg/cm3)预测病变的恶性程度,敏敏感性为90.5%,特异性为81.2%[13]。
定量碘测量可以帮助区分恶性和良性卵巢肿瘤,IC与卵巢肿瘤的血流动力学呈正相关,因为肿瘤的血管内IC反映了肿瘤的灌注[4,8]。恶性卵巢肿瘤富血管供应,包括曲折血管和动静脉瘘的新血管可提供肿瘤,这可解释为什么恶性卵巢肿瘤与良性卵巢肿瘤相比具有更高的IC值,后者的灌注相对较少[4]。在本研究中,IC≥9.81µg/cm3预测为恶性,敏感性为83%,特异性为75%,AUC为0.79。MILETO等[14]报道了Zeff的最佳阈值为8.36,可将增强型肾细胞癌与非增强型囊肿区分开。本研究中,Zeff≥8.19预测为恶性卵巢肿瘤,敏感性为84%、特异性为75%、AUC为0.80。
与正常组织相比,恶性肿瘤通常具有较高的WC,其次是相对较高的血管容量和大量的肿瘤细胞。此外,与CT值不同,WC不依赖于光子能量,受束硬化效应的影响较小,因此它在描绘肿瘤特征中具有更可靠的参数[15]。与PANG等[4]的研究相似,本研究显示恶性卵巢肿瘤的WC高于良性卵巢肿瘤。但是,统计学上并不显著。这可以用恶性卵巢组的异质性来解释,因为它涵盖了低级别和高级别恶性肿瘤,并且在比较高级别、低级别卵巢肿瘤和良性卵巢肿瘤三组时发现WC存在显著差异。DECT中的物质分解可以帮助进行非侵入性的组织学表征、肺和肾肿瘤的分级[14-16]。LIU等[15]报道浸润性肺腺癌的WC高于浸润前和微浸润性肺腺癌的WC[(550.1±158.2)mg/cm3vs(345.4±96.1)mg/cm3]。本研究表明DECT可以帮助预测恶性卵巢肿瘤的肿瘤分级,因为高级别恶性卵巢肿瘤的WC高于低级别恶性卵巢肿瘤,WC≥1 021.13 g/cm3预测高级别恶性卵巢肿瘤的敏感性为82%、特异性为85%、AUC为0.88。MILETO等[14]研究发现,DECT可用于区分恶性肾肿瘤的类型,例如透明细胞肾细胞癌,其Zeff为(9.9±0.68),而非透明肾细胞癌(乳头状)Zeff为(8.64±0.48)。然而,在本研究中,IC和Zeff在区分高级别恶性卵巢肿瘤和低级别恶性卵巢肿瘤方面没有统计学差异。研究表明,肝细胞癌患者DECT动脉期IC与灌注CT上的各种灌注参数之间存在显著相关性,这表明DECT可以测量肿瘤的灌注状态[17]。因此,DECT可以反映肿瘤的血管和血管生成,可将其应用于卵巢以表征卵巢肿瘤。
本研究存在一些不足:第一,回顾性研究设计的限制,样本量尚偏少。第二,成像仅在增强后的门静脉期进行,然而,在DECT增强的门静脉期,良性肿瘤可与恶性肿瘤区分开。尽管无法像ADNEX模型MRI评分和灌注成像那样生成动态增强曲线,IC被用作灌注成像的替代物;此外,IC和Zeff能够区分恶性和良性卵巢肿瘤。
综上所述,DECT可以使用IC和Zeff来鉴别恶性和良性卵巢肿瘤。高级别恶性卵巢肿瘤的WC较高,DECT的结果可提示卵巢肿瘤分级。鉴于样本量仍偏少,需要进行前瞻性试验以明确当前研究结果,并将DECT的碘定量与灌注CT和动态对比增强MRI的灌注参数进行相关分析。
