稀薄氨气的燃烧特性及动力学研究
2021-01-14苏嘉明李先春李艳鹰王焕然李伯阳
苏嘉明, 李先春, 李艳鹰, 王焕然, 李伯阳, 邱 爽
(1.辽宁科技大学 化学工程学院, 辽宁 鞍山 114051; 2.辽宁科技大学 材料与冶金学院, 辽宁 鞍山 114051)
0 引言
在众多化工企业排放的废气中,常常含有较低浓度的氨气(NH3),这些废气的直接排放不仅污染环境,也危害人们的健康[1]。 由于废气中的氨气浓度较低,不易回收提纯,因此,大多数工厂仍选择传统的方法除氨。 目前,常用的除氨方法包括生物法、物理法和化学法,3 种方法在工业上均有应用。 生物法是靠微生物的生命代谢活动来分解氨气,由于生物分解具有专一性,且易受环境影响,所以生物法的除氨效率较低[2]。 物理法可分为吸收法和吸附法,但这两种方法本质上不能实现氨气的分解,仅仅实现了氨气的转移,最终又产生了化工废水和固体废物[3]。 化学法主要是指催化氧化法,这种方法在有效去除废气中的氨气的同时,会面临除氨成本高、催化剂生产、回收和再生困难等问题[4]。 面对复杂的废气组分,开发一种清洁高效的新技术仍是研究热点。 与传统的化学法不同,燃烧法不需要催化剂就可将氨气较彻底地氧化成氮气和水, 具有绿色环保的特点,是未来发展的趋势。
很多学者使用数值模拟手段研究了氨气的燃烧。 Hisashi Nakamura 发现,氨/空气混合物在1 290 K 时就可以完全燃烧,并提出了一种反应机理来预测氨气的完全燃烧[5]。 Krzysztof Gosiewiski发现,甲烷均质燃烧的点火温度很大程度上取决于气相接触陶瓷表面的面积, 这与Wang Yikun的研究结论相一致[6],[7]。 Warner Maximilian 将复杂的表面反应机理简化为只有一步且直接生成产物的反应,该方法简化了产物的分析过程[8]。Xiao Hua的研究表明, 向甲烷中添加氨气可在不改变污染物排放的情况下,显著提高燃烧的传播速度[9]。
近年来, 有关氨气和其他燃料的混合物(如H2,CH4等)在内燃机中的燃烧的研究较多,而对于稀薄氨气直接燃烧的研究较少[10]~[12]。因此,本文研究了稀薄氨气在氧气充足条件下在固定床反应器中的燃烧, 并借鉴CH4均质燃烧的动力学测定方法[13]~[15],通过实验测定了氧气充足条件下,稀薄NH3均质燃烧的动力学参数。
1 研究方法
1.1 反应机理及简化
化学反应本身可以用不同类型的反应来描述,如离子反应、自由基反应等。 氨气燃烧是一个自由基反应,它可能包括数十个反应物种,几个到几百个连续的基元反应。
通过数值模拟所得到的氨气燃烧机理不仅复杂而且均有特定的使用条件。这些机理的缺点是,在模拟氨气的燃烧过程达到稳定状态时, 须要使用十分复杂的数值模拟方法才能非常准确地描述其过程,而模拟方法越复杂,越可能会由于初始条件的变化而导致数值上存在误差, 并进一步导致反应过程发生变化。因此,通过包含过多化学反应的多阶段动力学而使模型复杂化是不合理的。 除此之外,在动力学公式中出现的每一个新的中间产物都需要一个额外的微分平衡方程,几十个中间产物意味着额外的几十个非线性微分方程。 因此, 计算动力学应该基于一个简单的反应过程,反应过程越简单,动力学越能避免初始条件的变化带来的误差, 本文简化了氨气的自由基反应,只用了一个包含反应物和能测到的产物的方程来近似反应过程。
有研究表明, 当氨气燃烧的温度为740~1 050 ℃时,主要产物有N2,NO 和H2O(NO2极少,可忽略,其他中间产物亦被忽略)。 因此,我们对氨气在陶瓷蜂窝蓄热体上的燃烧进行了初步研究,假设了一个简单的生成N2和NO 的单级燃烧方案,其中k 为总反应的化学速率常数。
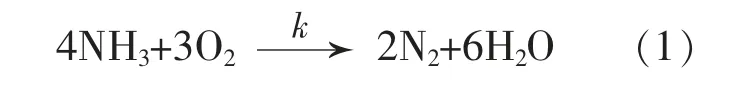
在对此模型的简化研究中,考虑到下列反应:

为了解释氨气燃烧的实验结果,本文假设了一个忽略中间产物和自由基的反应,并对反应动力学进行了计算。 实验过程中,O2充足, 可以将氧气浓度省略并入速率常数中计算,因此,反应动力学方程可以表示为

式中:CNH3为NH3的浓度,mol/L;E 为反应活化能,kJ/mol;R 为气体常数;T 为 温度,K;m 为反应级数;k0为指前因子,mol1-m/(L1-m·s)。
1.2 动力学计算方法
实验采用的是流动体系,所谓流动体系是指在反应过程中,反应物质在反应器内的空间位置随时间的改变而发生改变。 图1 为反应器中反应物的流动示意图。

图1 反应物的流动示意图Fig.1 Flow diagram of the reactants
若ri为单位时间、 单位体积内由于化学反应而引起的氨气变化量, 在时间dt 内其位移为dx,管道的截面积为S,在dx 范围内,流过的氨气的物质量为ni,则有:
根据阿伦尼乌斯速率方程, 由于反应中氧气浓度>>氨气浓度,氧气可在方程中省略,故氨气的反应速率为

其对应的的对数形式为

阿伦尼乌斯方程的对数形式为

本文通过画图法, 对-1/T 和lnk 作图后进行线性拟合, 线性方程的斜率为-E/R, 纵截距为lnk0,由此可解出动力学参数。
2 实验部分
2.1 实验原料和设备
原料:30 g 粒径为3~5 mm 的石英玻璃碎屑、30 g 粒径为3~5 mm 的陶瓷蓄热体碎屑、2 g 石英棉、长度为1 000 mm,内径为20 mm 的石英反应器以及氨气、高纯氩气和氧气。
设备:D08-1F 型质量流量计(北京七星华创电子)、气体混合器、GR/TF6014 型恒温卧式炉(上海贵尔机械设备)、JFQ-1150E 型氨气分析仪(北京均方理化)和Testo350 型烟气分析仪(德国德图仪器)等。
2.2 实验系统
稀薄氨气的燃烧所用到的实验系统如图2 所示。

图2 实验系统图Fig.2 The diagram of experimental system
在石英固定床反应器内填充石英玻璃或陶瓷蓄热体碎屑, 并用石英棉将石英玻璃固定在石英反应器中间,然后置于恒温卧式炉中。反应气体的总流量为1 L/min,原料气在质量流量计的精准控制下,可以使氨气达到所需要的浓度,并在气体混合器中充分混合, 以保证到达反应器时可以均匀燃烧。 利用氨气分析仪和烟气分析仪测量燃烧后的气体中剩余氨气的含量及生成的一氧化氮含量。 为了排除氮气作为反应器前端气体对产物氮气的影响,选用氩气作为载气。根据温度超过着火温度的空间长度, 确定了燃烧区的长度及填充蜂窝陶瓷的长度, 反应器的温度默认为加热炉的炉膛温度, 忽略热量的流失以及反应体系所放出的热量,即默认在反应区内温度处处相等。
2.3 实验方案及评价
本文采用控制变量法研究温度、停留时间、氨气浓度和氧气浓度对氨气燃烧特性的影响。 氨气燃烧特性的研究包括氨气作为反应物时的分解情况以及产物(如N2,NO 等)的生成情况。 由于N2定量难度较大,因此,本文研究产物时,主要研究的是NO。
停留时间是单位体积的混合气体在反应器的反应区所停留的时间, 反应器的规格决定了停留时间的大小,停留时间t 的计算式为

式中:r 为反应器内半径,m;l 为介质填充长度,m;q 为气体流量,L/min。
NH3转化率是氨气燃烧特性的最直观的表现方式,NH3转化率X 的计算式为

式中:C0和C1分别为反应器进、 出口处的氨气体积浓度,10-6。
NO 为NH3燃烧后的副产物,NO 的选择性直接体现了有多少的氨气转化成了NO,NO 的生成量可由烟气分析仪测得。NO 选择性SNO的计算式为
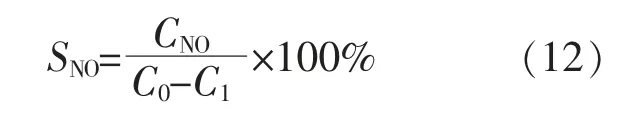
式中:CNO为反应器出口处的NO 体积浓度,10-6。
3 结果与讨论
3.1 反应温度对氨气燃烧的影响
对于氨气的燃烧反应来说, 选取一个合适的反应温度十分重要,反应温度过低,氧化反应缓慢或者不能进行,反应温度过高,分解效率也不会继续增加,反而会生成更多的氮氧化物。 研究发现,氨气燃烧的最佳反应温度为950~1 050 ℃。 当氨气浓度为1%,氧气浓度为7%,停留时间为0.24 s时, 反应温度对NH3转化率和NO 选择性的影响如图3 所示。
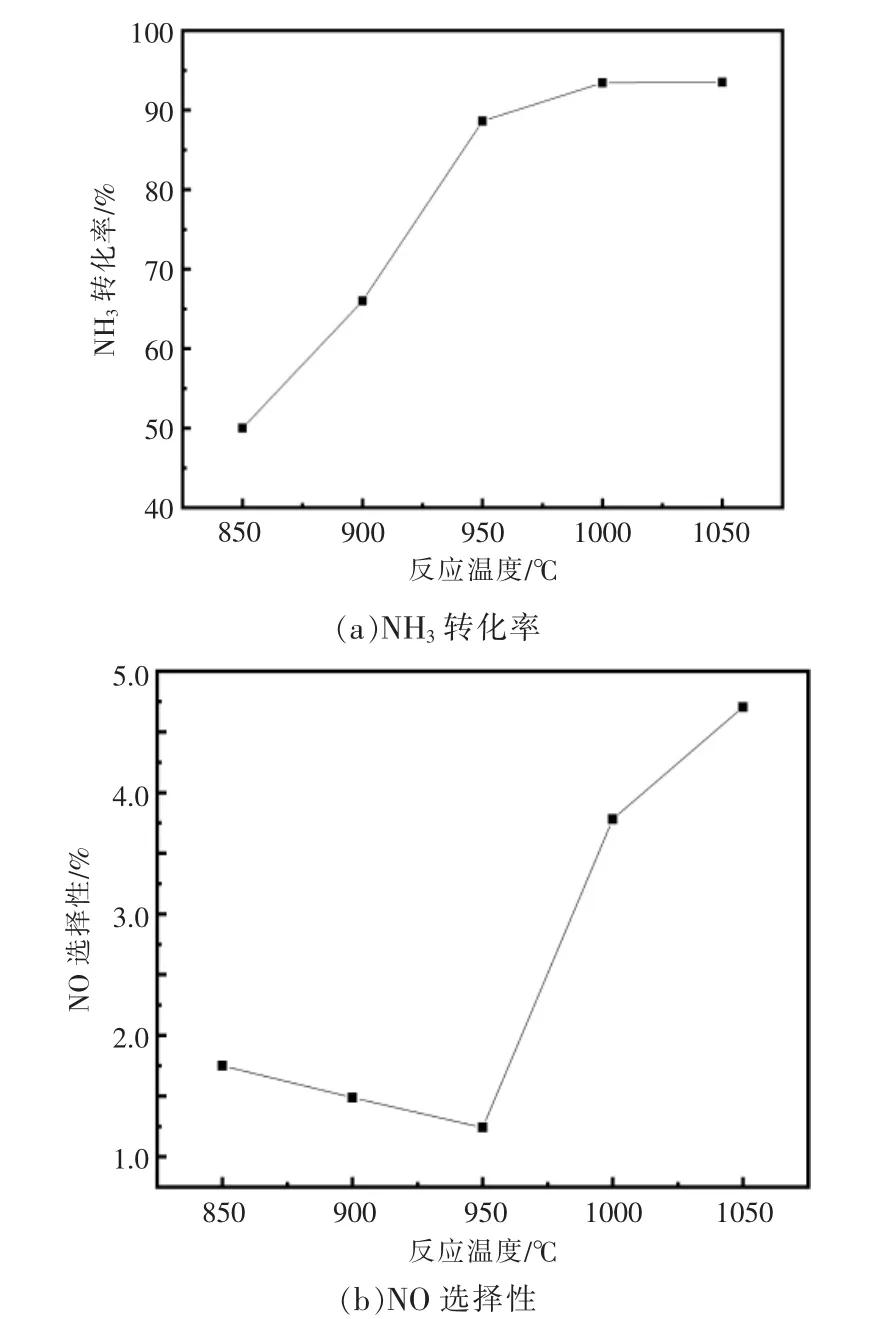
图3 反应温度对NH3 转化率和NO 选择性的影响Fig.3 Effect of temperature on ammonia conversion rate and NO selectivity
由图3 可以看出, 当反应温度为950 ℃时,NH3转化率就已经达到了90%, 随着反应温度继续升高,NH3转化率的增长变得不明显, 因此,随着反应温度的逐渐升高,NH3转化率会越来越高直至趋于平衡;当NH3转化率趋近平衡时,NO 选择性越来越大, 当反应温度为950 ℃时,NO 选择性最低。
3.2 氧气浓度对氨气燃烧的影响
当反应温度为1 050 ℃, 氨气浓度为1%,停留时间为0.48 s 时, 氧气浓度对NH3转化率和NO 选择性的影响如图4 所示。

图4 氧气浓度对NH3 转化率和NO 选择性的影响Fig.4 Effect of oxygen concentration on NH3 conversion rate and NO selectivity
氧气是氨气燃烧反应的反应物之一, 其含量影响着反应的平衡,氧气浓度越大,氨气氧化越完全,即氨气燃烧会产生更多的NO。 从图4 可以看出: 随着氧气浓度的逐渐升高,NH3转化率和NO选择性均逐渐升高,当氧气浓度为18%时,氨气转化率接近100%;NO 选择性随氧气浓度升高的增量远远大于NH3转化率随氧气浓度升高的增量。
3.3 停留时间对氨气燃烧的影响
停留时间是指混合气能够在反应区内进行反应的时间,它对于氨气燃烧的效果也有很大的影响,通常来说,停留时间越长,反应越接近平衡。当反应温度为1 050 ℃、氨气浓度为1%、氧气浓度分别为10%,12%,15%,18%时, 停留时间对NH3转化率和NO 选择性的影响如图5 所示。

图5 停留时间对NH3 转化率和NO 选择性的影响Fig.5 Effect of residence time on NH3 conversion rate and NO selectivity
从图5(a)可以看出,随着停留时间的延长,反应物在反应器内发生碰撞的几率增大, 导致反应进行得更完全,当停留时间为0.96 s 时,NH3转化率大于99.9%。 从图5(b)可以看出,随着停留时间的延长,NO 选择性的变化呈现3 种趋势:当氧气浓度为10%和12%时,NO 选择性会随着停留时间的延长而出现持续上升的变化趋势; 当氧气浓度为15%时,随着停留时间的延长,NO 选择性呈现出先升后降的变化趋势; 当氧气浓度为18%时, 随着停留时间的延长,NO 选择性呈现出持续下降的变化趋势。在反应区内,氨气燃烧生成NO 的反应和氨气与NO 反应生成N2的反应同时进行,升高氧气浓度会增大氨气的氧化程度,但停留时间过短, 不一定能使NO 与氨气的反应达到平衡。
3.4 氨气浓度对氨气燃烧的影响
当氧气浓度为18%,停留时间为0.96 s,反应温度为1 050 ℃时,氨气浓度对NH3转化率和NO选择性的影响如图6 所示。由图6 可以看出:随着氨气浓度的逐渐升高,NH3转化率也逐渐升高,且最高值大于99.9%;当氨气浓度小于1%时,NO 选择性会随着氨气浓度的升高而急剧降低, 当氨气浓度大于1%时,NO 选择性的变化不明显。

图6 氨气浓度对NH3 转化率和NO 选择性的影响Fig.6 Effect of ammonia concentration on NH3conversion rate and NO selectivity
4 化学反应动力学
4.1 蜂窝陶瓷体中燃烧的动力学
在稀薄氨气燃烧工艺上, 蜂窝陶瓷蓄热体的应用较为广泛,因此,本部分采用蜂窝陶瓷填充的石英管进行实验和动力学的计算。实验条件:反应温度为740~770 ℃,氨气浓度为1%,氧气浓度为15%。将动力学方程转变为对数形式[式(9)],利用微分法对前文中计算动力学的方法计算得出的1/T 和ln k 作图(图7)后进行线性拟合,图中拟合曲线的斜率为-E/R,纵截距为lnk0,由此计算出指前 因 子k0=2.49×106mol0.42/(L0.42·s), 活 化 能E=253.56 kJ/mol。

图7 NH3 燃烧总反应的动力学-1/T~lnk 图Fig.7 Kinetics of total reaction of NH3 combustion
通过对氨气均质燃烧简化模型的动力学结果分析可知, 氨气燃烧机理和动力学参数可能很大程度上取决于氨气燃烧时所处的环境。 最合理的解释是, 根据陶瓷蜂窝蓄热体与气相接触的表面积的大小,自由基的活化程度可能不同。在反应区内,接触面积越大,会导致自由基相互碰撞的几率增大,进而增大反应物的转化率。 所以,在氨气燃烧过程中, 陶瓷蜂窝体孔道的表面积会对自由基的活化和失活产生影响, 甚至可能对燃烧产物的类型产生重要影响。
4.2 自由空间中燃烧的动力学
石英管内不填充介质即为自由空间。 自由空间中NH3转化率随反应温度变化的关系如图8所示。
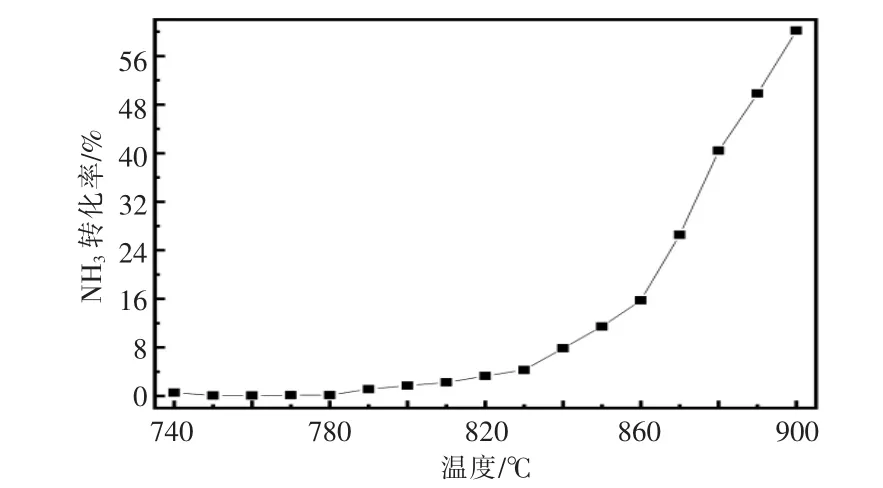
图8 自由空间中NH3 转化率随反应温度变化的关系Fig.8 Relationship between NH3conversion rate and temperature change in free space
从图8 可以看出,当反应温度740~770 ℃时,NH3转化率不到2%,远远低于在蜂窝陶瓷蓄热体中燃烧时的转化率。这个现象表明:氨气的燃烧依赖于反应环境,有陶瓷蜂窝蓄热体时,氨气的均质燃烧一部分发生在蓄热体的表面, 在蓄热体表面有利于活性物质的碰撞,从而改变了燃烧机理,另一部分发生在蜂窝陶瓷蓄热体的空隙之间; 而自由空间缺少能让反应物聚集的表面, 故氨气在自由空间内燃烧时, 若要达到与蜂窝陶瓷蓄热体类似的效果,须要将反应温度升高。 此外,氨气在自由空间中的燃烧是不稳定的, 导致在自由空间的实验结果的重现性较差, 不能计算出较准确的动力学。
5 结论
通过研究稀薄氨气的燃烧特性, 计算其在陶瓷蓄热体中燃烧的动力学结果, 并与在自由空间内的燃烧相对比,得出以下结论。
①NH3转化率与反应温度、停留时间、氧气浓度以及氨气浓度呈正相关关系。 当反应温度大于950 ℃时,NH3转化率可达99%以上;停留时间的延长有助于使反应物分子发生碰撞, 增大了反应机会;氧气充足条件下,继续加大氧气浓度,会生成更多的NO; 氨气浓度的增高有助于氨气与NO发生归一反应,进而降低NO 选择性。
②氨气在陶瓷蓄热体中燃烧的动力学参数E=253.56 kJ/mol,与在自由空间内的燃烧相比,氨气在陶瓷蓄热体中的燃烧更为剧烈, 且自由空间的实验结果重复性较差, 这证明了氨气燃烧的实质为表面燃烧反应, 也证明了氨气转化率对反应环境的依赖性。
