百香果连作对土壤细菌群落结构的影响
2021-01-13蔡国俊郭春艳谭仲廷吴凤婵李安定张丽敏彭熙
蔡国俊 郭春艳 谭仲廷 吴凤婵 李安定 张丽敏 彭熙





摘 要:细菌群落在土壤健康和植物的生长中起着重要作用,而作物的连作对其有着显著的影响。为探明百香果连作对土壤细菌群落结构和多样性的影响,本研究以种植‘台农1号’百香果1年(TF)、2年(TS)、3年(TT)、4年(TFo)及0年(撂荒地,TZ)的土壤为材料,利用Illumina高通量测序技术对不同种植年限土壤细菌群落结构及多样性开展分析研究。结果表明,所有土壤样本共检测出2418个OTUs,分属28门、70纲、170目、269科、465属、963种,其中变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)和放线菌门(Actinobacteria)是主要的优势菌门,细菌群落的丰富度和多样性指数随连作年限的增加表现为先增加后降低。分析发现,百香果连作对土壤细菌群落结构有显著影响,其中绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)和芽孢杆菌属(Bacillus)的相对丰度随连作年限的增加而显著升高,研究结果可为百香果连作障碍发生机制的进一步研究提供依据。
关键词:西番莲;连作障碍;高通量测序;细菌群落多样性;土壤微生物
中图分类号:S667.9 文獻标识码:A
Abstract: Soil bacteria play key roles in determining soil health and plant growth. Previous studies showed that conti-nuous cropping of crops altered a significant imbalance of soil bacteria communities. Five soil samples from 0 year to 4 years (TZ, TF, TS, TT, TFo ) of continuous cropping P. edulis were used as the materials, 16S rRNA was analyzed based on the Miseq platform of Illumina Company to study the soil bacterial community structure and diversity in different continuous cropping years of P. edulis. A total of 2418 OTUs for bacterial diversity were generated from the five sam-ples, which were classified in 28 phyla, 70 classes, 170 orders, 269 families, 465 genera and 963 species. Among them, Proteobacteria, Acidobacteria and Actinobacteria were the dominant phylum in the tested samples. The Ace, Chao, Shannon and Coverage index of soil bacteria increased first and then decreased with the increase of continuous cropping years. Continuous cropping of P. edulis had a significant impact on the structure of soil bacterial communities, but the influence rule on the main types species was different from the research results of other crops, with the relative abundance of Chloroflexi, Firmicutes and Bacillus increased with the increase of continuous cropping years. The research results would provide a research foundation and theoretical basis for the mechanism of continuous cropping obstacles of P. edulis in the further studies.
Keywords: passion fruit; continuous cropping obstacles; high-throughput sequencing; bacterial diversity; soil microbial
DOI: 10.3969/j.issn.1000-2561.2021.12.036
百香果(Passiflora edulis Sims, 2n=18)原产北美洲,是西番莲科(Passifloraceae)西番莲属(Passiflora)植物[1],其在食用和药用等方面具有较大的社会经济价值,在巴西、哥伦比亚、越南等国家及我国台湾地区广泛用于鲜果、饮料、香料等商业化发展[2-4]。百香果于20世纪80年代引入我国大陆地区,目前,在我国南部的广西、福建、海南、广东,及西南的贵州和云南等地区的种植面积已逾4万hm2[5],因其当年种植当年见效,近年来,百香果产业在脱贫攻坚过程中起到了重要的作用,其中,贵州省自2019年以来,便将百香果作为主要的扶贫产业进行规模化发展,种植面积已超过1万hm2。
百香果虽为多年生藤本植物,但在实践中,其种植第一年产量较高,从第二年开始,病虫害发生频次和程度增加,从而导致产量和品质的降低,为了克服这一问题,生产中一般采用一年一种,但一年一种的连作也对百香果产量和品质产生了严重的影响,笔者前期的调查[6]表明,随着百香果连作年限的增加,其叶片和果实染病率显著升高,植株平均单株结果量和果实大小也显著降低。Wang等[7]的研究结果表明,百香果连作土壤对百香果苗的生长具有抑制作用,并且随着连作年限的增加,抑制效果也逐渐增加。
细菌在土壤中广泛分布,并且具有较高的丰度,其通过利用植物根际分泌物作为营养源与植物形成相互作用,从而影响植物的生长发育[8]。土壤细菌群落平衡与否,对植物的生长发育起着重要的影响[9],研究表明,作物连作会破坏土壤细菌群落结构,促进有害菌物的生长,抑制有益微生物的繁殖,从而对作物的生长、产量和品质造成负面影响[10-11],该观点在马铃薯[12]、红薯[13]、菠萝[14]、大豆[15]等作物连作的研究中得到验证。连作对细菌群落的影响因作物种类的不同而不尽相同[12,16],目前对百香果连作的研究,仅Wang等[7]对百香果连作土壤的自毒作用开展了研究,陳晓婷等[17]对百香果连作土壤微生物生物量进行了定量研究,结果表明随着百香果连作年限的增加,土壤细菌与放线菌数量呈显著下降趋势,而真菌数量呈显著上升趋势,但对百香果连作后土壤细菌群落结构及其多样性如何变化并未开展相关分析,百香果连作对土壤细菌群落结构的影响如何尚未清楚。本文以我国栽培最多的‘台农1号’百香果为对象,利用高通量测序技术,对不同连作年限百香果土壤细菌群落变化开展研究,旨在探索百香果连作对土壤细菌群落结构及多样性的影响,为进一步解释百香果连作障碍发生机理提供依据。
1 材料与方法
1.1 材料
百香果种植基地位于贵州省黔南布依族苗族自治州平塘县克度镇(1065236 E,254338 N),海拔约850 m,属亚热带湿润季风气候,年平均气温16.8 ℃,年均降水量1100 mm~ 1300 mm,无霜期310 d,土壤为白云质砂壤土。该基地为撂荒地自2016年以来逐年开垦而来,种植方式均为一年一种,最长的地块已连续种植百香果4 a。笔者前期对该基地不同连作年限百香果的农艺性状的调查结果显示[6],随着连作年限的增加,百香果叶片和果实的染病率及病害程度均显著增加,同时其果实大小、单株结果量及产量均显著降低。
1.2 方法
1.2.1 实验设计 研究对象选取该基地种植年限为1年(TF)、2年(TS)、3年(TT)、4年(TFo)且种植品种均为紫果百香果(Passifora edulis)的根区土壤,以及种植年限为0年(TZ)的撂荒地土壤。不同年限地块百香果种植株行距为2 m×2 m,“门”字型搭架,每年3月下旬定植,统一水肥和修剪管理,次年2月清园,种植年限4 a的地块(TFo)为2016年3月开始种植,1年(TF)地块为2019年3月种植。撂荒地植被主要为白茅(Imperata cylindrica)等杂草。
1.2.2 样品采集与制备 2020年1月3日,天气晴朗,在不同年限百香果种植地中随机选择3个相距50 m以上的地块,每个地块按照相邻两点间距离不小于3 m,且相邻3点不在同一水平直线上的原则,采集5个百香果根区深10~20 cm的表土,5点混合,去除残渣、过2 mm孔径土壤筛混匀后,用四分法分取部分样品装入无菌离心管置于干冰中保存,运回实验室放入–70 ℃冰箱冻存,用于核酸提取。
1.2.3 核酸提取及测序 使用Omega Bio-Tek公司(Omega Bio-Tek, Norcross, GA, USA)提供的土壤DNA试剂盒提取土壤微生物总DNA,使用338-F(5-ACTCC TACGGGAGGCAGCAG-3)和806R(5-GGACTA CHVGGGTWTCTAAT-3)[18]引物对土壤细菌16S rRNA V3-V4区进行PCR扩增,使用MiseqPE300平台(Illumina, San Diego,USA)进行高通量进行测序、拼接。
1.3 数据处理
使用fastp[19](https://github.com/OpenGene/ fastp)软件对原始测序序列进行质控,使用FLASH[20](http://www.cbcb.umd.edu/software/flash)软件进行拼接。在97%相似水平上对优化序列进行OUT聚类,在聚类过程中过滤序列总数少于7,出现样本数少于3个的OUT,并去除叶绿体目(Chloroplast)和丰度较低且未注释到的物种,并按最小样本序列数对所得的OUT序列进行抽平,生成OUT数据表,采用RDPclassifier对97%相似水平的OTU序列进行分类学分析,并对比Silva(Release132http://www.arb-silva.de),Green¬gene(Release 13.5 http://greengenes.secondgenome. com/)数据库,在各个分类水平统计样品的群落组成。运用mothur(version v.1.30.1 http://www.
mothur.org/wiki/Schloss_SOP#Alpha_diversity)计算细菌群落的丰度、多样性和覆盖度指数(Chao、Shannon 、Simpson、Ace、Coverage)并用Welch's t test进行组间差异检验。
2 结果与分析
2.1 测序数据
本研究基于Illumina高通量测序平台,对不同连作年限百香果土壤进行细菌16S rRNA序列V3-V4区进行高通量测序分析,结果如表1所示,15个土壤样本共获得683 325条原始序列(sequences),过滤和去除出现样本数较少和未注释物种的序列后,共获得394 528条有效序列,序列长度范围在202~526 bp之间,平均序列长度为413.82 bp。各样本覆盖率均大于98%,说明各样本细菌基因序列被检出的概率较高,能较真实地反映样本的细菌群落,测序深度满足要求。在3%的差异阈值下,采用RDP classifier对获得的序列进行分类,共获得2418个细菌OTUs,归类为28门、70纲、170目、269科、465属、963种。
2.2 稀释曲线与Alpha多样性分析
2.2.1 稀释曲线 从图1A的Sobs指数稀释曲线可知,随着测序数据量增加,Sobs指数逐渐趋于平缓,说明测序数据量合理;Shannon多样性指数曲线随着样本测序数据的增加,最终趋于平坦(图1B),说明测序数据能反映样本中绝大多数的微生物多样性信息。
2.2.2 Alpha多样性分析 不同连作年限百香果土壤细菌多样性指数如表2所示,Coverage指数表示样本的文库覆盖率,其数值越高,表示样本中序列被测出的概率越高,如表2所示,各样本Coverage指数均大于98%,说明各样本细菌基因序列被检出的概率较高,能较真实地反映样本的细菌群落;Ace和Chao指数反映细菌群落的丰富度程度,指数值越高,样本细菌丰富度越高;Shannon指数和Simpson指数反映样本中细菌群
落的多样性程度,Shannon值越大,表明细菌多样性越高,Simpson指数值越大,表明细菌优势度越高,均匀性越低,多样性越低。各样本Ace、Chao、Shannon和Simpson指数差异显著(P<0.05),如表2所示,随着种植年限的增加,百香果种植土壤细菌的丰富度、多样性指数均呈先增加后降低的趋势,其中Ace和Chao指数在种植第2年时达到最大,Shannon多样性指数在连作第3年时达到峰值,Simpson指数在前3年逐渐降低,连作4 a时与撂荒地相近。上述结果说明连作能显著影响百香果根区土壤细菌群落的多样性。
2.3 土壤細菌群落结构
2.3.1 不同连作年限土壤细菌群落物种组成 通过高通量测序表明,不同连作年限百香果土壤细菌群落中,相对丰度大于1%的门类有15种(图2),主要优势种类为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actin¬obacteria)、绿弯菌门(Chloroflexi)、浮霉菌门(Planctomycetes)、厚壁菌门(Firmicutes)、疣薇菌门(Verrucomicrobia)和Candidata division WPS-2,约占所有细菌丰度的85%~95%,其中变形菌门、变形菌门、放线菌门和绿弯菌门等4种细菌类群是百香果种植土壤中的主要菌群,占所有细菌总数的80%以上。
将不同连作年限土壤细菌优势门类排名前9增加而增大的趋势。
在属水平上,将相对丰度排名前30位的属进行聚类分析,绘制成热图(图4),结果显示相对丰度排名前30位的细菌来源于变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、浮霉菌门(Planc-tom¬ycetes)、绿弯菌门(Chloroflexi)、WPS-2、己科河菌门(Rokubacteria)、厚壁菌门(Firmicutes)和芽单胞菌门(Gemmatimonadetes)等9个门类,其中变形菌门、酸杆菌门和放线菌门占前30属中的66.7%,分别为10属、5属和5属。
所有样本中,相对丰度大于1%的属有24属,相对丰度占58.51%,其中相对丰度最高的10属占总丰度的40.68%,依次分别为酸杆菌门Subgroup_2目下的未定名属(占8.57%)、变形菌门根瘤菌目的未定名属(占5.12%)、酸杆菌目未定名属(占4.81%)、热酸菌属(Acidothermus,占4.38%)、Elsterales目未定名属(占3.52%)、出芽菌科(Gemmataceae)未定名属(占2.78%)、慢生根瘤菌属(Bradyrhizobium, 占2.71%)、Candidatus Solibacter(占2.43%)、水球菌属(Aquisphaera,占2.16%)、酸杆菌门Subgroup_6纲下未定名属(占2.11%)、变形菌门Acidibacter属(占2.09%)。
方差分析结果表明,不同连作年限土壤细菌间,前30属的相对丰度差异显著(P<0.05),其中酸杆菌门Subgroup_2目下的未定名属、Aquisphaera、Acidibacter、Bryobacter、分枝杆菌属(Mycobacterium)等属的丰度随连作年限的增加而显著降低,而芽孢杆菌属(Bacillus)、酸杆菌门Subgroup_6纲下未定名属等属丰度随连作年限增加而显著增大。
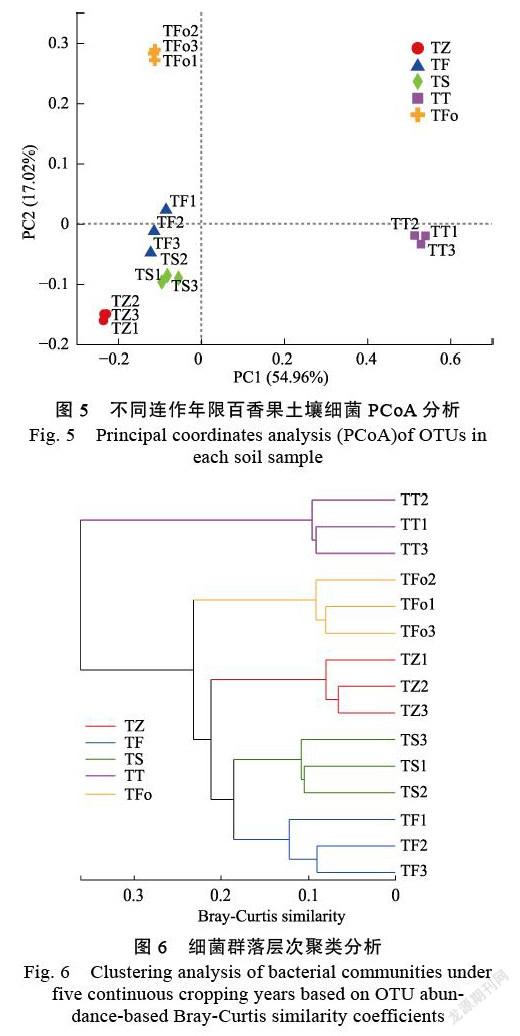
2.3.2 不同连作年限土壤细菌群落结构 为了进一步对细菌群落物种组成差异进行分析,探讨不同连作年限间群落细菌组成的相似性或差异性,基于Bray-Curtis距离算法,采用主坐标分析(PCoA)对不同连作年限土壤细菌群落差异进行分析,结果如图5所示,在OUT水平上,PC1与 PC2分别解释方差为54.96%和17.02%,累计解释能力达71.98%,不同连作年限间土壤细菌群落差异显著(P=0.001,R=1),撂荒地土壤样本与百香果种植地样本在第一主成分上很好地被区分,种植第一年(TF)与种植第二年(TS)土壤细菌群落组成较相近;每个处理的3个重复样本的聚集性较好,显示出较好的重复性,第一年种植的土壤细菌组内差异较大。同时,采用Bray-Curtis算法对15个土壤样本细菌群落进行样本层级聚类分析,结果表明(图6):15个土壤样本明显聚集为5组,与5个连作年限对应,其中连作3 a的样本(TT)单独为一簇,与其他4个样本分开; 第一年种植(TF)和第二年种植(TS)的样本与撂荒地(TZ)的相似距离较近,说明百香果连作显著影响土壤细菌群落结构。
3 讨论
3.1 百香果不同连作年限土壤细菌多样性
基于IlluminaMiseq高通量测序平台,对不同连作年限百香果土壤进行细菌16S rRNA序列V3-V4区的高通量测序,以研究百香果不同连作年限下土壤细菌群落变化,结果表明,百香果不同种植年限间土壤细菌多样性指数差异显著,细菌丰富度和多样性随着种植年限的增加均表现为先升高后降低的趋势,其中Ace和Chao指数在种植第2年时达到最大,Shannon多样性指数在连作第3年时达到峰值,Simpson指数在前3年逐渐降低,连作4 a时与撂荒地相近。与Zhang等[21]对棉花长期连作的研究结果相似,原因可能是开垦直接改变了原生系统细菌群落结构变化,撂荒地开垦后,随着有机肥等养分输入,增加了细菌的丰富度和多样性,但长时间连作后又使土壤细菌群落结构发生变化。有研究表明[22],施肥和耕作年限对土壤微生物有着显著的影响,前人对苜蓿的研究[23-26]也表明,苜蓿土壤细菌丰富度指数和多样性在连作10 a内呈增加趋势,但在连作10~16 a内呈降低趋势,与本研究表现出相似的趋势。
3.2 百香果不同连作年限细菌种类组成
高通量测序结果表明,百香果种植地样品中共鉴定细菌28门,其中变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、浮霉菌门(Planctomycetes)是样品中的主要优势门类,土壤细菌优势菌门类组成与马铃薯[12]、红薯[13]、菠萝[14]、西红柿[27]和烟草[28]等作物相似,其中变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)和放线菌门(Actinobacteria)也被认为是高通量测序下,农业生态系统和其他土壤类型中最常见的菌门[29]。绿弯菌门(Chloroflexi)的相对丰度随种植年限的增加呈逐渐升高的趋势,厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)相对丰度在前3年连作中也呈逐渐升高的趋势,与对红薯[13]的研究结果相似,但与对黑胡椒(black pepper)[30]、大豆[15]和馬铃薯[12]等作物的研究结果相反,这可能是因为连作对不同作物土壤微生物群落结构的影响不同导致,以往的研究认为,即使在相同的土壤条件下,不同植物种类和根系分泌物决定了土壤细菌群落结构[16, 31]。
在属水平上,芽孢杆菌属(Bacillus)、酸杆菌门Subgroup_6纲下未定名属丰度随连作年限增加而显著增大,前者与对大豆[15]的研究结果相似,后者与对棉花[21]的研究结果相似。有研究认为,芽孢杆菌属(Bacillus)细菌可以产生毒素以抑制土壤内的其他菌物和动物的生长发育[32-33],一些研究[34]认为,芽孢杆菌属(Bacillus)产生的毒素可以抑制土壤内有害昆虫和病菌的生长,所以作物连作时,芽孢杆菌属(Bacillus)细菌丰度降低导致土传病虫害增加可能是连作障碍发生的原因之一,但本研究和对大豆[15]的研究结果表明,随着连作年限的增长,该属细菌丰度呈显著升高的趋势,这也可能会因芽孢杆菌属(Bacillus)丰度增加,其产生的毒素亦会对作物本身及有益菌产生毒害作用,从而产生连作障碍。
3.3 不同连作年限土壤细菌群落结构
基于样本OUT组成及Bray-Curtis算法的主坐标分析(PCoA)和样本层级聚类分析结果均表明,不同连作年限样本间细菌群落组成和结构均存在显著差异,而同一种植年限3个重复样本间细菌群落结构较为相似,结果与大部分作物连作的研究[13, 30, 34]得到的结论相同,即作物长期连作可能会极大地影响土壤微生物群落结构。但与其他作物相比,本研究结果中,细菌群落结构的相似距离并未随着连作年限的增加而增加,而是和细菌多样性指数的变化趋势较为相似,即呈现细菌群落相似距离随连作年限的增加呈先增加后降低的趋势,其中撂荒地细菌群落与连作第3年(TT)的细菌群落相似距离最大,出现这种结果的原因可能与耕作年限有关,同时,如讨论3.2中所述,虽然连作对土壤细菌整体的群落组成及结构有显著的影响,但因作物及物种基因型间的差异,不同作物连作对微生物种类及丰度的影响也各不相同,甚至会得到相反的结果。
4 结论
本研究通过16S rRNA高通量测序研究了百香果连作土壤细菌多样性和群落结构,结果表明,百香果连作显著影响了土壤细菌群落结构和多样性,土壤细菌的丰富度和多样性随连作年限的增加表现为先增加后降低;变形菌门(Proteobac-teria)、酸杆菌门(Acidobacteria)和放线菌门(Actinobacteria)是百香果种植土壤中的主要优势菌门,连作对放线菌门(Actinobacteria)影响不显著,绿弯菌门(Chloroflexi)和厚壁菌门(Firmicutes)相对丰度随连作年限的增加显著升高。百香果连作对土壤细菌群落结构有显著影响,但对细菌主要种类的影响规律与其他作物研究结果有所区别,因此,需要进一步从更长连作周期和多样本开展百香果连作对土壤微生物群落及百香果生长发育影响的研究,以探明百香果连作障碍发生机制。
参考文献
[1] Onildo N J, Eder J, Oliveira, et al. Illustrated mor-pho-agronomicdescriptors for Passiflora spp[M]. Brasíla, DF: Embrapa, 2017: 126.
[2] Feng G Y, Chan W H, Yu X, et al. Volatiles in juice of pas-sion fruitsat different developmental stages[J]. Fujian Journal of Agricultural Sciences, 2017, 32(3): 299-304.
[3] Silva R O, Damasceno S R, Brito T V, et al. Polysaccharide fraction isolated from Passiflora edulis inhibits the inflam-matory response and the oxidative stress in mice[J]. Journal of Pharmacy & Pharmacology, 2015, 67(7): 1017-1027.
[4] Silva D C, Freitas AL, Barros F C, et al. Polysaccharide isolated from Passiflora edulis: Characterization and antitu-mor properties[J]. Carbohyd Polym, 2012, 87(1): 139-145.
[5] 張丽敏, 彭 熙, 蔡国俊, 等. 不同搭架方式百香果营养成分分析及综合评价[J]. 食品工业科技, 2021, 42(21): 33-40.
[6] 蔡国俊, 谭仲廷, 吴凤婵, 等. 连作对‘台农1号’百香果农艺性状的影响[J]. 贵州师范大学学报(自然科学版), 2021, 39(6): 51-56.
[7] Wang H B, Chen X T, Li D, et al. Replant problem and soil toxicity of passion fruit (Passiflora edulis sims) in China[J]. Allelopathy Journal, 2018, 44(1): 1-12.
[8] Bulgarelli D, Schlaeppi K, Spaepen S, et al. Structure and functions of the bacterial microbiota of plants[J]. Annual Review of Plant Biology, 2013, 64(1): 807-838.
[9] Zhao J, Zhang R F, Xue C, et al. Pyrosequencing reveals contrasting soil bacterial diversity and community structure of two main winter wheat cropping systems in China[J]. Microbial Ecology, 2014, 67(2): 443-453.
[10] Chen M N, Li X, Yang Q L, et al. Dynamic succession of soil bacterial community during continuous cropping of peanut (Arachis hypogaea L.)[J]. PLoS One, 2014, 9(7): e101355.
[11] Dong L L, Xu J, Feng G Q, et al. Soil bacterial and fungal community dynamics in relation to Panax notoginseng death rate in a continuous cropping system[J]. Scientific Reports, 2016, 6(1): 31802.
[12] Zhao J, Zhang D, Yang Y Q, et al. Dissecting the effect of continuous cropping of potato on soil bacterial communi-ties as revealed by high-throughput sequencing[J]. PLoS One, 2020, 15(5): e233356.
[13] Gao Z Y, Hu Y Y, Han M K, et al. Effects of continuous cropping of sweet potatoes on the bacterial community structure in rhizospheric soil[J]. BMC Microbiol, 2021, 21:102, https://doi.org/10.1186/s12866-021-02120-6.
[14] Chen J, Gong J L, Xu M G. Implications of continuous and rotational cropping practices on soil bacterial communities in pineapple cultivation[J]. European Journal of Soil Bi-ology, 2020, 97: 103172.
[15] 殷继忠, 李 亮, 接伟光, 等. 连作对大豆根际土壤细菌菌群结构的影响[J]. 生物技术通报, 2018, 34(1): 230-238.
[16] Marschner P, Crowley D, Yang C H. Development of spe-cific rhizosphere bacterial communities in relation to plant species, nutrition and soil type[J]. Plant Soil, 2004, 261(1/2): 199-208.
[17] 陈晓婷, 王裕华, 林立文, 等. 连作百香果对土壤理化性质和微生物特性的影响及病原真菌的分离与鉴定[J]. 热带作物学报, 2021, 42(2): 495-502.
[18] Mori H, Maruyama F, Kato H, et al. Design and experimen-tal application of a novel non-degenerate universal primer set that amplifies prokaryotic 16S rRNA genes with a low possibility to amplify eukaryotic rRNA genes[J]. DNA Research, 2014, 21(2): 217-227.
[19] Chen S F, Zhou Y Q, Chen Y R, et al. fastp: an ultra-fast all-in-one FASTQ preprocessor[J]. Bioinformatics, 2018, 34(17): i884-i890.
[20] Mago T, Salzberg S L. FLASH: fast length adjustment of short reads to improve genome assemblies[J]. Bioinfor-matics, 2011, 27(21): 2957-2963.
[21] Zhang W, Du Y. Analysis of the succession of structure of the bacteria community in soil from long-term continuous cotton cropping in Xinjiang using high-throughput sequenc-ing[J]. Archives of Microbiology, 2018, 200(4): 653-662.
[22] 毕庆芳. 施肥模式和耕作年限影响土壤磷有效性和碳氮磷耦合转化的微生物学机制[D]. 杭州: 浙江大学, 2020.
[23] 程文文. 黄土高原半干旱区土壤生物性质对苜蓿种植年限和种植体系的响应[D]. 兰州: 甘肃农业大学, 2019: 54.
[24] 马 欣. 陇中半干旱区苜蓿种植年限对黄绵土微生物群落结构的影响解析[D]. 兰州: 甘肃农业大学, 2020: 68.
[25] 耿德洲, 黄菁华, 霍 娜, 等. 黄土高原半干旱区不同种植年限紫花苜蓿人工草地土壤微生物和线虫群落特征[J]. 应用生态学报, 2020, 31(4): 1365-1377.
[26] 张萌萌, 敖 红, 张景云, 等. 建植年限对紫花苜蓿根际土壤微生物群落功能多样性的影响[J]. 草业科学, 2014, 31(5): 787-796..
[27] Jiang S Q, Yu Y N, Gao R W, et al. High-throughput abso-lute quantification sequencing reveals the effect of different fertilizer applications on bacterial community in a tomato cultivated coastal saline soil[J]. The Science of the Total Environment, 2019, 687: 601-609.
[28] 施河丽, 向必坤, 谭 军, 等. 烟草青枯病发病烟株根际土壤细菌群落分析[J]. 中国烟草学报, 2018, 24(5): 57-65.
[29] Nacke H, Thürmer A, Wollherr A, et al. Pyrosequenc-ing-based assessment of bacterial community structure along different management types in German forest and grassland soils[J]. PLoS One, 2011, 6(2): e17000.
[30] Xiong W, Li Z G, Liu H J, et al. The effect of long-term continuous cropping of black pepper on soil bacterial com-munities as determined by 454 pyrosequencing[J]. PLoS One, 2015, 10(8): e136946.
[31] Grayston S J, Wang S, Campbell C D, et al. Selective influ-ence of plant species on microbial diversity in the rhizos-ph¬ere[J]. Soil Biology and Biochemistry, 1998, 30(3): 369-378.
[32] Devapriyanga R, Jonathan E. I, Meena K. S. Bioefficacy of pseudomonas and bacillus isolates against root-knot nema-tode, meloidogyne incognita in Black pepper cv. panniyur 1[J]. Indian Journal of Nematology, 2012, 42: 57-65.
[33] Myresiotis C K, Karaoglanidis G S, Vryzas Z, et al. Evalua-tion of plant-growth-promoting rhizobacteria, acibenzo-lar-S-methyl and hymexazol for integrated control of Fusa-rium crown and root rot on tomato[J]. Pest Management Science, 2012, 68(3): 404-411.
[34] Li H, Wang J Q, Liu Q, et al. Effects of consecutive mono-culture of sweet potato on soil bacterial community as de-termined by pyrosequencing[J]. Journal of Basic Microbiology, 2019, 59(2): 181-191.
責任编辑:白 净
