橡胶树红根病患病与健康植株根际土壤微生物结构及多样性分析
2021-01-13涂敏蔡海滨彭延麟官鑫伏雪曾霞胡彦师
涂敏 蔡海滨 彭延麟 官鑫 伏雪 曾霞 胡彦师



摘 要:为探究红根病对橡胶树根际土壤微生物多样性的影响,分别以患红根病和健康橡胶树根际土壤为研究对象,采用Illumina MiSeq高通量测序,分析了样本间的微生物群落结构和组成差异;同时测定根际土壤理化性质,分析其与土壤微生物群落的相关性。结果表明:患红根病橡胶树根际土壤真菌多样性显著降低,OTU数量和Alpha多样性指数均低于健康橡胶树根际土壤;患病植株根际土壤细菌多样性略高于健康植株根际土壤;患病植株根际土壤中真菌的群落结构发生明显改变,细菌群落结构变化较小;在属水平上,共检测出289类土壤真菌、525类土壤细菌,病原菌Ganoderma在患病植株根际土壤中相对丰度高达31.32%,在健康植株根际土壤中未检测到;有机质、有效磷、速效钾含量和pH在健康植株根际土壤中含量高,碱解氮在患病植株根际土壤中含量高;相关分析结果显示,Ganoderma丰度与土壤有机质含量和pH呈显著负相关。该结果为揭示红根病发生的根际微生态机制及研发红根病综合防控技术提供理论参考。
关键词:橡胶树;红根病;根际土壤;高通量测序;Alpha多样性
中图分类号:S794.1 文献标识码:A
Abstract: To explore the effect of red root rot disease on the microbial diversity of rhizosphere soil, the rhizosphere soil of diseased and healthy Hevea brasiliensis were selected as the research objects, and Illumina Miseq high-throughput sequencing was used to analyze the microbial community structure and composition differences. The physiochemical properties of the soil samples were also analyzed. Infestation caused by red root rot decreased the fungi diversity of rhizosphere soil significantly, the number of OTU and Alpha diversity index were both lower than those in the healthy soil. The bacteria diversity in the diseased soil was slightly higher than that in the healthy soil. The community structure of fungi in the diseased soil changed significantly, and the change of bacterial community structure was small. At genus level, there were totally 289 kinds of soil fungi, 525 kinds of bacteria detected, the relative abundance of pathogenic Ganoderma in the diseased soil was as high as 31.32%, which was not detected in the healthy soil. The content of organic matter, available phosphorus, available potassium and pH value of the rhizosphere soil were higher in the healthy soil, and the content of hydrolysable nitrogen was higher in the diseased soil. Correlation analysis showed that the abundance of Ganoderma was negatively correlated with the content of organic matter and pH value. This research revealed the micro-ecological changes of the rhizosphere with the occurrence of red root rot disease and would provide theoretical support for developing a comprehensive control method of red root rot.
Keywords: Hevea brasiliensis; red root rot; rhizosphere soil; high-throughput; Alpha-diversity
DOI: 10.3969/j.issn.1000-2561.2021.12.034
天然橡膠是重要的工业原料和战略资源,全球99%以上的天然橡胶由巴西橡胶树(Hevea brasiliensis)生产[1-2]。红根病是橡胶树危害面积最广、影响最大的世界性土传病害,严重缩短橡胶树的生产寿命和产胶量,给橡胶产业带来巨大损失[3]。根据形态学和分子鉴定,红根病病原菌为橡胶灵芝菌(Ganoderma pseudoferreum)[4-5]和菲律宾灵芝(Ganoderma philippii)[6],其具有寄主范围广(10多种作物)、潜伏期长(土壤中能达2年以上)[7]、蔓延较快(年均蔓延量为1.83 m)[8]等特点。目前在我国海南、云南、广东等各植胶区均普遍发生[9-10],尤其海南屯昌市、儋州市和云南河口县等地部分林段的胶林红根病较重,发病率可达40%,未进行预防处理的幼树区高达60%,若不及时处理,死亡率可达100%[6, 11]。多年来,生产上主要使用机械挖除和十三吗啉来防治红根病[12-13],但存在费用高、环境污染、防效下降等问题;木霉菌等生防菌对红根病的拮抗作用在实验室得到验证[14-15],未见胶园防效报道。
土传病害发生的主要场所为根际,根际是作物吸收营养成分的窗口,是寄主、土壤和微生物相互作用的关键区域[16]。相比于单个优势菌易受到生态适应性、土著微生物竞争及病原菌免疫等因素的影响,多样类型的组合菌群既可以提高微生物的根际定殖能力,还会扩大抑制病原菌的范围[17-18]。根际微生物对寄主生长的作用主要分为2类:第1类促进寄主的生长,主要是通过养分竞争、拮抗作用或诱导寄主的系统抗性等抑制病原菌的蔓延[19];第2类是加速寄主的死亡,主要是通过促进土壤中病原菌的积累来完成[20]。因此,通过研究橡胶树感染红根病后根际土壤微生物群落组成及其多样性变化,对了解橡胶树红根病发生及扩散传播策略具有重要意义。近年来,Illumina高通量测序技术因其高效、快速、准确的特点,已经广泛应用于根际土壤微生物多样性研究中[21-22],为揭示土壤微生物丰度、物种组成提供大量的信息。以往调查表明,橡胶树根病区土壤养分水平偏低,不利于橡胶树根系生长[23],但未见胶园土壤理化性质与红根病发生之间的相关性研究报道。本研究从橡胶树根际土壤微生态角度出发,通过土壤微生物的高通量测序,比较分析患红根病和健康橡胶树根际土壤微生物的Alpha多样性、群落组成及其与土壤理化因子的相关性,为进一步深化红根病发生机理研究,为找到防控橡胶树红根病的有效方法提供理论参考。
1 材料与方法
1.1 材料
患红根病和健康橡胶树的根际土壤样品于2020年9月采集于海南省昌江县龙江农场。龙江农场位于北纬19°1857,东经109°1745,海拔127.76 m,年平均气温22.6 ℃,年降雨量2100 mm。橡胶树种植品种为‘PR107’,树龄18 a。选取树冠稀疏、枯枝多的红根病植株,距离主干30 cm处,挖掘深度25~30 cm,取出红褐色病根,收集其根际土壤。选取与病树相隔2株或以上,新生出的枝条丰富、生长势旺盛且前后左右4株均无发病的健康橡胶树,同样方法采集健康橡胶树根际土壤。共采集患红根病橡胶树根际土壤3份,标记为Disease 1、Disease 2和Disease 3;健康橡胶树根际土壤3份,标记为Health 1、Health 2和Health 3。部分根际土用5 mL带盖离心管储存于液氮罐,随后干冰保存送至上海美吉生物医药科技有限公司进行土壤微生物高通量测序;另一部分土壤室温风干,用于土壤理化性质分析。
1.2 方法
1.2.1 微生物多样性测定 采用E.Z.N.A. soil试剂盒(Omega Bio-tek)进行土壤DNA提取,DNA浓度和纯度采用NanoDrop2000进行检测;细菌16S扩增引物为338F和806R;真菌PCR扩增引物为ITS1F和ITS2R。使用Illumina公司的Miseq PE300平台进行测序,原始数据上传至NCBI数据库。
1.2.2 土壤理化性质测定 参考鲍士旦[24]的方法对土壤碱解氮(HN)、有效磷(AP)、速效钾(AK)、有机质(SOM)、土壤pH 5种土壤理化因子进行测定。
1.3 数据处理
采用Excel 2010软件对土壤理化性质数据进行统计处理,独立样本t检验选用IBM SPSS Statistics 21;使用UPARSE(version 7.1)根据97%的相似度对序列进行操作分类单元(operational taxonomic units, OTU)聚类;通过和Silva数据库进行比对,设置70%比对阈值,物种分类注释采用软件RDP classifier;通过MOTHUE(version v.1.30)分析微生物Alpha多样性,共选取了5项多样性指数,其中Sobs、Chao、Ace反映土壤微生物群落的丰富度,Shannoneven反映群落均匀度,Shannon反映群落的多样性;采用R(Version 2.15.3)绘制分析结果。
2 结果与分析
2.1 患红根病和健康橡胶树根际土壤微生物的OTU分类
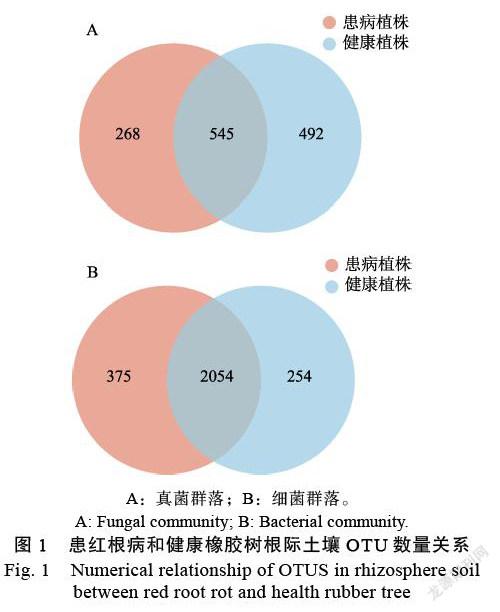
患红根病和健康橡胶树根际土壤真菌群落中分別检测到813、1037个OTU(图1A),其中共有OTU为545个,健康橡胶树根际土样特有OTU为492个,患红根病橡胶树根际土样特有OTU为268个;结果表明,感染红根病后,橡胶树根际土壤真菌OTU数量降低。患红根病和健康根际土壤细菌群落中分别检测到2429、2308个OTU(图1B),其中共有OTU为2054个,患红根病橡胶树根际土样特有OTU为375个,健康橡胶树根际土样特有OTU为254个。感染红根病后,橡胶树根际土壤细菌OTU数量与真菌相反,略微增加。
2.2 患红根病和健康橡胶树植株根际土壤微生物Alpha多样性
根际土壤微生物多样性扩增项目号为PRJN¬A-746358,具体扩增结果序列号见表1。结果显示,土壤微生物群落的覆盖率为99.86%~99.99%,说
明建立的文库能真实、有效地反映土壤环境微生物的多样性。土壤中细菌的5项多样性指数均高于真菌;健康橡胶树根际土壤真菌Alpha多样性显著高于患红根病植株根际土壤(P<0.05),而健康橡胶树根际土壤细菌Alpha多样性低于患红根病植株根际土壤,但差异不显著(P>0.05)。
2.3 患红根病与健康橡胶树根际土壤微生物群落特征
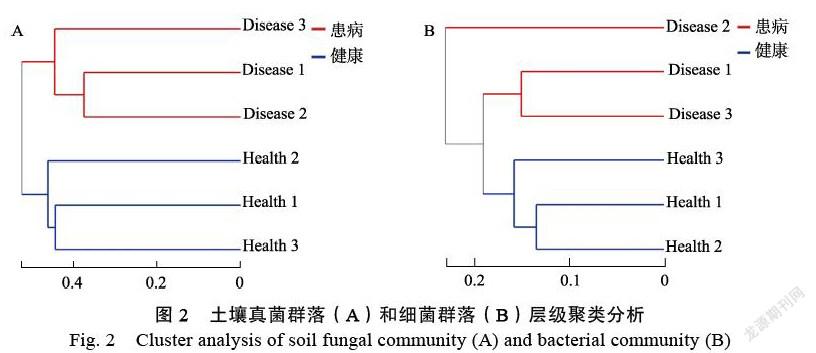
2.3.1 土壤微生物群落结构相似性分析 根据Beta多样性距离矩阵,使用UPGMA算法构建的层级聚类,分析不同样本中群落组成的相似和差异程度。通过患红根病与健康橡胶树根际土壤生物群落的层级聚类图(图2),健康橡胶树根际土壤与患病植株根际土壤真菌群落的距离阈值为0.526时,分为单独的2支,样本间的距离相差较大。而土壤根际细菌在距离阈值为0.229时,患病植株根际土壤样本2(Disease 2)为单独一支;距离阈值为0.190时,另外2个患病橡胶树根际土壤样本与健康植株根际土壤样本分开;各样本间距离相差较小。可知红根病的发生主要改变了橡胶树根际土壤的真菌群落结构。
2.3.2 土壤真菌群落结构分析 对患红根病和健康橡胶树根际土壤真菌在不同分类水平进行群落结构分析。在门水平上,健康橡胶树和患病植株根际土样检测到的真菌类型一致,主要包括担子菌门(Basidiomycota)、子囊菌门(Ascomycota)、球囊菌门(Glomeromycota)、被孢霉门(Mortierellomycota)和未知真菌。
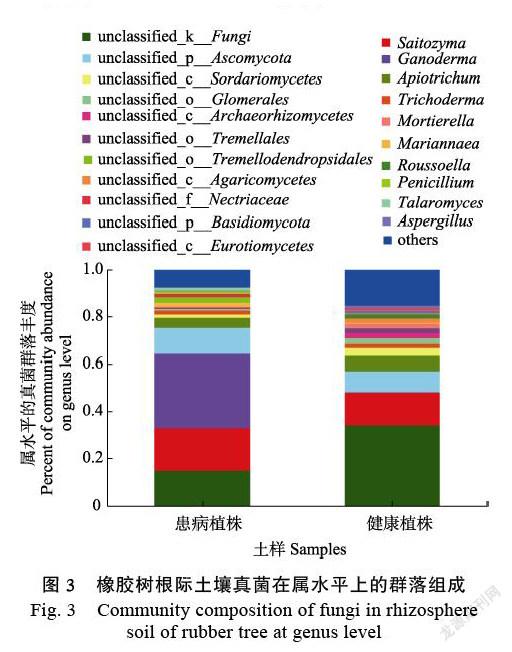
在属水平上,土壤真菌群落共检测出289类,其中患病橡胶树根际土壤221类,健康植株根际土壤252类。橡胶树根际土壤真菌在属水平上的群落组成显示,2类土壤优势真菌差异较大。健康橡胶树根际土壤中富集未知真菌、Apiotrichum、Trichodema、未知Sordariomycetes、Glomerales等真菌,而患红根病橡胶树根际土壤中富集Saitozyma、Ganoderma、未知Ascomycota等真菌(图3)。经种水平群落组成鉴定,患病橡胶树根际土壤中的土壤中富集的Ganoderma即为橡胶树红根病的病原菌,且其在患病植株根际土壤中相对丰度高达31.32%,在健康植株根际土壤中未检测到。
2.3.3 土壤细菌群落结构分析 对患红根病和健康橡胶树根际土壤细菌在不同分类水平进行群落结构分析。在门水平上,健康和患病土壤共检测到33个门的细菌,其中变形菌门(Proteobecteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidoba¬ct¬eriota)、放线菌门(Actinobacteriota)均为二者的优势细菌,纤维杆菌门(Fibrobacterota)为患病土壤特有细菌。
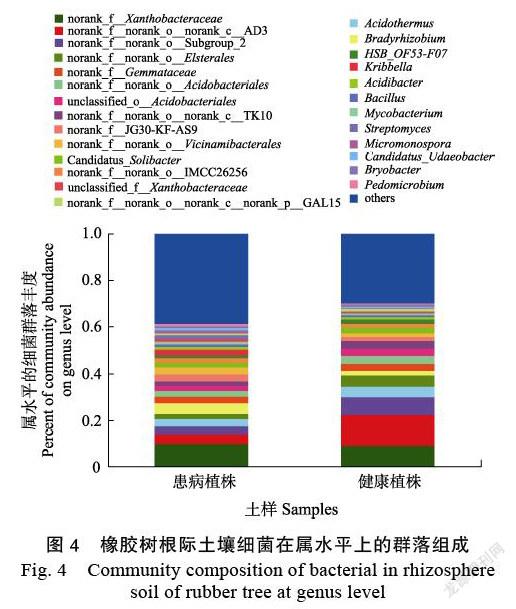
在属水平上,土壤细菌群落共检测出525类,其中患病橡胶树根际土壤490类,健康植株根际土壤474类。橡胶树根际土壤细菌在属水平上的群落组成显示,各属在土壤中丰度差异不大,未知Xanthobacteraceae、Acidothermus、未知Elsterales、Bradyrhizobium等為优势菌群(图4)。
2.4 橡胶树根际土壤微生物群落结构与根际土壤理化性质的关系
2.4.1 橡胶树根际土壤的理化性质差异 对患红根病和健康橡胶树根际土壤进行5类理化性质的测定,结果见表2,健康橡胶树根际土壤的AP、AK、SOM和pH均显著高于患红根病橡胶树根际土壤(P<0.05);健康橡胶树根际土中的HN显著低于患红根病橡胶树根际土样(P<0.05)。
2.4.2 橡胶树根际土壤微生物多样性与土壤理化性质的相关性分析 通过Spearman等级相关系数来分析优势菌属与土壤理化性质的相关性,结果见表3,土壤微生物多样性水平与土壤理化性质中AP、AK、SOM和pH呈正相关,与HN含量呈负相关。其中真菌群落多样性与AP、SOM和pH呈显著性相关(P<0.05),细菌群落多样性与HN、SOM和pH显著性相关(P<0.05)。根际土壤真菌和细菌中属级别前30物种的OTUs相对丰度与土壤理化因子得到的相关性热图也支持上述结果(图5)。从图5A可见,红根病病原菌Ganoderma与土壤有机质含量呈显著负相关,与土壤pH呈极显著负相关(P<0.05)。
3 讨论
土壤微生物学特征能在一定程度上反映土壤的质量和健康程度,当土传病害发生时,健康植株与发病植株根际土中的微生物多样性以及群间的动态平衡往往差异巨大[25]。微生物群落多样性指数越高,表明其群落结构越复杂,其系统就越稳定,应对环境变化、病原菌侵染的能力就越强[26]。本研究发现,当橡胶树根部受红根病侵染后,根际土壤中真菌多样性显著降低,患病植株根际土壤的Sobs、Shannon和Shannoneven指数显著低于健康植株根际土壤。该结果与多种作物土传病害植株根际土壤真菌群落的研究结果一致[27-30]。红根病病原菌Ganoderma在患病橡胶树根际土壤中相对丰度高达31.32%,在健康橡胶树根际土壤中未检测到,表明病原菌在土壤中累积成为优势种,抑制了其他真菌的增殖,导致土壤真菌多样性降低。研究同时发现,患病橡胶树根际土壤中细菌多样性比健康植株根际土壤高,这个结果与常见土传病害侵染后细菌多样性变化不一致,但该现象在人参红皮病根际土壤中也有发现[31]。可能是因为橡胶树红根病的发生导致橡胶树根际土壤生态条件的改变,促进一些微生物的生长繁殖,从而使根际土壤细菌物种多样性变得更加丰富。
患红根病橡胶树根际土壤的细菌菌群中检测出1个特有菌群——纤维杆菌科细菌,在健康植株根际土壤样品中未被发现。据其他学者报道[32],土壤中纤维杆菌科相对丰度在入侵杂草中高于本地草本,在竞争处理中也保持较高水平,并与本地草本植物的竞争反应呈显著负相关,推测纤维杆菌科细菌在削弱本地草本植物的竞争能力中发挥作用。尽管纤维杆菌科在重金属含量高的土壤中丰度通常较低[33],但该科也与入侵草优势正相关[34]。此外,纤维杆菌科主要作用是降解其纤维素,经常在动物瘤胃中发现[35-36],因此可能是有机物分解的重要分类群[37]。推测Ganoderma侵染橡胶树根颈后,根际的纤维杆菌科细菌在降解橡胶树根部纤维素中发挥作用。
土壤的理化性质可通过影响植物生理间接改变根际微生物的组成及相对丰度[38-39]。本研究发现,健康橡胶树根际土壤中的有机质、有效磷、速效钾的含量和pH均比患病植株根际土壤高,这与云南河口根病区调查结果一致[4]。本研究将土壤微生物多样性指数与土壤理化因子进行相关性分析,发现Ganoderma丰度与土壤有机质含量和pH值显著负相关。pH一直被认为是影响土壤微生物群落结构最重要的化学特性之一[40-41],而橡胶树适宜于有机质丰富、土层深厚肥沃的酸性土壤(pH 4.0~6.5)[42],胶林土壤有机质含量高或增施有机肥料都具有抑制根病侵染蔓延和促进病树自愈的作用[43]。因此在胶林中适当增施有机肥,调控土壤pH可能对于橡胶树红根病的防控产生较好效果。
参考文献
[1] Allen P W, Jones K P. A historical perspective of the rubber industry[M]//Roberts A D. Natural rubber science and tech-nology. Oxford: Oxford University Press, 1988.
[2] 何长辉, 莫业勇, 刘锐金. 中国天然橡胶生产能力预测分析(2019—2025年)[J]. 林业经济问题, 2020, 40(3): 320-327.
[3] 郑服丛. 我国橡胶植保科技的现状与展望[J]. 中国热带农业, 2011(4): 37-40.
[4] 白建相, 王 涓, 黄 林, 等. 云南河口垦区橡胶树根病普查及治理方法探讨[J]. 热带农业科技, 2008, 31(4): 7-11.
[5] 丁雄飞, 刘昌芬. 云南橡胶树灵芝分类研究[J]. 云南热作科技, 1995, 18(2): 14-19.
[6] 丁婧钰. 橡胶树与相思树病原灵芝种类鉴定及生物学特性研究[D]. 海口: 海南大学, 2018.
[7] 何 康, 黄宗道. 热带北缘橡胶树栽培[M]. 广州: 广东科技出版社, 1987: 294-300.
[8] 张运强, 张辉强. 橡胶树红根病的蔓延速度及预测预报[J]. 热带作物学报, 1998, 19(1): 7-12.
[9] 张 贺, 蒲金基, 张 欣, 等. 橡胶树红根病病原菌生物学培养特性[J]. 热带作物学报, 2008, 29(5): 632-635.
[10] 张运强, 张辉强, 邓晓东. 橡胶树红根病病原菌的鉴定[J]. 热带作物学报, 1997, 18(1): 16-23.
[11] Gohet E, Canh T V, Louandri M, et al. New developments in chemical control of white root disease of Hevea brasiliensis in Africa[J]. Crop Protection, 1991, 10(3): 234-238.
[12] 林盛武, 吳吉祥, 郭泽忠, 等. 十三吗啉防治橡胶红根病[J]. 农药, 1992, 31(3): 57-58.
[13] 贺春萍, 李 锐, 梁艳琼, 等. 不同地区橡胶树红根病菌的生物学特性及室内毒力测定[J]. 热带作物学报, 2019, 40(3): 522-529.
[14] 秦云霞, 涂 敏, 阳美芳, 等. 8株木霉菌对橡胶树红根病的拮抗作用[J]. 热带农业科学, 2015, 35(3): 41-45, 53.
[15] Ogbebor N O, Adekunle A T, Eghafona N O, et al. Gano-derma psuedoferreum: Biological control possibilities with microorganisms isolated from soils of rubber plantations in Nigeria[J]. African Journal of General Agriculture, 2010, 6(4): 301-305.
[16] 杨 珍, 戴传超, 王兴祥, 等. 作物土传真菌病害发生的根际微生物机制研究进展[J]. 土壤学报, 2019, 56(1): 12-22.
[17] 柳少燕, 陈捷胤, 李 蕾, 等. 拮抗菌与病原菌碳水化合物酶类比较分析[J]. 基因组学与应用生物学, 2013, 32(1): 97-104.
[18] Niu B, Paulson J N, Zheng X Q, et al. Simplified and repre-sentative bacterial community of maize roots[J]. Proceed-ings of the National Academy of Sciences of the United States of America, 2017, 114(12): 2450-2459.
[19] Bakker P A H M, Doornbos R F, Zamioudis C, et al. Induced systemic resistance and the rhizosphere micro-biome[J]. The Plant Pathology Journal, 2013, 29(2): 136-143.
[20] Santhanam R, Luu V T, Weinhold A, et al. Native root-associated bacteria rescue a plant from a sudden-wilt disease that emerged during continuous cropping[J]. Pro-ceedings of the National Academy of Sciences, 2015, 112(36): 5013-5020.
[21] 杨丹丹, 胡承孝, 程 勤, 等. 根肿菌与根系互作效应及其影响因素研究进展[J]. 中国农学通报, 2019, 35(34): 77-81.
[22] Yu M, Jiang J L, Ren X M, et al. Research on relationship between occurrence of root rot and changes of fungal com-munities in rhizosphere of Panax quinquefolius[J]. China Journal of Chinese Materia Medica, 2018, 43(10): 2038-2047.
[23] 王树明, 周 敏, 陈鸿洁, 等. 河口垦区橡胶树根病区土壤养分调查[J]. 热带农业科技, 2008, 31(4): 12-13.
[24] 鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000.
[25] 韦 中, 沈宗专, 杨天杰, 等. 从抑病土壤到根际免疫:概念提出与发展思考[J]. 土壤学报, 2021, 58(4): 814-824.
[26] 邵秋雨, 董醇波, 韩燕峰, 等. 植物根际微生物组的研究进展[J]. 植物营养与肥料学报, 2021, 27(1): 144-152.
[27] 杨光柱, 黄文静, 李云国, 等. 苹果根腐病根际土壤真菌组成及多样性研究[J]. 果树学报, 2020, 37(6): 875-881.
[28] 伍文宪, 黄小琴, 张 蕾, 等. 十字花科作物根肿病对根际土壤微生物群落的影响[J]. 生态学报, 2020, 40(5): 1532-1541.
[29] 李忠奎, 凌爱芬, 李红丽, 等. 基于多样性测序对健康与易感病烟田根际土壤微生物群落分析[J]. 河南农业大学学报, 2019, 53(6): 918-925.
[30] 谢玉清, 茆 军, 王 玮, 等. 大蒜根腐病根际土壤真菌群落结构及多样性分析[J]. 中国农学通报, 2020, 36(13): 145-153.
[31] 徐成路. 人参红皮病根际土壤特性研究[D]. 北京: 中国农业科学院, 2016.
[32] Laforgia M L, Kang H, Ettinger C L. Competitive outcomes between native and invasive plants are linked to shifts in the bacterial rhizosphere microbiome[J/OL]. bioRxiv, 2021. (2021-01-08)[2021-05-18]. https://www.biorxiv.org/content/ 10.1101/2021.01.07.425800v2.
[33] Syranidou E, Thijs S, Avramidou M, et al. Responses of the endophytic bacterial communities of Juncus acutus to pollution with metals, emerging organic pollutants and to bioaugmentation with indigenous strains[J]. Fronters in Plant Science, 2018, 9: 1526.
[34] Fahey C, Koyama A, Antunes P M, et al. Plant communities mediate the interactive effects of invasion and drought on soil microbial communities[J]. The ISME Journal, 2020, 14(6): 1396-1409.
[35] Rubino F, Carberry C, Sinéad M W, et al. Divergent func-tional isoforms drive niche specialisation for nutrient acquisition and use in rumen microbiome[J]. The ISME Journal, 2017, 11(4): 932-944.
[36] Ozbayram E, Ince O, Ince B, et al. Comparison of rumen and manure microbiomes and implications for the in-oculation of anaerobic digesters[J]. Microorganisms, 2018, 6(1): 15.
[37] Nuccio E E, Starr E, Karaoz U, et al. Niche differentiation is spatially and temporally regulated in the rhizosphere[J]. The ISME Journal, 2020, 14(4): 999-1014.
[38] Lareen A, Burton F, Schäfer P. Plant root-microbe commu-nication in shaping root microbiomes[J]. Plant Molecular Biology, 2016, 90(6): 575-587.
[39] Liu F, Hewezi T, Lebeis S L, et al. Soil indigenous micro-biome and plant genotypes cooperatively modify soybean rhizosphere microbiome assembly[J]. BMC Microbiology, 2019, 19(1): 1-19.
[40] Fierer N, Jackson R B. The diversity and biogeography of soil bacterial communities[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(3): 626-631.
[41] Rousk J, Brookes P C, Baath E. Contrasting soil pH effects on fungal and bacterial growth suggest functional redundan-cy in carbon mineralization[J]. Applied & Environmental Microbiology, 2009, 75(6): 1589-1596.
[42] 张希财, 谢贵水. 我国植胶区高产橡胶园产量狀况和栽培措施[J]. 中国热带农业, 2018(6): 6-9.
[43] 黄雅志, 刘昌芬. 橡胶树根病及其治理措施[J]. 云南热作科技, 1993, 16(1): 7-14, 29.
责任编辑:黄东杰
