临床药师参与1例大剂量甲氨蝶呤致淋巴瘤患者急性肾功能衰竭的诊治的病例分析
2021-01-13吴薇李晓宇吕迁洲
吴薇 李晓宇 吕迁洲
摘 要 目的:探讨临床药师在救治药源性急性肾功能衰竭中的药学服务作用。方法:以1例大剂量甲氨蝶呤致淋巴瘤患者急性肾功能衰竭的药物治疗过程为例,根据患者的病情变化和治疗效果及时调整治疗方案,并对患者进行药学监护。结果:临床药师通过参与患者的药学监护,提出药学建议,促进临床用药的安全性,改善临床治疗结局。结论:临床药师参与药源性急性肾功能衰竭的救治,可以为患者提供个体化给药方案,并且提高了临床对药源性疾病的认识,优化药物治疗方案,为今后的用药提供参考依据。
关键词 大剂量甲氨蝶呤 急性肾功能衰竭 药学监护
中图分类号: R979.12; R692.5 文献标志码:B 文章编号:1006-1533(2021)23-0086-05
Clinical pharmacists participate in the diagnosis and treatment of a lymphoma atient with acute renal failure caused by high dose methotrexate
WU Wei, LI Xiaoyu, LYU Qianzhou
(Department of Pharmacy, Zhongshan Hospital, Fudan University, Shanghai 200032, China)
ABSTRACT Objective: To explore the pharmaceutical care role of clinical pharmacists in the treatment of druginduced acute renal failure. Methods: Taking a case of acute renal failure caused by high dose methotrexate as an example, the treatment plan was adjusted in time according to the patient’s conditions and treatment effect, and meanwhile the patient was given pharmaceutical care. Results: By participating in the pharmaceutical care of the patient, clinical pharmacists put forward pharmaceutical suggestions to promote the safety of clinical medication and improve the outcomes of clinical treatment. Conclusion: Clinical pharmacists participating in the treatment of drug-induced acute renal failure can provide individualized drug delivery programs for patients and improve the clinical understanding of drug-induced diseases, optimize drug treatment programs and provide reference for future drug use.
KEY WORDS high dose methotrexate; acute renal failure; pharmaceutical care
大劑量甲氨蝶呤(HDMTX)是多种恶性肿瘤的治疗方案中必不可少的部分。当以大剂量给药时,甲氨蝶呤(MTX)可在肾小管沉淀,并直接引起肾小管损伤。存在酸性尿和容量不足的情况下,这一风险会增加。在临床应用过程中需要加强血药浓度监测,并根据病情及时调整治疗方案。本研究就临床药师参与1例HDMTX致淋巴瘤患者急性肾功能衰竭的临床诊治病例进行具体分析,以期为临床治疗提供参考。
患者,男,61岁,身高180 cm,体重87 kg,因“双眼视物模糊1年,确诊右眼淋巴瘤半月余”,于2018年11月26日入院行“利妥昔单抗+甲氨蝶呤”方案化疗。11月28日行HDMTX 16 g化疗,给予预防性保肝,检测MTX 0 h血药浓度为700.00 mmol/L。29日检测MTX 24 h血药浓度为41.25 mmol/L,肌酐158 mmol/L,总胆红素、直接胆红素、丙氨酸氨基转移酶、天冬氨酸氨基转移酶、碱性磷酸酶明显增高,考虑MTX所致严重肾损伤、轻度肝损伤,继续给予保肝治疗、水化、利尿,同时给予亚叶酸钙50 mg,每6 h给药一次进行解毒治疗。30日检测MTX 48 h血药浓度为27.60 mmol/L,肌酐266 mmol/L,尿酸出现增高为483 mmol/L,小便量尚可,肝功指标出现好转,LDH持续增高,继续目前治疗方案。12月1日检测MTX 72 h血药浓度为5.63 mmol/L,肌酐302 mmol/L,尿酸483 mmol/L,肝功指标正常,碱性磷酸酶为248 mmol/L,考虑为MTX所致肾损伤,肾内科会诊后尚无透析指征,继续目前水化、利尿、亚叶酸钙解毒治疗。12月2日检测MTX 96 h血药浓度为1.8 mmol/L,尿酸466 mmol/L,肌酐300 mmol/L,未继续升高,MTX浓度较前下降。12月3日MTX 120 h血药浓度为1.15 mmol/L,加用地塞米松20 mg治疗。12月4日MTX血药浓度为0.61 mmol/L,肌酐246 mmol/L。12月5日—8日MTX血药浓度分别为0.29、0.19、0.13、0.12 mmol/L;5日AST、ALT再次出现升高,继续保肝治疗,9日肝功能指标恢复正常值;期间肌酐持续下降,9日时肌酐为200.00 mmol/L。患者高血压病史1年,口服降压药(洛汀新),血压控制尚可。入院诊断:B细胞淋巴瘤。
2.1 MTX所致肾损伤的解救
MTX为叶酸还原酶抑制药,主要通过抑制二氢叶酸还原酶而使二氢叶酸不能还原成具有生理活性的四氢叶酸,从而使嘌呤核苷酸和嘧啶核苷酸的生物合成过程中一碳基团的转移作用受阻,导致DNA的生物合成明显受抑制,主要作用于细胞周期的S期,属细胞周期特异性药物,对G1/S期的细胞亦有延缓作用,对G1期细胞的作用较弱。静脉给药后,MTX广泛分布于体内。在血清中,约50%为蛋白/白蛋白结合型,MTX的给药剂量大于1 000 mg/m2时,血药浓度峰值范围是500~1 500 μmol/L。静脉给药后的总体半衰期在8~12 h之间。24 h时超过5~10 μmol/L,48 h时超过1 μmol/L,72 h时超过0.1 μmol/L,预示药物毒性增强[1]。
患者24 h MTX血药浓度为41.25 mmol/L,48 h血药浓度为27.60 mmol/L,72 h血藥浓度为5.63 mmol/L,严重超过正常血药浓度,且肌酐水平不断上升,给予水化、利尿治疗,每6 h给药一次亚叶酸钙50 mg进行解救,因患者小便量尚可故未进行透析治疗。搜索相关文献,通过腹膜透析、血液透析进行MTX清除的成功案例已有报道,但也有报道指出虽然透析期间血浆MTX水平暂时下降,透析时药物浓度恢复到正常水平,但患者的MTX总清除率未见改变,随着透析的停止,血浆MTX浓度很快恢复到预处理水平。因此,无论是腹膜透析还是血液透析,对于血浆MTX水平高、肾功能衰竭程度轻至中度的患者,均无明显疗效[2]。其他严重的并发症如血小板减少、白细胞减少、低钙血症、体温过低、纤维蛋白原减少和低血糖等也有报道[3-4]。白蛋白透析(SPAD)是在透析液中加入白蛋白,但它不像在肝透析中去除毒素的分子吸收再循环系统(MARS)那样经过循环过程。SPAD不仅提供了一种持续的治疗,而且通过使用白蛋白作为透析液[5],增加了毒素清除的强度。一成功案例报道中患者为一名11岁女孩(体重38 kg),左髋关节骨肉瘤,用HDMTX以12 g/m2的剂量治疗,治疗后发生严重肾脏损伤,采用白蛋白透析和白蛋白透析液进行单次治疗,MTX浓度下降明显,后用透析和血液灌流(HP)治疗,血清MTX和肌酐水平显著反弹,再次使用白蛋白透析治疗46 h后好转[6]。这也为透析治疗MTX中毒提供了一个思考的方向。木炭血液灌流是一种吸附疗法,早期使用HP的重点是清除无法使用解毒剂的毒素或毒物,其缺点不能使电解质紊乱正常化,而且随着高通量、高效透析过滤器HD技术的发展,木炭血液灌流的使用也逐渐减少[7]。
谷卡匹酶也是MTX中毒解救药物,能够使叶酸和叶酸拮抗物C端谷氨酸盐水解,将MTX转化为非活性代谢物4-脱氧-4-氨基-N10-甲基蝶酸(DAMPA)和谷氨酸盐,从而降低血浆中MTX的浓度,T1/2为5.6 h,用于治疗由肾功能受损导致MTX清除延迟造成的MTX中毒[8]。对于此药的安全性已有研究,一项纳入43例成年及老年患者的研究中表明糖苷酶治疗MTX延迟是安全的,可评估的24例患者在初次使用糖苷酶后有效地减少了血浆中MTX的暴露浓度,但是糖苷酶可能偶尔导致抗体的形成(研究中3名患者再次使用糖苷酶后MTX水平出现显著反弹上升,检测发现了抗糖苷酶抗体),在重复给药时可能降低酶的活性[9]。另一项研究中纳入140例使用MTX患者,有83例(59%)使用糖苷酶后MTX浓度快速且持续降低。64%的肾功能损害大于或等于2级不良反应事件的患者在使用糖苷酶后12.5 d中位恢复到0级或1级,研究表明葡糖苷酶可使肾损害患者血清MTX水平持续下降99%以上,且无创伤性[10]。而使用谷卡匹酶治疗后是否还可以使用HDMTX治疗,也是众多研究者关注的问题。一项病例系列研究显示再次使用HDMTX进行治疗是有可能性的,该研究纳入了20例因HDMTX引起的急性肾损伤接受谷卡匹酶治疗的儿童,其中13例患儿在肾功能恢复后再次接受了HDMTX治疗。12例患儿的MTX剂量进行了下调,减至急性肾损伤相关初始剂量的33%~75%;而1例骨肉瘤患儿则接受了推荐剂量的全量(12 g/m2),血清肌酐的最大值为0.8 mg/dL;在随后的HDMTX疗程中没有一例患儿需要谷卡匹酶治疗,此研究表明谷卡匹酶治疗后,在密切监测肾功能和血浆MTX水平的情况下恢复HDMTX治疗是安全的[11]。
2.2 亚叶酸钙的剂量选择
鉴于MTX中毒的解救药谷卡匹酶还没有在国内上市,国内目前可用药物还是以亚叶酸钙为主。目前市面所售亚叶酸主要是亚叶酸钙和左旋亚叶酸钙,亚叶酸(D, L-亚叶酸外消旋混合物)是四氢叶酸(THF)的5-甲酰衍生物的非对映异构体混合物,其生物活性物质为左旋体,称为左亚叶酸。但胸水、腹水多是左亚叶酸治疗的禁忌证,所以该患者选用亚叶酸进行治疗[12]。对于亚叶酸钙注射剂和口服片剂的选择应根据给药剂量进行选择,剂量小于等于25 mg,可优先选择口服亚叶酸钙(剂量大于40 mg时口服生物利用度会降低);大于25 mg的剂量时,优先选择静脉给予亚叶酸钙或左亚叶酸[13]。表1和表2列出了亚叶酸钙和左亚叶酸钙说明书用于MTX的“解救”治疗指导剂量表[12,14]。
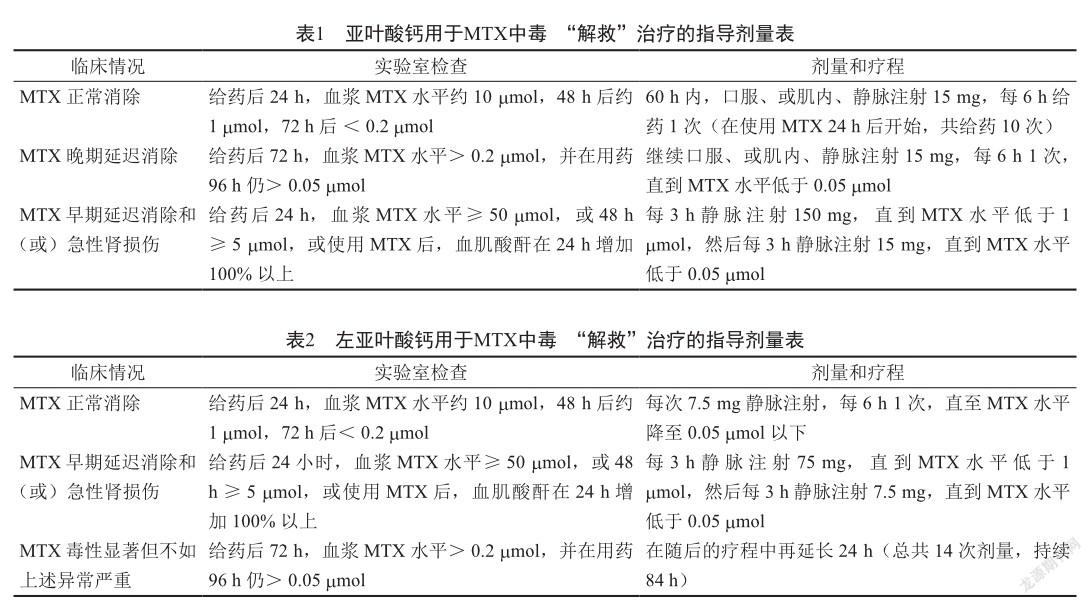
因为亚叶酸钙在进行解毒治疗的时候也能抵消MTX的治疗作用,而且亚叶酸钙的神经毒性也经常发生,所以大剂量的亚叶酸钙进行解救是否存在过度解救是很多临床医生关心的问题,同时因为亚叶酸钙没有足量使用延迟解救的情况也有发生。在一项针对头颈部癌症患者的研究中发现,MTX 40 mg/m2的治疗效果可以被40 mg/m2的叶酸所抵消[15]。Diddens等[16]也发现,治疗骨肉瘤细胞系用MTX 10~7 mol可导致细胞生长停止,12 h后给予叶酸10~6 mol可逆转MTX的细胞毒性,而10~6 mol和10~5 mol的MTX只会被10~5 mol和10~4 mol的叶酸部分逆转。这些研究都表明亚叶酸钙虽然可抵消MTX的治疗效果,但大剂量MTX同样需要大剂量亚叶酸钙进行解救。有研究人员在细胞学实验和白血病小鼠模型中给予MTX 400 mg/kg(相当于人类12~15 g/m2)16 h后给予亚叶酸钙400 mg/kg(相当于人类12 000 mg/m2)或24 mg/kg(相当于700 mg/m2),观察到在细胞和动物小肠内有相同的药物保留效果,且24 mg/kg给药方式可以使更多的白血病细胞死亡,并减少了动物实验中药物毒性反应的发生[17]。临床案例报道中检索到1例骨肉瘤患者,在第二次MTX后30~120 h使用大剂量亚叶酸钙1 275 mg(930 mg/m2),而不是30~102 h使用亚叶酸钙760 mg(MTX与叶酸的比值为22∶1,而不是通常的36∶1),导致肿瘤复发,后改为顺铂、异环磷酰胺、阿霉素治疗,但切除的股骨下段仍有10%~15%的肿瘤存活,再次通过MTX进行治疗后好转[18]。这个病例也说明大剂量的亚叶酸钙来预防肾脏功能衰竭后血清中MTX水平过高的潜在毒性时的风险,会使患者面临肿瘤复发的危险。目前对于亚叶酸钙使用的上限值没有明确的规定,根据12.5~20 g/m2 MTX和760 mg/m2(最大760 mg)叶酸方案治疗的骨肉瘤患者没有显示化疗效果降低和神经毒性发生的情况[19]。
本案例患者在MTX使用前预防性给予50 mg亚叶酸钙,发生延迟代謝后,给予每6 h 1次亚叶酸钙50 mg,同时进行水化、利尿治疗,密切监测体液及电解质状态,于第10天时MTX浓度达到0.12 mmol/L,停止给药。患者所使用的亚叶酸钙剂量在说明书推荐范围之内,10 d内累积剂量为2 000 mg,未发生神经毒性,出院时状态良好,建议下次化疗前可延长亚叶酸钙预防性给药时间。
在MTX的使用时要密切监测其血药浓度、电解质水平、尿排出量和尿pH,可应用亚叶酸钙、补液和碱化尿液等方式预防MTX的毒性作用。如发生肾损伤,不能仅遵循指南和说明书进行亚叶酸钙的解救治疗,要根据患者的实际MTX使用剂量、实验室检查及亚叶酸钙疗效进行调整剂量,最终达到解救的目的。对于发生MTX肾损伤治疗成功的患者下次是否再次使用MTX进行治疗,要根据患者实际耐受情况进行及时调整。
参考文献
[1] 中国临床肿瘤学会.大剂量甲氨蝶呤亚叶酸钙解救疗法治疗恶性肿瘤专家共识[J]. 中国肿瘤临床, 2019, 46(15): 761-767.
[2] Ahmad S, Shen FH, Bleyer WA. Methotrexate-induced renal failure and ineffectiveness of peritoneal dialysis[J]. Arch Intern Med, 1978, 138(7): 1146-1147.
[3] Ghannoum M, Bouchard J, Nolin TD, et al. Hemoperfusion for the treatment of poisoning: technology, determinants of poison clearance, and application in clinical practice[J]. Semin Dial, 2014, 27(4): 350-361.
[4] Gil HW, Kim SJ, Yang JO, et al. Clinical outcome of hemoperfusion in poisoned patients[J]. Blood Purif, 2010, 30(2): 84-88.
[5] Sauer IM, Goetz M, Steffen I, et al. In vitro comparison of the molecular adsorbent recirculation system (MARS) and single‐ pass albumin dialysis (SPAD)[J]. Hepatology, 2004, 39(5): 1408-1414.
[6] Chan WK, Hui WF. Sequential use of hemoperfusion and single-pass albumin dialysis can safely reverse methotrexate nephrotoxicity[J]. Pediatr Nephrol, 2016, 31(10): 1699-1703.
[7] Nemoto T, Imai C, Kaneko U, et al. Effect of charcoal hemoperfusion for removal of plasma methotrexate in a patient with acute renal failure[J]. Pediatr Hematol Oncol, 2009, 26(7): 520-525.
[8] Boelens AD, Math?t RAA, Vlaar APJ, et al. Glucarpidase treatment for methotrexate intoxication: a case report and review of the literature[J]. Neth J Med, 2018, 76(1): 36-39.
[9] Schwartz S, Borner K, Müller K. Glucarpidase(carboxypeptidase g2) intervention in adult and elderly cancer patients with renal dysfunction and delayed methotrexate elimination after high-dose methotrexate therapy[J]. Oncologist, 2007, 12(11): 1299-1308.
[10] Widemann BC, Schwartz S, Jayaprakash N, et al. Efficacy of glucarpidase (carboxypeptidase g2) in patients with acute kidney injury after high-dosemethotrexate therapy[J]. Pharmacotherapy, 2014, 34(5): 427-439.
[11] Christensen AM, Pauley JL, Molinelli AR. Resumption of high-dose methotrexate after acute kidney injury and glucarpidase use in pediatric oncology patients[J]. Cancer, 2012, 118(17): 4321-4330.
[12] New Drug Application (NDA): 008107[EB/OL]. [2020-12-04]. https://www.accessdata.fda.gov/scripts/cder/daf/index. cfm?event=overview.process&ApplNo=008107.
[13] Straw JA, Szapary D, Wynn WT. Pharmacokinetics of the diastereoisomers of leucovorin after intravenous and oral administration to normal subjects[J]. Cancer Res, 1984, 44(7): 3114-3119.
[14] Abbreviated New Drug Application (ANDA): 203563[EB/OL]. [2020-12-04]. https://www.accessdata. fda.gov/scripts/cder/daf/index.cfm?event=overview. process&ApplNo=203563.
[15] Browman GP, Goodyear MDE, Levine MN, et al. Modulation of the antitumor effect of methotrexate by low dose leucovorin in squamous cell head and neck cancer: a randomized placebo-controlled clinical trial[J]. J Clin Oncol, 1990, 8(2): 203-208.
[16] Diddens H, Teufel T, Niethammer D. High dose methotrexate with leucovorin rescue: in vitro investigations on human osteosarcoma cell lines[J]. Cancer Chemother Pharmacol, 1987, 20(2): 128-132.
[17] Sirotnak FM, Donsbach RC, Moccio DM, et al. Biochemical and pharmacokinetic effects of leucovorin after high dose methotrexate in a murine leukemia model[J]. Cancer Res, 1976, 36(12): 4679-4686.
[18] Cohen IJ. Progression of osteosarcoma after high dose methotrexate: over rescue by folinic acid[J]. Pediatr Hematol Oncol, 2003, 20(8): 579-581.
[19] Shkalim-Zemer V, Ash S, Toledano H, et al. Highly effective reduced toxicity dose-intensive pilot protocol for nonmetastatic limb osteogenic sarcoma (SCOS 89) [J]. Cancer Chemother Pharmacol, 2015, 76(5): 909-916.
