甲酸诱导细胞凋亡与自噬的实验研究
2021-01-13郝乐乐李亚妮刘贺荣
陈 楠, 郝乐乐, 严 姣, 李亚妮, 刘贺荣
(宁夏医科大学公共卫生与管理学院,银川 750004)
甲醇(CH3OH)可经呼吸道、消化道、皮肤接触进入机体,甲醇主要在肝中代谢,在体内醇脱氢酶催化作用下代谢成甲醛,然后通过醛脱氢酶被迅速氧化代谢为甲酸[1]。其中甲酸被认为是甲醇毒性作用中的关键成分[2]。甲醇中毒后主要表现为中枢神经系统损伤、眼部损伤和代谢性酸中毒。有研究表明[3],甲醇中毒大鼠脑中可检测到甲酸,说明其可通过血脑屏障进入大脑发挥毒作用。因此推测代谢产物甲酸可能在甲醇神经毒性中发挥着重要的作用。细胞凋亡(apoptosis)又被称为Ⅰ型细胞程序性死亡,是一种基于遗传机制的细胞死亡模式,其诱导了一系列细胞形态学改变,如细胞皱缩、染色质凝聚、分裂凋亡小体等[4],有报道表明[5],各种有害因素引起的中枢神经系统的损伤都与细胞的线粒体凋亡密切相关。自噬是Ⅱ型细胞程序性死亡方式,自噬在维持神经元和胶质细胞正常功能中起到重要作用,维持神经元和神经胶质活动需要大量的能量,而这些能量的需求在很大程度上是通过自噬来解决的[6-7]。越来越多的研究表明[8-9],细胞的最终命运是由自噬和凋亡的交叉作用决定的。可能是自噬损伤可促进细胞凋亡,继而破坏自噬过程,最终导致细胞死亡[10]。因此,本文通过不同浓度甲醇代谢物——甲酸处理PC12 细胞,探讨甲酸对PC12 细胞凋亡及自噬的影响,为进一步阐明甲醇神经毒性奠定基础。
1 材料与方法
1.1 主要试剂与仪器
甲酸(天津大茂生物公司/中国);胎牛血清(Biological Industries/以色列);MEM 培养基(上海中桥新舟/中国);CCK-8 细胞增殖与毒性检测试剂盒(贝博公司/中国);凋亡试剂盒(贝博公司/中国);AO/EB(贝博公司/中国);荧光显微镜(Olympus/日本);流式细胞仪(Sysmex/日本),电泳仪(Tanon/中国)。
1.2 细胞培养与染毒
肾上腺嗜铬细胞瘤高分化细胞株(PC12 细胞,购自中国上海科学院细胞库)用1640 完全培养液轻柔吹匀制备为细胞悬液,加入适量的细胞悬液于细胞培养瓶中,置于细胞培养箱培养。取对数生长期且细胞状态良好的PC12 细胞,弃旧培养液,经过洗涤、消化后制备成细胞悬液,计数并用1640 完全培养液稀释细胞密度最终为6×103个/mL。分别接种于0、8.32、10.40、12.48、14.56、16.64、18.72 mmol·L-1甲酸的96 孔板中,每组5个复孔,每孔100 μL 染毒24 h。
1.3 CCK-8 法检测PC12 细胞活力
待加药24 h 后,弃掉含甲酸培养液,每孔加入含10% CCK-8 液的培养液100 μL,置于培养箱中孵育1~2 h 后,酶标仪波长450 nm 处检测各孔光密度(OD)值,由此确定染毒细胞的甲酸浓度为0、8.32、12.48、16.64 mmol·L-1;根据确定的甲酸染毒浓度,染毒PC12 细胞6、12、24、48 h。实验重复3 次。计算细胞活力,采用以下公式计算:细胞活力(细胞存活率)=(实验组OD 值-空白组OD 值)÷(对照组OD 值-空白组OD 值)×100%。
1.4 AO/EB 染色荧光显微镜观察各剂量组细胞的凋亡情况
收集上清液于15 mL 离心管中,用1 mLPBS洗涤细胞2 次后,收集旧培养液及用不含EDTA 胰酶消化30 s 的细胞于5 mL 的离心管中,置于转速为1000 r·min-1的离心机中离心,用预冷的PBS 洗涤2 次,500 μL 染色液重悬细胞,加入A 染液及B染液各5 μL,轻轻混匀,4 ℃避光孵育20 min 后,弃去染液,用PBS 洗涤,用PBS 制备成细胞悬液,滴至载玻片上,加盖玻片。以波长488 nm 的紫外光激发,荧光显微镜下观察各剂量组细胞的凋亡情况。
1.5 Annexin V-FITC 双染法检测PC12 细胞凋亡
细胞以3×105个/孔的密度接种于6 孔板内,每组3 个复孔,培养12 h 后弃去培养液,加入浓度为0、8.32、12.48、16.64 mmol·L-1的甲酸染毒,染毒24 h 后,收集旧培养液及用不含EDTA 胰酶消化30 s 的细胞于5 mL 的离心管中,置于转速为1000 r·min-1的离心机中离心,然后弃去上清液,加入1 mL 的PBS 洗涤2 次,冰上加入400 μL 异硫氰酸荧光素(FITC)结合缓冲液重悬细胞并加入5 μL Annexin V-FITC,4 ℃避光孵育15 min,再向细胞混悬液中加入10 μL 碘化丙啶(PI),4 ℃避光孵育5 min,流式细胞仪检测,其结果采用FSC Express 软件分析。
1.6 MDC 染色观察细胞自噬的情况
染毒24 h 后,用不含EDTA 的胰酶消化30 s,制备成细胞悬液,并移入1.5 mL 的EP 管中,置于转速为800×g的离心机中离心5min,将上清液弃去,用稀释的1×Wash Beffer 重悬细胞,使其细胞密度达到106个/mL。吸取90 μL 细胞悬液和10 μL MDC 染液于1.5 mL 的EP 管中,轻吹打将其混匀,室温避光30 min 后,将EP 管置于转速为800×g的离心机中离心5 min,弃去染液,用稀释的1×Wash Beffer 300 μL 洗涤细胞3 次。100 μL 的collection buffer 重悬细胞,并将100 μL 的细胞悬液滴于载玻片上,加盖玻片,用荧光显微镜紫外激发光355 nm,阻断滤光片512 nm 下观察细胞自噬的情况。
1.7 Western blot 检测PC12 细胞内自噬相关蛋白
染毒24 h 后,PBS 洗涤细胞2 次,每孔加入裂解液,用刮刀将细胞刮下,收集到EP 管中冰上裂解30 min。4 ℃,12000×g离心5 min。取上清液按照BCA 试剂盒说明书进行蛋白浓度测定。经SDS-PAGE 电泳后转移至PVDF 膜上,用5%脱脂奶粉TBST 溶液室温下封闭,再将PVDF 孵育上相应的一抗,4 ℃过夜,TBST 清洗3 次,二抗封闭,室温孵育1 h,TBST 清洗3 次,膜蛋白表面上均匀涂抹显影液,避光孵育5 min 后用Bio-rad 凝胶成像系统曝光显影。应用Image J 软件分析灰度值(目的蛋白相对表达量=目的蛋白的灰度值/内参的灰度值)。
1.8 统计学方法
采用SPSS 22.0 统计软件对数据进行分析,计量资料符合正态分布,以均数±标准差(x±s)表示。组间比较采用单因素的方差分析,两两比较采用LSD-t检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 甲酸对PC12 细胞活力的影响
不同浓度甲酸(0、8.32、10.40、12.48、14.56、16.64、18.72 mmol·L-1)对PC12 细胞干预24 h,各甲酸浓度组细胞活力差异具有统计学意义(P<0.01)。且各甲酸浓度组与细胞活力呈负相关,随着甲酸浓度增加细胞活力逐渐减小(r=-0.981,P<0.01)。根据回归方程y=-0.0269x+0.9976 计算出半数抑制浓度IC50为18.27 mmol·L-1,确定0、8.32、12.48、16.64 mmol·L-1为后续实验浓度。根据确定的甲酸染毒浓度分别染毒PC12 细胞6、12、24、36、48 h 后,观察细胞活力的改变,由图2 可知,细胞活力随着染毒时间的增加逐渐降低,有明显的时间依赖关系。经查阅文献及观察细胞生长状态最终选取24 h 为后续实验的染毒时间。见图1、图2。
2.2 AO/EB 染色观察PC12 凋亡形态学的改变
甲酸浓度为0、8.32、12.48、16.64 mmol·L-1染毒PC12 细胞24 h 后,细胞经AO/EB 双染,AO能透过正常细胞完整的细胞膜,使细胞着绿色荧光,而EB 仅能通过细胞膜受损的细胞,嵌入DNA使之发出橙红色荧光。混合使用两种染料时,正常活细胞的核染色质着绿色,形态结构正常;早期凋亡细胞的膜结构完整,细胞呈黄绿色;晚期凋亡细胞,核染色质发桔红色荧光。0 mmol·L-1组无明显的凋亡细胞,细胞染色为绿色;低浓度组可见少量早期凋亡细胞,细胞染色为呈黄绿色荧光;随着甲酸浓度的增加,晚期凋亡细胞均增多,细胞染色呈桔红色。见图3。
2.3 流式细胞仪检测细胞凋亡率
Annexin V-FITC/PI 双染检测PC12 细胞凋亡情况,不同类型凋亡率(早期、晚期、总凋亡率)差异有统计学意义(P<0.01),均随浓度的增加而增加,且8.32、12.48 和16.64 mmol·L-1浓度组与0 mmol·L-1浓度组比较三种类型凋亡率均升高(P均<0.05);12.48、16.64 mmol·L-1浓度组三种类型凋亡率均高于8.32 mmol·L-1组(P均<0.05);16.64 mmol·L-1组三种类型凋亡率高于12.48 mmol·L-1组(P<0.05)。见图4、表1。
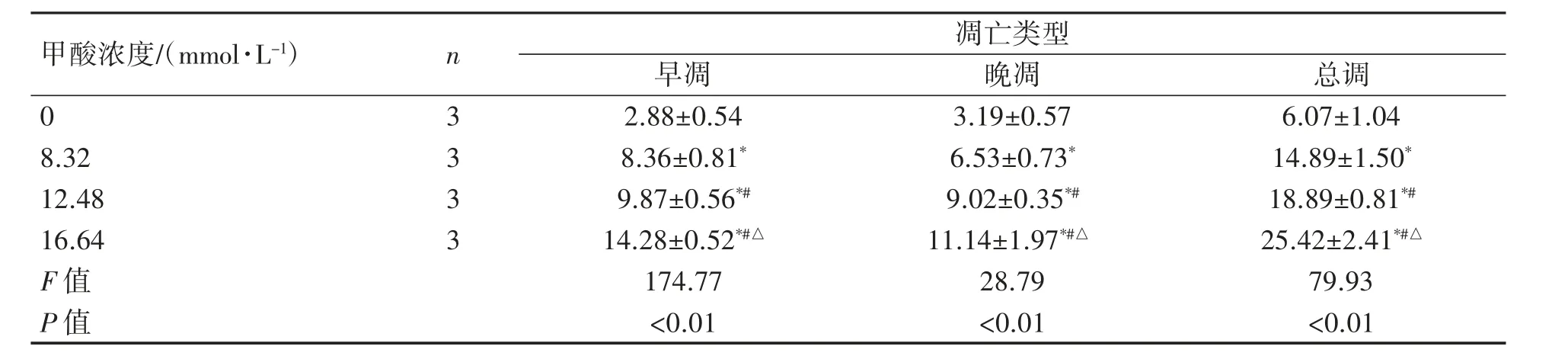
表1 不同浓度甲酸干预PC12 细胞24 h 后细胞凋亡比较
2.4 MDC 染色观察荧光强度
在荧光显微镜下观察发现:对照组可见极少量的蓝色荧光,随着甲酸浓度的增高,蓝色荧光增多,差异有统计学意义(P<0.05)。8.32 mmol·L-1组与0 mmol·L-1组相比,荧光强度差异无统计学 意义(P >0.05);12.48、16.64 mmol·L-1组与0 mmol·L-1组相比,荧光强度均增高(P均<0.05)。见图5、表2。

表2 MDC 染色甲酸染毒PC12 细胞后荧光强度变化
2.5 甲酸致PC12 细胞自噬相关蛋白LC3、Beclin1、P62 表达情况的变化
结果表明,自噬相关蛋白LC3Ⅱ/LC3Ⅰ、Beclin-1 相对表达量随着浓度的增加而增高,而P62 蛋白相对表达量逐渐降低(P均<0.01)。8.32 mmol·L-1组与0 mmol·L-1组相比,LC3Ⅱ/LC3Ⅰ表达量差异无统计学意义(P>0.05),12.48、16.64 mmol·L-1组与0 mmol·L-1组相比,LC3Ⅱ/LC3Ⅰ表达量增高(P均<0.01);与0 mmol·L-1组相比,8.32、12.48、16.64 mmol·L-1组Beclin-1蛋白表达量均增高(P均<0.01);12.48、16.64 mmol·L-1组与0 mmol·L-1组相比,P62 蛋白表达量均降低(P均<0.05)。见图6、表3。
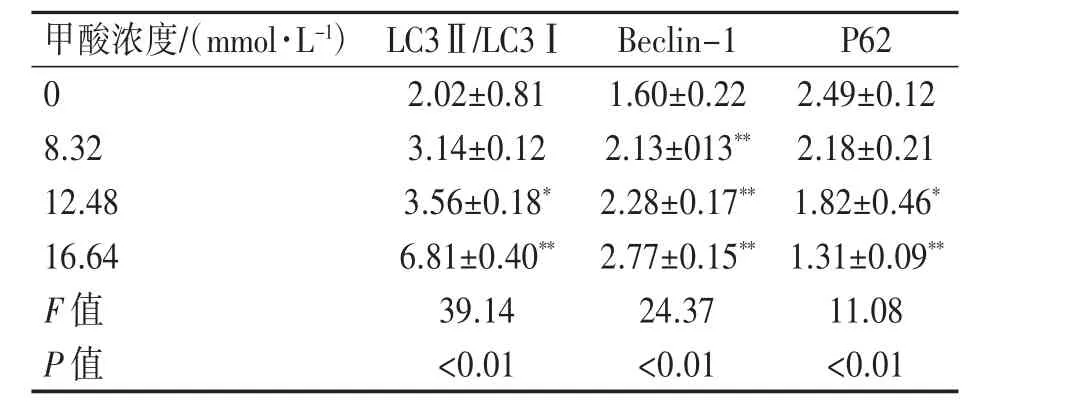
表3 甲酸染毒PC12 细胞后自噬相关蛋白灰度分析情况
3 讨论
有报道表明[11-12],各种有害因素引起的中枢神经系统损伤与细胞凋亡相关。本实验首先对甲酸是否能够诱导PC12 细胞凋亡展开研究。采用CCK-8 方法检测不同浓度甲酸干预不同时间PC12 细胞后其细胞活力改变,结果表明随着甲酸浓度和时间增加,PC12 细胞的活力逐渐降低,有明显的浓度和时间依赖性,说明甲酸具有细胞毒性作用,对PC12 细胞的活力有抑制作用。细胞凋亡是一种常见的细胞死亡方式,许多不同的神经病理状态都与细胞凋亡有关[13-14]。本研究采用AO/EB 染色可见,不同浓度甲酸染毒引起PC12 细胞呈凋亡特征性形态,进一步利用Annexin VFITC/PI 双染来定量检测甲酸暴露细胞的凋亡率,发现早期、晚期、总凋亡率均随甲酸浓度的增加而升高,与孙凌聪等[15]研究结果一致,说明甲酸暴露能引起PC12 细胞损伤,且这种损伤作用可能与其诱发的细胞凋亡有关。
自噬是负责清除蛋白质和细胞器的细胞途径,因此一定程度的自噬对于维持正常的细胞稳态是必要的[16]。很多外源性化合物能够诱导细胞自噬[17-18]。自噬是否参与甲酸致神经细胞毒性需要通过实验进一步对细胞自噬情况进行检测。MDC 阳性囊泡积累对自噬诱导做出反应[19-20],本研究通过荧光显微镜对PC12 细胞自噬进行形态学分析发现,对照组可见极少量的蓝色荧光,随着甲酸浓度的增高,蓝色荧光增多,提示甲酸干预的PC12 细胞自噬囊泡形成逐渐增加,自噬水平有明显的浓度依赖性。因此我们进一步用Western blot 检测自噬标志蛋白表达情况,结果发现:不同浓度甲酸染毒PC12 细胞24 h 后,自噬相关蛋白LC3Ⅱ/LC3Ⅰ、Beclin-1 相对表达量逐渐增高,而P62 蛋白相对表达量逐渐降低,自噬水平随之升高,结果与铅中毒[21]引起自噬相关蛋白的结果一致,分析原因可能为当自噬发生时,胞浆型LC3Ⅰ转变为膜型LC3Ⅱ,所以,LC3Ⅱ/LC3Ⅰ与自噬体数量成正相关[22]。Beclin-1 是Ⅲ型磷脂酰肌醇3-激酶(PtdIns3K)复合物的关键成分[23],也是自噬体形成的必须蛋白,Beclin1表达上升则提示发生自噬[24]。P62 蛋白与神经递质性疾病相关,P62 蛋白能够把目标蛋白运送到自噬体内使其发生自噬性降解,P62 蛋白的表达量与自噬流强弱成负相关[25]。
综上,甲酸可通过引起细胞凋亡产生神经损伤,也可引起神经细胞自噬发生,但其中自噬与凋亡是否有关联,以及具体的关系尚不明确,后续实验可加入相应的抑制剂来进一步深入探讨。
