慢性阻塞性肺疾病急性加重期患者PA、Hcy和hs-CRP水平与病情预后的相关性研究*
2021-01-13陶黎岚张梦兰
陈 尧,陶黎岚,张梦兰
安徽省蚌埠市第一人民医院检验科,安徽蚌埠 233000
慢性阻塞性肺疾病急性加重期(AECOPD)的发病率逐年上升,在AECOPD患者病情不断恶化的过程中,其发生肺源性心脏病或多器官功能衰竭的风险较高[1-2]。血清中相关生物学标志物,能够在呼吸系统疾病的病情评估中发挥重要作用。前清蛋白(PA)通过影响机体的清蛋白储备,加剧机体营养状态的恶化,并通过影响炎性反应的激活,促进肺部病变的进展[3];半胱氨酸(Hcy)是胱氨酸代谢相关因子,其通过释放游离自由基,促进小气道的狭窄和平滑肌细胞的重塑[4];超敏C-反应蛋白(hs-CRP)是炎症相关因子,作为超敏炎症因子家族成员,上调炎症通路相关信号分子,加剧慢性阻塞性肺疾病(COPD)患者支气管黏膜的损伤[5]。本研究选取2018年2月至2019年9月在本院接受治疗的AECOPD患者为研究对象,探讨PA、Hcy和hs-CRP的表达情况,从而为AECOPD患者的预后评估提供参考。
1 资料与方法
1.1一般资料 选取2018年2月至2019年9月在本院接受治疗的AECOPD患者为研究对象。纳入标准:(1)年龄50~80岁;(2)符合中华医学会制订的AECOPD的诊断标准[6];(3)无其他系统严重疾病。排除标准:(1)临床资料不全;(2)合并上消化道感染等其他呼吸系统疾病;(3)不愿参与本研究。本研究共纳入AECOPD患者120例作为观察组,其中男65例,女55例;年龄52~78岁,平均(68.35±4.78)岁。选取同期本院体检健康者120例作为对照组,其中男60例,女60例;年龄54~80岁,平均(68.33±5.12)岁。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经本院伦理委员会评审通过,患者均知情同意并签署知情同意书。
1.2方法 采集两组研究对象外周静脉血3~5 mL,室温下放置30 min,3 000 r/min离心5 min,取上清液待测。采用BS-600全自动生化检测仪器(购自深圳迈瑞医疗公司)进行PA、hs-CRP水平检测,全自动生化检测试剂盒Biotic购自武汉华美生物公司;采用荧光偏振免疫技术进行Hcy水平检测,Axsym仪器购自美国雅培公司。
1.3评价指标 观察两组研究对象PA、Hcy、hs-CRP水平和肺功能;观察组根据患者预后分为好转组95例和加重组25例,比较好转组和加重组患者PA、Hcy、hs-CRP水平和肺功能指标,并分析AECOPD患者的PA、Hcy和hs-CRP水平与肺功能指标的相关性。

2 结 果
2.1对照组和观察组PA、Hcy、hs-CRP水平比较 观察组PA、Hcy、hs-CRP水平高于对照组,差异均有统计学意义(P<0.05)。见表1。

表1 对照组和观察组PA、Hcy、hs-CRP水平比较
2.2对照组和观察组肺功能指标比较 观察组用力肺活量(FVC)、第1秒用力呼气容积(FEV1)、最大呼气中期流量(MMEF)和最大呼气流量(PEF)低于对照组,差异均有统计学意义(P<0.05)。见表2。

表2 对照组和观察组肺功能指标比较
2.3好转组和加重组PA、Hcy、hs-CRP水平比较 加重组PA、Hcy、hs-CRP水平高于好转组,差异均有统计学意义(P<0.05)。见表3。

表3 好转组和加重组PA、Hcy、hs-CRP水平比较
2.4好转组和加重组肺功能指标比较 加重组FVC、FEV1、MMEF和PEF低于好转组,差异均有统计学意义(P<0.05)。见表4。

表4 好转组和加重组肺功能指标比较
2.5AECOPD患者的PA、Hcy、hs-CRP水平与肺功能指标的相关性 AECOPD患者的PA、Hcy、hs-CRP水平与FVC、FEV1、MMEF、PEF均呈负相关(P<0.05)。见表5。
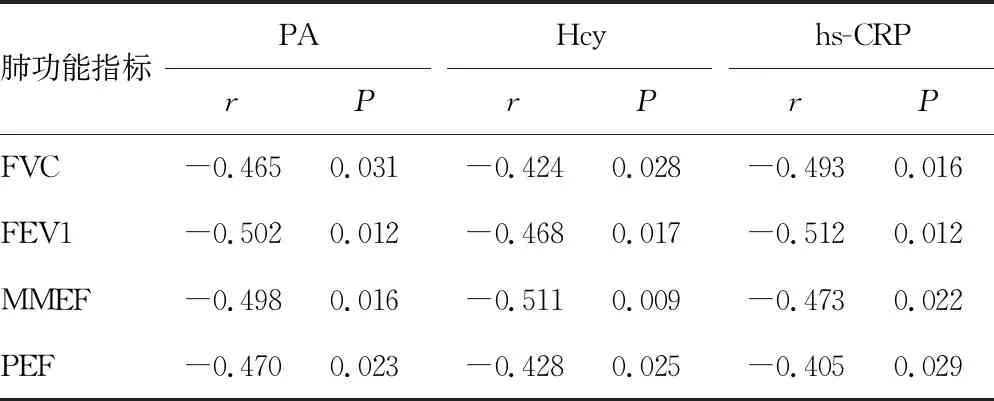
表5 AECOPD患者PA、Hcy、hs-CRP水平与肺功能指标的相关性
3 讨 论
感染、自身免疫功能的下降及重症基础性并发症,均能够促进AECOPD的发生。在合并有院内感染相关高危因素的群体中,AECOPD患者的病死率上升[7]。随着AECOPD患者病情进展,肺性脑病及肝、肾功能障碍的风险增加,导致远期致残率的上升[8-9]。临床上对于AECOPD病情预后的准确评估,能够为疾病的治疗、出院后的随访工作提供参考。虽然肺功能可以评估AECOPD患者的肺通气程度,但肺功能检查需要患者积极配合,对于高龄或自主状态较差的患者,肺功能检查的可靠性较低。生物学标志物具有检测便捷的特点,炎症因子及氧化应激因子,能够在呼吸系统疾病并发症的治疗中发挥一定的调控作用。本研究通过对AECOPD患者血清中PA、Hcy、hs-CRP水平的检测,为AECOPD患者临床转归的评估提供参考。
PA是清蛋白的前体物质,在炎性反应激活或免疫紊乱的病理进程中,PA水平可明显上升,最终通过诱导机体应激反应的发生,加剧炎症因子的释放,促进肺部病情的进展;Hcy对于胱氨酸等代谢的干预,能够释放游离的电荷自由基,加剧肺泡支气管黏膜氧化损伤的风险;hs-CRP能够直接参与支气管及小气道的炎症损伤过程,同时还能够诱导粒细胞的富集,加剧炎症细胞对于肺功能弥散的影响[10]。有研究探讨了PA、hs-CRP在COPD患者中的表达,发现PA、hs-CRP水平上升与COPD患者肺功能的恶化程度密切相关[11-12],但对于PA、Hcy、hs-CRP水平与COPD患者预后的关系研究较少。
本研究发现与对照组比较,观察组PA、Hcy、hs-CRP水平上升,差异有统计学意义(P<0.05),表明PA、Hcy、hs-CRP的水平能反映AECOPD患者的病情进展。原因在于AECOPD患者的体内可能存在较为明显的炎性反应的激活,而且炎性反应失代偿诱导的氧化应激系统的激活也较为显著,最终促进了Hcy、hs-CRP水平上升;而PA水平上升主要与清蛋白利用代谢紊乱导致前体物质的释放加速有关。阿选德[13]发现,在COPD患者中Hcy的水平可上升3~4倍,在合并有显著肺通气或者肺换气功能障碍的COPD患者中,Hcy的水平可随着患者肺功能的恶化而上升。FEV1、FEV1/FVC、MMEF及PEF是评估呼吸系统疾病患者肺功能的指标,本研究中AECOPD患者其FVC、FEV1、MMEF和PEF明显下降,肺功能障碍的表现较为明显。同时与好转组比较,加重组PA、Hcy、hs-CRP的水平上升,差异有统计学意义(P<0.05),表明PA、Hcy、hs-CRP的水平可能影响到AECOPD患者的治疗转归情况。这主要是由于治疗后好转的患者,其肺部局部支气管黏膜上皮细胞的病理应激程度较轻,炎性反应的激活程度较小,从而导致Hcy、hs-CRP的合成释放不足。同时PA、Hcy、hs-CRP水平的下降,能够降低游离自由基对于支气管黏膜上皮的损伤,促进黏膜上皮的损伤修复,从而改善患者临床结局。Pearson相关分析发现,PA、Hcy、hs-CRP水平与FVC、FEV1、MMEF和PEF均呈负相关,提示PA、Hcy、hs-CRP水平与AECOPD患者的肺功能密切相关,这主要是由于PA、Hcy、hs-CRP水平的改变,能够通过影响肺泡上皮细胞的弥散功能,加剧肺部血管内皮炎症损伤,最终影响到肺通气和肺换气过程[14-15]。
综上所述,AECOPD患者PA、Hcy和hs-CRP水平较高,且与患者肺功能指标呈负相关,可为患者的预后治疗提供参考。
