新生儿急性呼吸窘迫综合征的临床特征及预后相关性分析
2021-01-11刘慧程伟伍莉汪丽
刘 慧 程 伟 伍 莉 汪 丽
新生儿急性呼吸窘迫综合征(neonatal acute respiratory distress syndrome,ARDS)是临床常见的危重症之一,病死率高,严重影响患儿的生存质量。与原发性肺表面活性物质(pulmonary surfactant,PS)缺乏所致的新生儿呼吸窘迫综合征(neonatal respiratory distress syndrome,NRDS)不同,新生儿ARDS是由各种原因导致的继发性Ⅱ型肺泡上皮细胞受损、PS破坏/失活,主要发生于中晚期早产儿和(或)足月儿[1~3]。目前其具体的发病机制、临床特征及治疗策略仍处于探索阶段。本研究通过对63例胎龄32~42周的中晚期早产儿及足月儿ARDS临床特征及影响预后的相关因素进行分析总结,以便指导临床,降低ARDS患儿的病死率及改善预后。
对象与方法
1.研究对象:收集2018年1月~2019年3月在陆军军医大学大坪医院住院,胎龄32~42周的新生儿ARDS病例63例,其中男患儿34例,女患儿29例,胎龄36.24±3.19周,出生体重2780±774g。
2.诊断标准及排除标准:新生儿ARDS的诊断标准参照2017年蒙特勒诊断标准[4],按氧合指数(oxygenation index,OI)将ARDS分为轻度(OI为4.0~7.9)、中度 (OI为8.0~15.9) 及重度 (OI为16.0以上)。低白蛋白血症诊断标准[5]:胎龄<35周,白蛋白低于2.5g/dl,胎龄≥35周,白蛋白低于3.0g/dl。排除标准:①胎龄<32周及胎龄>42周;②暂时性呼吸增快、NRDS、先天性膈疝及肺泡毛细血管发育不良等先天性畸形引起的呼吸困难;③先天性心脏病、原发性肺动脉高压、遗传代谢性疾病。
3.研究方法:收集ARDS患儿的临床资料,包括:性别、胎龄、出生体重、生产方式、胎膜早破 (premature rupture of membranes,PROM)、绒毛膜羊膜炎 (chorioamnionitis,CA)、确诊时的血气分析、入院时血清白蛋白及球蛋白水平、吸入性肺炎 (胎粪、胆汁、奶、血性羊水)、机械通气时间/吸氧时间、呼吸机参数、PS使用次数、住院时间、并发症及结局。并对出院患儿进行专人随访。根据有无死亡及遗留神经系统后遗症,分为死亡/后遗症组及痊愈组。

结 果
1.影响ARDS预后的相关分析:63例患儿中住院期间死亡3例;14例放弃治疗,其中7例死亡;46例好转/治愈出院。对出院的53例患儿进行随访,其中3例患儿死亡,18例患儿存在语言、运动和(或)智力发育迟缓。病死率约20.6% (13/63), 存活患儿致残率为36.0% (18/50)。死亡/后遗症组31例,痊愈组32例。单因素分析发现死亡/后遗症组胎龄、低白蛋白血症、低球蛋白血症较痊愈组低 (P<0.05),详见表1。将单因素分析P<0.05的变量纳入Logistic回归模型,结果显示低白蛋白血症是影响ARDS预后的独立危险因素,详见表2。
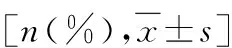
表1 死亡/后遗症组与痊愈组单因素分析
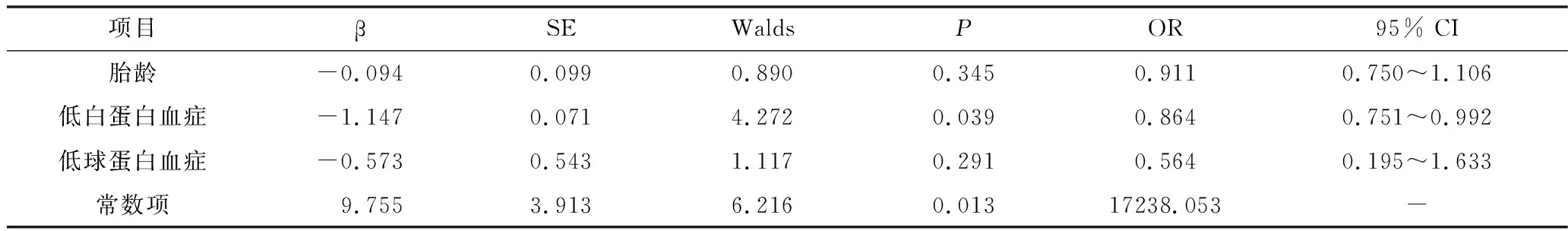
表2 影响ARDS预后的Logistic回归分析
2.临床特征:42例患儿接受了PS治疗,26例使用PS后病情有所好转(26/42, 61.9%)。死亡/后遗症组中,重度ARDS、PS使用≥3次的患儿占比显著高于痊愈组(P<0.05),而无创通气时间、单独吸氧时间及住院时间较痊愈组短(P<0.05)。两组有创通气率及有创通气时间比较,差异无统计学意义(P>0.05),详见表3。
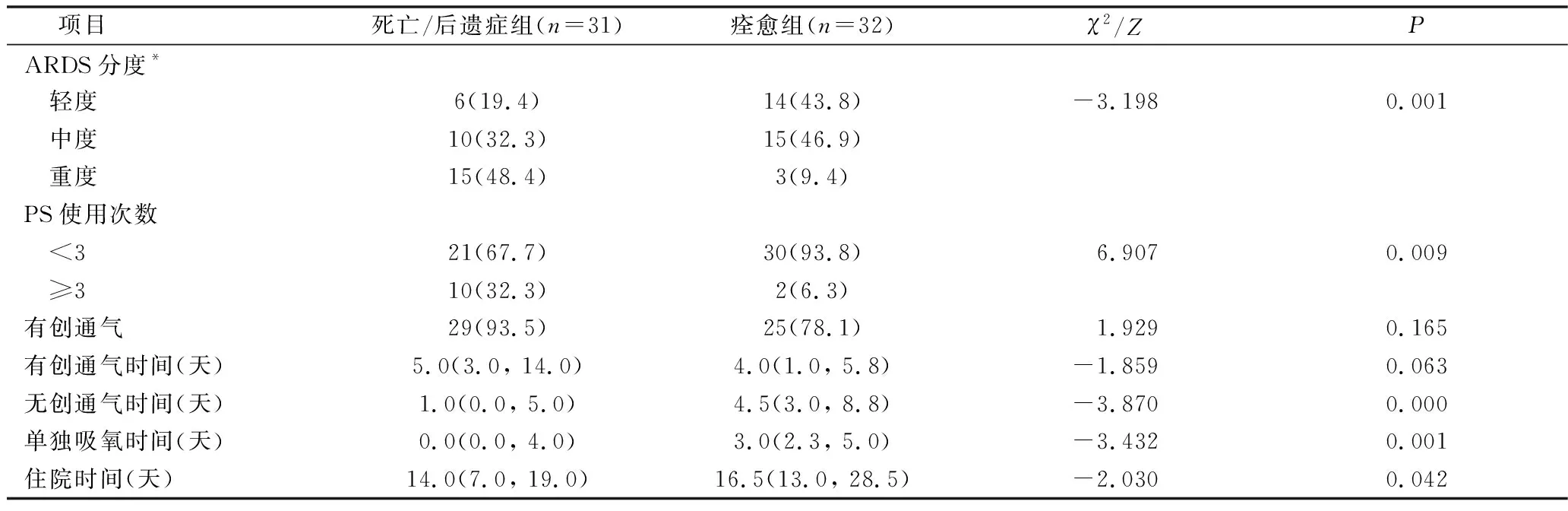
表3 死亡/后遗症组与痊愈组临床特征比较[n(%), M(Q1, Q3)]
3.与痊愈组比较,死亡/后遗症组二氧化碳分压(partial pressure of carbon dioxide,PCO2)、吸入氧浓度(fraction of inspired oxygen,FiO2)及呼吸机平均气道压(mean airway pressure,MAP)更高(P<0.05),而氧分压(partial pressure of oxygen,PO2)及碱剩余(base excess,BE)更低(P<0.05),详见表4。
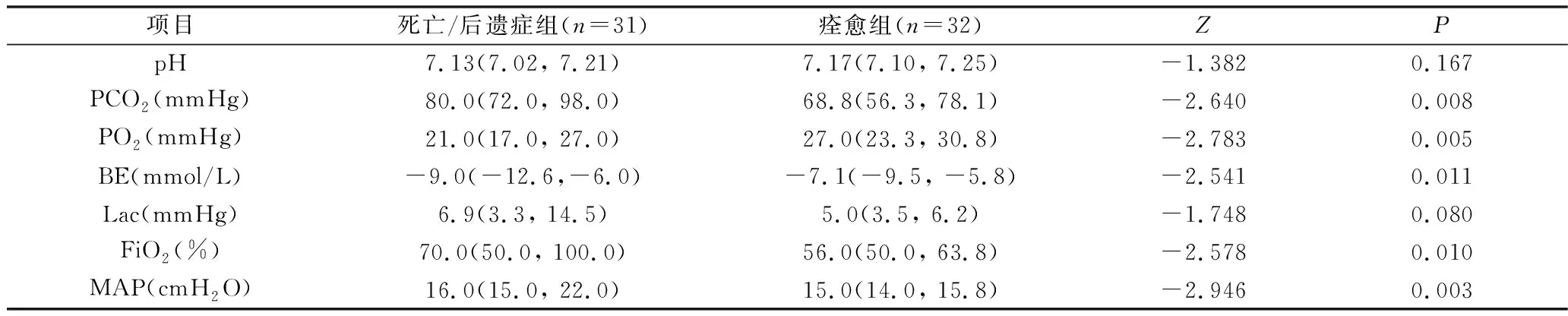
表4 死亡/后遗症组与痊愈组临床特征比较 [M(Q1, Q3)]
4.并发症:所有患儿均未并发早产儿视网膜病(retinopathy of prematurit, ROP)及坏死性小肠结肠炎(necrotizing enterocolitis,NEC), 两组各并发支气管肺发育不良 (bronchopulmonary dysplasia, BPD)1例。与痊愈组比较,死亡/后遗症组更易并发高血糖、持续肺动脉高压(persistent pulmonary hypertension,PPHN)、肺出血、心力衰竭、肾功能损害及颅内出血(P<0.05),详见表5。
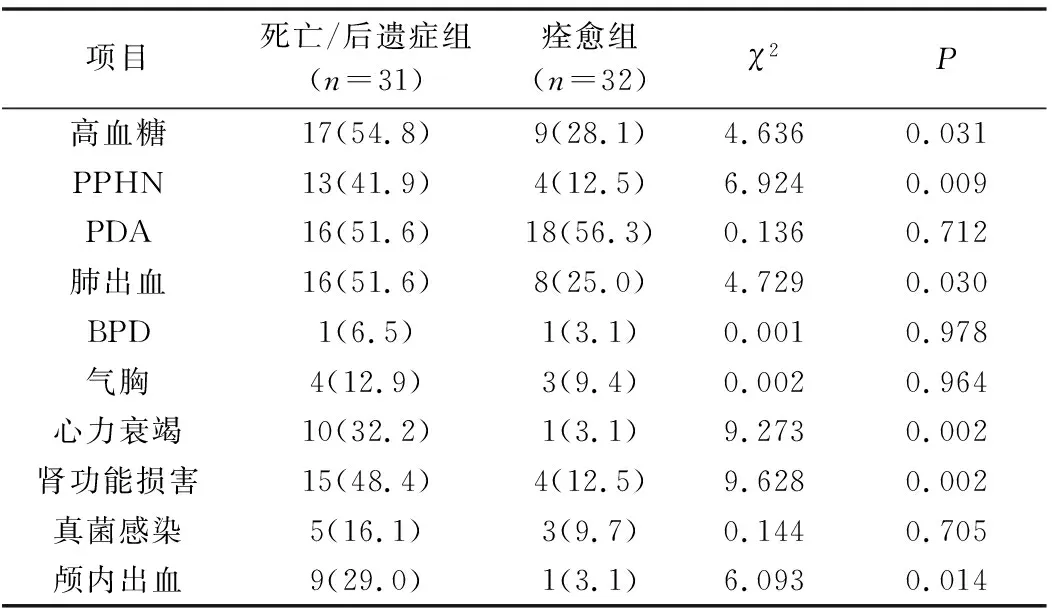
表5 死亡/后遗症组与痊愈组并发症比较[n(%) ]
讨 论
ARDS是由各种原因导致的肺部急性炎性反应,以肺泡毛细血管内皮细胞损伤、肺泡毛细血管通透性增加及渗出性肺水肿形成为主要病理改变,以严重低氧血症、呼吸窘迫、肺顺应性降低为主要临床特征。新生儿ARDS是常见的临床危重症,是导致新生儿致死、致残的主要原因之一。本研究发现,新生儿ARDS的病死率为20.6%, 致残率为36.0%,该结果与国际新生儿ARDS多中心研究中期报告[6]及唐烁等[2]的研究结果一致。Aman等[7]研究发现,白蛋白水平对判断肺毛细血管通透性及ARDS有较高的敏感度和阴性预测值,对ARDS有附加诊断价值,血清蛋白水平的下降与急性肺损伤/ARDS的严重程度呈正相关。本研究Logistic回归分析显示低白蛋白血症是影响ARDS预后的独立危险因素,预示血清白蛋白水平对预测ARDS预后具有重要意义。大量临床研究表明,白蛋白是影响预后的一个重要指标,血清白蛋白越低,提示预后越差[5,8,9]。白蛋白具有许多重要的生理功能,包括维持胶体渗透压、蛋白质结合和转运、改变血管通透性等。新生儿白蛋白合成能力有限,炎性介质又可直接抑制负责白蛋白合成的基因转录,在病情危重情况下,毛细血管通透性增高导致白蛋白外漏,这些病理生理过程都可导致新生儿低白蛋白血症[8]。由此认为,本研究中ARDS患儿血清低白蛋白水平可能与肺泡毛细血管通透性增高和肺泡间隙蛋白质渗漏增加有关。
PS不仅能减少新生儿ARDS的机械通气时间及用氧时间,还能延缓病情进展[3]。本研究66.7%的ARDS患儿接受了PS治疗,绝大多数使用PS后病情有所好转,证实了PS在治疗新生儿ARDS有一定的临床疗效。一项关于PS治疗儿童ARDS的临床研究也表明,使用PS后患儿的PO2、PO2/FiO2、OI及pH得到明显改善 (P<0.05)[10]。尽管如此,对于一些病情危重的患儿,若原发病得不到控制,补充的外源性PS可能被不断消耗,需要多次补充PS。本研究死亡/后遗症组中,重度ARDS及使用PS≥3次的患儿占比明显高于痊愈组(P<0.05),表明ARDS程度越重或需多次补充外源性PS的ARDS患儿结局较差。而痊愈组无创通气时间、单独吸氧时间及住院时间较死亡/后遗症组长,两组间有创通气率及有创通气时间比较,差异无统计学意义,这可能与死亡/后遗症组中部分患儿因病情危重、在机械通气下死亡或放弃治疗有关。
血气分析是评估血液中气体分压和酸碱含量的常用诊断工具,在临床中应用非常广泛,尤其是对病情的评估相当重要。ARDS患儿由于肺部病变重,肺通气不足,肺顺应性差,气道阻力大,常导致CO2潴留、OI高。本研究发现,死亡/后遗症组所需的FiO2及呼吸机MAP较痊愈组更高(P<0.05),而血气分析中PO2和BE更低、PCO2更高(P<0.05),表明呼吸窘迫及低氧血症越严重的患儿所需的呼吸机参数越高。
新生儿ARDS作为最严重的新生儿肺部疾病之一,严重的低氧血症及呼吸窘迫可导致全身血流动力学发生改变而导致组织缺血缺氧,造成多脏器损伤,出现一系列并发症[11, 12]。本研究也发现死亡/后遗症组中的患儿更易并发PPHN、肺出血、心力衰竭、肾功能损害及颅内出血。此外,机体在窒息、感染或严重疾病的情况下易并发高血糖,而严重高血糖又会影响患儿的预后,两者互为因果[13]。Wintergerst等[13]研究报道,血糖水平与病死率呈正相关,血糖>110mg/dl、>150mg/dl及>200mg/dl病死率分别为5.7%、7.4%及9.9%,而血糖<110mg/dl的病死率仅为1.5%,与本研究中死亡/后遗症组患儿更易并发高血糖的结论一致。与NRDS不同的是,本研究63例ARDS患儿中仅2例并发BPD,无病例并发ROP及NEC。Luo等[1]研究报道49例新生儿ARDS患儿中仅4例并发BPD,无病例并发ROP及NEC,而胎龄<32周的NRDS患儿BPD、ROP及NEC的发生率分别为34.0%、30.2%及1.9%[14]。这可能与ARDS常见于中晚期早产儿和(或)足月儿,对缺氧、氧中毒、呼吸机损伤等的耐受性较极早及早期早产儿强有关,今后仍需开展大样本量、多中心临床试验予以验证。
综上所述,新生儿ARDS的致死、致残率高。在诊疗过程中需警惕低白蛋白血症的发生,严密监测血气分析,及时调整呼吸机参数,纠正低氧血症,维持血糖稳定,减少并发症的发生,以降低新生儿ARDS的病死率及改善预后。
