短期胰岛素泵强化治疗对初诊2型糖尿病患者血清IL-22水平的影响
2021-01-11彭湾湾薛君力曾姣娥
彭湾湾 钟 雯 薛君力 曾姣娥
2型糖尿病(type 2 diabetes mellitus,T2DM)发生的中心环节为胰岛素抵抗与胰岛β细胞分泌受损。胰岛素泵是胰岛素强化降糖治疗的一种重要方法,能有效调节初诊T2DM患者的糖脂代谢,缓解氧化应激反应,减轻胰岛素抵抗,改善胰岛β细胞功能[1,2]。研究发现,白介素-22(interleukin-22,IL-22)可保护胰岛β细胞免受炎症和葡萄糖诱导的毒性不良反应影响,甚至可逆转高血糖对胰岛细胞的损害作用[3]。IL-22的低表达被认为是T2DM发生的危险因素[4]。目前关于初诊T2DM患者血清IL-22水平与胰岛β细胞功能的关系及胰岛素泵治疗对血清IL-22的影响尚未见报道,IL-22在T2DM发生过程中扮演的角色仍未揭开神秘面纱。因此,本研究选择初诊T2DM患者为研究对象,观察短期胰岛素泵强化治疗前后血清IL-22水平变化,并探讨胰岛素泵强化治疗对其影响,旨在为T2DM及其并发症的早期诊治提供帮助。
对象与方法
1.研究对象:选择2018年5月~2019年5月荆州市中心医院内分泌科住院收治的80例初诊T2DM患者,其中男性48例,女性32例。对照组为笔者医院健康管理中心同期健康体检者80例,其中男性44例,女性36例。T2DM诊断符合中国T2DM防治指南(2017年版)诊断标准[5];年龄30~60岁;未服用口服降糖药、降脂药,且未接受任何胰岛素治疗。排除标准:1型糖尿病、特殊类型糖尿病;胰岛素自身抗体阳性;合并糖尿病急性及慢性并发症;严重的全身系统性疾病、恶性肿瘤;冠心病、高血压病史;肝功能不全、肾功能不全、慢性炎性疾病、血液系统疾病;妊娠期、哺乳期。所有研究对象均签署知情同意书。
2.研究方法:(1)采集两组研究对象的年龄、身高、体重,计算体重指数(body mass index,BMI)=体重(kg)/[身高(m)]2。(2)空腹8~12h,次日清晨空腹抽取肘静脉血,一部分血直接送检测空腹血糖(fasting blood glucose,FBG)、糖化血红蛋白(glycated hemoglobin,HbA1c)、空腹C肽(fasting C-peptide,FCP)、空腹胰岛素(fasting insulin,FINS),一部分血放入常规试管1500r/min离心3min后取血清2ml,置于-80℃冰箱保存待查IL-22,采用葡萄糖氧化酶法检测FBG,采用放射免疫分析法检测FCP、FINS,采用高效液相色谱法检测HbA1c,采用双抗体夹心酶联免疫吸附法检测IL-22[科鹿(武汉)生物科技有限公司产品],严格按照试剂盒说明书进行操作。(3)稳态模型评估法计算胰岛β细胞功能指数(homa islet beta cell function index,HOMA-β)与胰岛素抵抗指数(homa insulin resistance index,HOMA-IR),HOMA-β=20×FINS/(FBG-3.5),HOMA-IR=FBG×FINS/22.5。(4)T2DM组患者给予胰岛素泵持续皮下输注胰岛素(门冬胰岛素,商品名:诺和锐,丹麦诺和诺德制药有限公司,规格:300IU/支)治疗,起始总量按0.5IU/(kg·d)计算,50%作为基础量输注,余50%分配于3餐前大剂量泵入。(5)每天采用博士医生血糖仪监测指尖血糖,根据血糖监测值(3餐前、3餐后2h、睡前、凌晨3点)调整胰岛素泵剂量,直至血糖达标(FBG<6.1mmol/L,餐后2h血糖<8.0mmol/L),达标后维持治疗14天,停胰岛素泵1天,次日清晨空腹复测FBG、FCP、IL-22。(6)研究期间不加用口服降糖药、调脂药等。

结 果
1.一般资料的比较:对照组和T2DM组患者的性别、年龄、BMI比较,差异无统计学意义(P>0.05)。入院时,T2DM组患者FBG、HbA1c、HOMA-IR显著高于对照组,FCP、FINS、HOMA-β显著低于对照组,差异有统计学意义(P<0.05),详见表1。

表1 两组一般临床资料比较
2.血清IL-22水平的比较:T2DM组患者治疗前IL-22水平为127.56±74.63pg/ml,显著低于对照组353.98±93.94pg/ml,差异有统计学意义(t=-17.239,P<0.05),接受胰岛素泵强化降糖治疗14天后,IL-22水平升高至171.97±92.68pg/ml,较治疗前显著上升(t=-9.816,P<0.05),但仍显著低于对照组(t=-12.042,P<0.05)。
3.Pearson相关性分析:对照组中,IL-22与FBG呈负相关(r=-0.703,P<0.05),与FINS、FCP呈正相关(r=0.761,P<0.05;r=0.946,P<0.05),而与HbA1c无明显相关性(r=0.046,P>0.05,图1)。T2DM组治疗前,IL-22与FBG、HbA1c呈负相关(r=-0.622,P<0.05;r=-0.520,P<0.05),与FINS、FCP呈正相关(r=0.618,P<0.05;r=0.832,P<0.05,图2)。T2DM组胰岛素泵强化治疗14天后,IL-22与FBG仍呈负相关(r=-0.387,P<0.05),与FCP呈正相关(r=0.820,P<0.05,图3)。
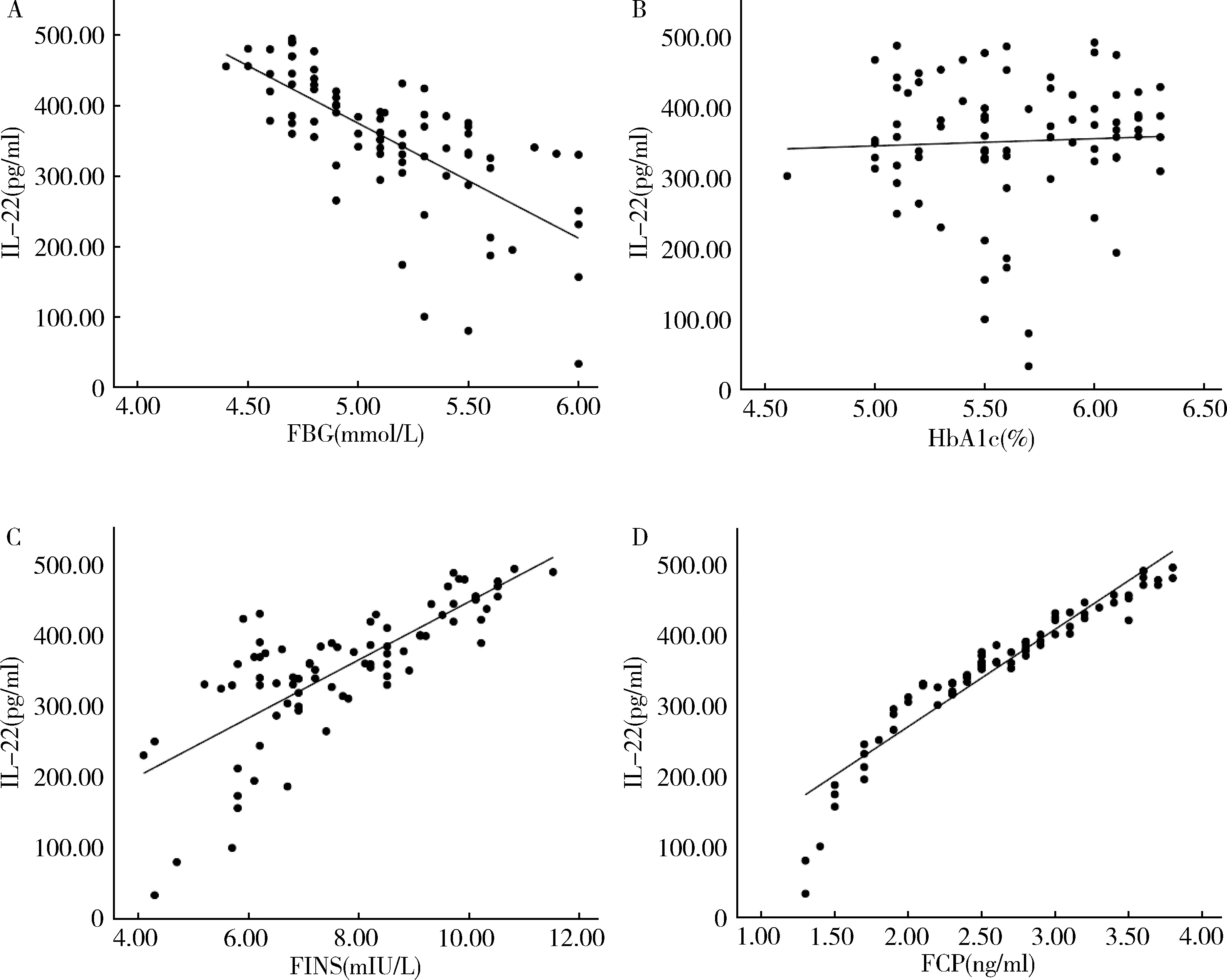
图1 对照组患者血清IL-22水平与FBG、HbA1c、FINS、FCP的相关性分析A.FBG;B.HbAlc;C.FINS;D.FCP
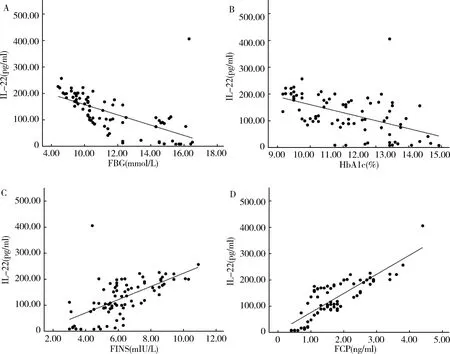
图2 T2DM组患者治疗前血清IL-22水平与FBG、HbA1c、FINS、FCP的相关性分析A.FBG;B.HbAlc;C.FINS;D.FCP
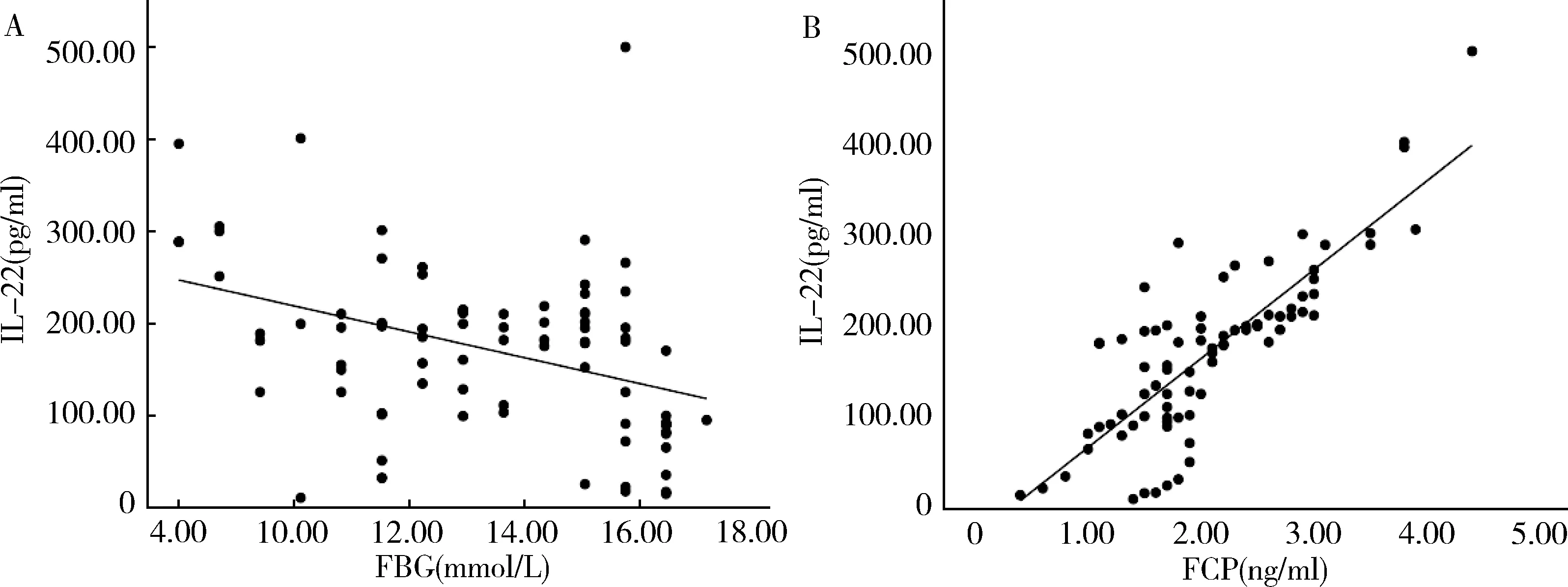
图3 T2DM组患者胰岛素泵治疗后血清IL-22水平与FBG、FCP的相关性分析A.FBG;B.FCP
讨 论
炎症学说认为,T2DM是一种细胞因子参与的慢性炎性疾病,而抗炎治疗可改善T2DM患者血糖及胰岛β细胞功能[6]。IL-22是一种新型细胞因子,属于白介素-10家族的成员,胰腺、肝脏、肠道等组织中均有高度表达,具有抗炎特性,通过与IL-22受体结合发挥生物学作用[7]。研究表明,IL-22途径可能是T2DM患者进行治疗干预的新靶标[8]。IL-22治疗能够促进糖尿病伤口的愈合,对治疗糖尿病性溃疡有一定潜力[9]。越来越多的研究表明,IL-22可以改善糖尿病患者的胰岛素敏感度并保护β细胞免受氧化和内质网应激,从而改善血糖控制[11,12]。因此,探讨血清IL-22在T2DM患者中的表达以及与胰岛β细胞功能的关系具有重要意义。
本研究比较了T2DM组和对照组血清IL-22水平,发现T2DM组患者血清IL-22水平显著低于对照组,短期胰岛素泵强化治疗后,T2DM组血糖显著下降,血清IL-22水平显著上升,但仍低于对照组,说明初诊T2DM患者血清中IL-22呈低表达。Asadikaram等[4]分别检测了115例初诊T2DM患者(第1组)、434例病程2年以上T2DM患者(第2组)及104例健康对照组血清IL-22水平,结果证实第1组和第2组血清IL-22水平明显低于健康对照组。Wang等[13]研究发现,血清IL-22水平在糖尿病肾脏病变患者中明显降低,随着病情进展,IL-22水平降低更显著。另外Shen等[14]研究关于IL-22水平与汉族人群糖尿病前期和T2DM的相关性发现,IL-22在糖尿病前期和T2DM患者中呈低表达,IL-22水平与血糖、BMI等糖尿病危险因素呈负相关,这与本研究结果一致。
本研究的相关性分析显示,T2DM组和对照组IL-22均与FBG呈负相关,与FINS、FCP呈正相关,T2DM组经过短期胰岛素泵强化治疗后,即使IL-22较前明显上升,但与FBG仍呈负相关,与FCP仍呈正相关。T2DM组IL-22与HbA1c呈负相关,而对照组中IL-22水平与HbA1c无显著相关性,笔者分析可能是HbA1c在健康体检人群中个体差异性不明显导致。
初诊T2DM患者受“糖毒性”及血糖波动的影响,体内氧化应激与炎性反应加剧,胰岛β细胞功能受损[15]。短期胰岛素强化治疗初诊伴有高血糖的T2DM患者,能快速、安全、有效地解除“糖毒性”对胰岛β细胞的破坏,修复或改善胰岛β细胞功能。IL-22在防止β细胞氧化应激和促进β细胞再生中起关键作用。Hasnain等[12]研究证明,IL-22是胰腺胰岛氧化和内质网应激的强大内源性旁分泌抑制因子,其上调超氧化物歧化酶-2、谷胱甘肽过氧化酶-5等抗氧化基因及下调铁蛋白重链-1、一氧化氮合酶-2等氧化应激诱导基因,抑制胰岛β细胞中亚硝酸盐与活性氧的产生与蓄积,减少炎性因子的产生,从而调节β细胞胰岛素的生物合成和分泌。由于早期胰岛β细胞功能的损伤是可逆的,所以当高血糖状态下β细胞功能受损且被抑制时,IL-22表达下降,胰岛素强化治疗后β细胞功能得以改善,IL-22水平也逐渐上升。因此笔者在T2DM组观察到了IL-22与FBG、HbA1c呈负相关,T2DM组和对照组中IL-22与FINS、FCP均呈正相关。
综上所述,初诊T2DM患者血清IL-22水平明显降低,短期胰岛素泵强化治疗后血清IL-22水平上升,胰岛β细胞功能有所恢复,提示血清IL-22水平与胰岛β细胞功能受损存在相关性,可能对胰岛β细胞功能受损有预测价值。但由于本研究临床干预时间较短,未检测T2DM组胰岛素泵治疗后的HbA1c水平和FINS水平,不能反映较长时间内IL-22与血糖水平及胰岛β细胞功能的关系,这也是本研究的不足之处。今后笔者将延长观察时间并扩大样本量,对IL-22进行深入研究,为今后T2DM及其并发症的防治提供新的临床依据。
